Метиламин как сделать
Обновлено: 05.07.2024
Реактивы:
Бромистый этилен. 28,2 г (0,15 моля)
Аммиак 25%-ный. 230 мл (30 моля)
Сернокислая медь; едкое кали; соляная кислота; спирт; едкий натр; натронная известь
В полулитровую толстостенную бутылку *1 помещают бромистый этилен и аммиак, добавляют 3 г сернокислой меди и плотно закупоривают бутылку резиновой пробкой, которую привязывают к бутылке бечевкой или проволокой.
Бутылку помещают в водяную баню, нагревают ее до 75-80° и выдерживают при этой температуре, периодически (примерно через каждые 5 мин.) энергично перемешивая ее содержимое (при взбалтывании бутылку следует обвертывать полотенцем во избежание поранения осколками, если бутылка лопнет от развиваемого аммиаком давления и от неравномерного нагревания). Если перемешивание производится достаточно часто и энергично, реакция заканчивается примерно через 2 часа. Признаком конца реакции является полное растворение бромистого этилена.
По охлаждении бутылку вскрывают, содержимое ее переливают в фарфоровую чашку и упаривают почти досуха. Остаток растворяют в 85 мл воды, прибавляют раствор 23 г едкого кали в 85 мл воды и вновь нагревают на водяной бане до полного удаления аммиака (запах!). По удалении аммиака упаренный примерно до 60 мл раствор переносят в небольшую круглодонную колбу и отгоняют этилендиамин, нагревая колбу на сетке. Отгонку ведут почти досуха, затем дают колбе остыть, прибавляют 25 мл воды и вновь отгоняют почти досуха. Дистиллят, имеющий щелочную реакцию, нейтрализуют соляной кислотой (концентрированную соляную кислоту разбавляют водой в два раза) до слабокислой реакции (по лакмусу), на что требуется около 28 мл разбавленной кислоты. Нейтрализованную жидкость фильтруют, упаривают на водяной бане до начала кристаллизации и дают охладиться.
Выпавшие игольчатые кристаллы солянокислого этилендиамина, обладающие серебристым блеском, отсасывают и промывают небольшим количеством спирта, а маточный раствор вновь упаривают до начала кристаллизации. Через несколько часов после охлаждения выпавшие кристаллы отсасывают, промывают небольшим количеством спирта и присоединяют к ранее полученной порции. Маточный же раствор упаривают еще раз до состояния сиропа, прибавляют равный объем спирта, охлаждают, отсасывают выпавшие кристаллы и промывают их спиртом.
Для выделения свободного этилендиамина 10 г его соли смешивают с 11 г едкого кали. Полученную массу растирают с 10-12 г натронной извести и переносят в реторту. Нагревая реторту на голом огне, отгоняют свободный этилендиамин. Вследствие гигроскопичности едкого кали и натронной извести этилендиамин получается влажным. Его высушивают сплавленным едким кали, перегоняют еще раз и получают чистый гидрат этилендиамина.
Для характеристики этилендиамина его переводят в пикрат; он образуется при взаимодействии растворов солянокислого этилендиамина и пикриновой кислоты в присутствии небольшого количества уксуснокислого натрия. Полученный труднорастворимый осадок отфильтровывают, хорошо промывают водой и перекристаллизовывают из спирта.
Гликоколь (глицин, аминоуксусная кислота) получается при взаимодействии монохлоруксусной кислоты с концентрированным водным раствором аммиака:
Для отделения гликоколя от хлористого аммония можно воспользоваться различной растворимостью этих веществ в метиловом спирте или же перевести гликоколь в малорастворимую медную соль. После перекристаллизации медную соль гликоколя разлагают сероводородом и выделяют свободный гликоколь.
Реактивы:
Монохлоруксусная кислота. 19 г (0,2 моля)
Аммиак 25%-ный. 250 мл (около 3 молей)
Сернокислая медь; едкий натр; сернокислый алюминий; сероводород (из аппарата Киппа)
Растворяют монохлоруксусную кислоту в 20 мл воды и полученный раствор при тщательном перемешивании приливают к раствору аммиака, находящемуся в полулитровой колбе. Прилив кислоту, колбу закрывают пробкой и оставляют стоять в течение 24 час. Затем жидкость переливают в фарфоровую чашку и выпаривают на водяной бане до исчезновения запаха аммиака. Упарив аммиак, прибавляют к жидкости свежеосажденную окись меди *2 , кипятят около 10 мин., фильтруют горячий раствор и упаривают его на водяной бане до начала кристаллизации. Оставляют стоять на ночь, а на следующий день выделившиеся кристаллы медной соли гликоколя отсасывают и перекристаллизовывают из небольшого количества горячей воды.
Для выделения свободного гликоколя медную соль растворяют в горячей воде, прибавляют немного свежеосажденного и промытого гидрата окиси алюминия *3 и пропускают сероводород до полного осаждения меди. Раствор кипятят несколько минут и отфильтровывают сернокислую медь. Фильтрат упаривают на водяной бане до малого объема и оставляют стоять для кристаллизации. Выделившиеся кристаллы отсасывают, отжимают между листами фильтровальной бумаги и высушивают.
Освободить гликоколь от примеси хлористого аммония можно также обработкой метиловым спиртом, в котором хлористый аммоний растворяется значительно лучше гликоколя. Для этого раствор упаривают до начала кристаллизации, растворяют кристаллы прибавлением небольшого количества воды и приливают метиловый спирт до тех пор, пока не перестанет выпадать осадок. Ставят на несколько часов на лед, отсасывают выделившийся гликоколь и промывают метиловым спиртом. Кристаллы растворяют в небольшом количестве воды, снова осаждают прибавлением метилового спирта, охлаждают и оставляют стоять. Выпавшие кристаллы отсасывают, промывают метиловым спиртом и высушивают.
Продукт, растворенный в воде, слегка подкисленной азотной кислотой, не должен давать мути с раствором азотнокислого серебра.
*2 Для получения окиси меди растворяют в воде 30 г сернокислой меди, нагревают почти до кипения, осаждают едким натром и промывают декантацией до исчезновения реакции на серную кислоту с хлористым барием.

Метиламин (монометиламин, аминометан или сокращенно MMA) – это соединение органического происхождения, являющееся производным аммиака, типичный первичный амин алифатического ряда. В нормальных условиях выглядит как не имеющая окраса газообразная среда с аммиачным запахом. Хорошо растворяется в воде и орган. растворителях. Взаимодействуя с кислотами, формирует соли, с альдегидами и ацеталями – Шиффовые основания, с эстерами и ацилхлоридами – амиды. Кроме безводной газовой формы, выпуск этого вещества возможен в виде раствора, водного, спиртового (на основе метанола/этанола) или тетраметиленоксидного.
Молярная масса – 31,1 г/моль, плотность – 0,9 г/см 3 . Термосвойства: t плавления – -94 °C, t кипения – -6 °C, t вспышки – 8 °C. Формула: CH5N.
Получение
Реакция, с помощью которой производят монометиламин в промышленных масштабах, предвидит использование метанола и аммиака, а также обеспечение большого температурного режима (370-430 °C) и давления 20-30 бар. Процесс осуществляется в газофазе при наличии контактного цеолитного катализатора. В результате формируются дополнительно побочные продукты (вода, ди- и триметиламин). Чтобы получить очищенный метиламин, выполняют многоразовую перегонку.
Это не единственный из возможных способов синтеза. Хорошая альтернатива ему – взаимодействие водного раствора метаналя (формалина) и хлорида аммония в процессе нагрева. И как вариант для лабораторного получения – перегруппировка по Гофману ацетамида, получаемого, в свою очередь, при нагреве совокупности ледяная уксусная кислота + карбамид.
Применение
Метиламин – это вещество, нашедшее немалое применение в различных пром. направлениях: в военной отрасли, фотоиндустрии, фармацевтике, аграрном комплексе и т.д. С его участием создают растворители, красители и ПАВ, фотоматериалы и лекарства (кофеин, теофиллин). Оно входит в состав инсектицидов и гербицидов. Выступает промежуточным звеном при изготовлении большого перечня соединений.
Далее – детальнее о главных сферах использования:
- сельское хозяйство. Здесь метиламин используют при изготовлении метам-натрия – почвенного стерилизатора и фумиганта, наиболее активно применяющегося для картофельных и томатных насаждений, а также в садоводстве;
- каталитический синтез. Может служить как непосредственно катализатором (например, уретановым), так и сырьем для получения других каталитически действующих компонентов;
- производство взрывчатки. Подобная гелю взрывчатка, созданная из аминометана, востребована в горнодобыче. Отмечают ее простоту применения и безопасность;
- получение топливных добавок. Задача данного вещества – уменьшить точку замерзания топлива в реактивных двигателях;
- нефтегазовая отрасль. метиламин – источник важнейших для данной отрасли материалов МДЭА и НMЭA, имеющих огромное значение для переработки природного газа и нефти;
- медицина. Пожалуй, основная сфера применения рассматриваемого соединения. Здесь с его помощью создают приличный перечень лекарств, в частности антидепрессантов, противосудорожных и гормональных препаратов, а также адреналин, эфедрин, неосинефрин, ванедрин и др.;
- фотохимия. Выступает сырьевым компонентом для получения различных фотохимикатов;
- изготовление растворителей. Монометиламин используется в этом направлении очень активно. С его участием создают полярные апротонные, реакционные, экстракционные и спиннинг растворители.
Вместо заключения
Метиламин может раздражать глаза, кожу и органы дыхания. При вдыхании несет опасность ЦНС и может даже привести к смерти. Так что используйте эту субстанцию, где нужно, но обязательно соблюдайте технику безопасности.
Предварительно учащиеся знакомятся с запахом метиламина. Для этого в пробирке или на стекле к небольшой щепотке хлористоводородного метиламина они прибавляют 5–7 капель концентрированного раствора щелочи. Отмечают сходство запаха выделяющегося метиламина с запахом аммиака.
Для демонстрации опытов с метиламином в небольшую колбочку с отводной трубкой и капельной воронкой помещают 2–3 г.соли, в капельную воронку наливают концентрированный раствор щелочи. Метиламин получают, прибавляя понемногу из воронки щелочь к взятой соли. С метиламином проделывают следующие опыты:
а) Пропускают выделяющийся газ в воду, подкрашенную фиолетовым или красным лакмусом. Лакмус синеет. Делают заключение о том, что не только по запаху метиламин имеет сходство с аммиаком, но и по химическим свойствам (щелочные свойства водного раствора). Составляется уравнение гидратации метиламина.
в) К отводной трубке колбы подносят открытую склянку с концентрированной соляной кислотой или палочку, смоченную кислотой. Образуется густое облако дыма хлористоводородной соли (черный фон!). Параллельно ставят опыт с аммиаком. Составляют уравнение реакции солеобразования и, проводя далее аналогию с аммиаком и солями аммония, объясняют реакцию получения амина из соли (см. выше).
г) Чтобы показать отличие метиламина от аммиака, демонстрируют горючесть метиламина, поджигая газ у отводной трубки колбы. Учащиеся знают, что аммиак на воздухе не горит. Для большей убедительности над пламенем горящего метиламина помещают стакан, сполоснутый известковой или баритовой водой. Появление мути на стенках свидетельствует о наличии углерода в горящем веществе (чего нет в аммиаке) и о принадлежности его к органическим соединениям.
Получение метиламина из ацетамида. Для получения метиламина и постановки опытов с ним можно воспользоваться реакцией амида уксусной кислоты с хлорной известью:

В маленькую колбочку с отводной трубкой помещают около 3 г ацетамида и двойное количество смеси хлорной извести с гидроокисью кальция, замешанной на воде. Вещества перемешивают и нагревают. Выделяется газообразный метиламин. С ним проводят опыты, как указано выше (растворение в воде, окраска лакмуса, горение и т.д.). Уравнение реакции образования метиламина с учащимися не разбирается.
Ацетамид, необходимый для опытов, может быть синтезирован учащимися в химическом кружке.
Получение ацетамида. Ацетамид может быть получен взаимодействием карбоната аммония и уксусной кислоты:

В круглодонную колбу наливают 15 г.уксусной кислоты и прибавляю: небольшими порциями 8 г карбоната аммония (выделение СО2). Колбу закрывают пробкой с вертикальным воздушным холодильником и нагревают около часа до слабого кипения. Затем содержимое переливают в колбу для перегонки, закрывают колбу пробкой с термометром, присоединяют небольшой нисходящий воздушный холодильник и медленно производят перегонку, пока температура не поднимется до 160° С. При этой температуре удаляют холодильник и отводную трубку колбы помещают непосредственно в приемник. Продолжают перегонку до 200° С. Затем меняют приемник и после этого отгоняют ацетамид в интервале температур 200–220° С. Полученный продукт без очистки можно применять для получения метиламина. Ввиду гигроскопичности ацетамид нельзя держать на открытом воздухе.
Анилин
Опыты с анилином должны показать, что это вещество принадлежит к классу аминов, имеет свойства основания и в то же время отличается от алифатических (жирных) аминов по степени проявления основных свойств. Большое внимание также должно быть уделено получению анилина из нитробензола ввиду особого исторического значения этой реакции и ее роли в современной промышленности. Ввиду ядовитости паров анилина опыты следует проводить в вытяжном шкафу.
Отношение анилина к индикаторам. К 100 мл воды в демонстрационном стакане прибавляют 1 мл анилина и взбалтывают смесь стеклянной палочкой. Половину раствора отливают в другой такой же бокал. После этого к одной половине раствора приливают раствор фенолфталеина, к другой – фиолетовый раствор лакмуса. Окраска индикаторов не изменяется.
Взаимодействие анилина с кислотами. После того как показано, что анилин не действует на индикаторы, т.е. не обладает щелочными свойствами, возникает вопрос о том, обладает ли вообще он свойствами оснований, вступает ли он, например, вреакции солеобразования с кислотами.
1. В пробирку с 5 мл воды учащиеся наливают около 0,3 мл анилина. Смесь взбалтывают. Убеждаются, что анилин почти не растворился в воде. Добавляют по каплям концентрированную соляную кислоту. Анилин растворяется. Составляют уравнение реакции образования хлористоводородного анилина.
К раствору соли анилина добавляют по каплям концентрированный раствор щелочи. Снова выделяется анилин в виде маслянистой жидкости. Составляют уравнение реакции.
При проведении опыта следует пользоваться концентрированными растворами кислоты и щелочи с той целью, чтобы не вводить большого количества воды, иначе из-за частичной растворимости анилина (1 г анилина растворяется в 30 мл воды) выделение его будет мало заметно.
2. В демонстрационную пробирку наливают 5 мл анилина и затем примерно такой же объем концентрированной соляной кислоты или 50-процентной серной кислоты. Дают некоторым учащимся убедиться, что проходит экзотермическая реакция. Охлаждают пробирку в струе холодной воды. Выделяются кристаллы соли. Растворяют соль по возможности в небольшом количестве воды (воду добавляют небольшими порциями и пробирку встряхивают). Если остался непрореагировавший анилин, отфильтровывают от него раствор, а к раствору соли добавляют концентрированный раствор щелочи. Выделяется свободный анилин.
Тем или другим из этих опытов устанавливается, что анилин является основанием; отсутствие же действия его на индикаторы говорит о том, что он основание более слабое, чем жирные амины.
Так как по составу молекул жирные амины и анилин отличаются тем, что вместо предельного радикала здесь имеется бензольное ядро, то, очевидно, что ослабление основных свойств аминогруппы обусловлено влиянием ароматического радикала – С6Н5.
Взаимодействие анилина с бромной водой. Как известно, влияние атомов друг на друга в молекуле взаимно. Если бензольное кольцо влияет на аминогруппу в анилине, ослабляя проявление ею свойств основания, то можно ожидать, что и бензольное ядро под влиянием этой группы будет обладать свойствами, отличными от свойств бензола. С подобным изменением свойств ядра учащиеся уже встречались на примере фенола.
Встает вопрос, не ослабляет ли аминогруппа связь атомов водорода с ядром, подобно тому как эту связь ослабляет гидроксильная группа в феноле, и не будет ли анилин реагировать с бромной водой, как реагирует с ней фенол.
1. В колбе или демонстрационной пробирке растворяют при встряхивании в 10 мл воды 1 мл анилина. К полученному раствору (эмульсии) добавляют бромную воду до образования белого осадка.
Осадок представляет собой триброманилин:

Необходимо, чтобы растворы анилина и брома были достаточно концентрированными. Вместо раствора анилина можно воспользоваться раствором его соли.
Окисление анилина. Анилин сравнительно легко окисляется в разнообразные продукты. При окислении анилина хромовой смесью и некоторыми другими окислителями образуется так называемый черный анилин, применяемый для окраски в черный цвет тканей, дерева кожи.
1. В демонстрационной пробирке к 3–4 мл водной эмульсии анилина приливают 10–12 мл хромовой смеси. Жидкость взбалтывают и подогревают. Вначале она приобретает зеленую окраску, затем синеет, при дальнейшем нагревании образуется осадок черного анилина. Характер осадка выявляется при сильном взбалтывании смеси в пробирке.
2. В 100 мл воды растворяют 2 г бихромата калия К2Сr2О7 и 1 мл концентрированной серной кислоты. К полученному раствору добавляют 2 г солянокислого анилина или по 1 мл анилина и концентрированной соляной кислоты. Смесь перемешивают стеклянной палочкой. В образующийся раствор быстро вносят кусок хлопчатобумажной ткани. Краситель с тканью нагревают, затем ткань достают, отжимают валиком на гладкой поверхности и развешивают на стеклянных палочках.
3. Готовят раствор солянокислого анилина, приливая к 50 мл воды 2 мл анилина и 3 мл концентрированной соляной кислоты. К раствору добавляют еще 1 г хлорида аммония. Полученный раствор наносят кисточкой на гладкую поверхность доски.
После того как раствор впитается, таким же способом покрывают дерево вторым раствором, приготовляемым растворением 4 л бертолетовой соли и 6 г медного купороса в 50 мл воды. Бертолетова соль окисляет анилин, и поверхность доски постепенно принимает черную окраску. Хлористый аммоний и медный купорос способствуют ускорению процесса окисления и получению плотной и прочной окраски. После высыхания поверхности на нее еще несколько раз наносят попеременно первый и второй растворы.
Реакция анилина с хлорной известью. При взаимодействии анилина с хлорной известью даже при очень сильных разбавлениям образуется характерное фиолетовое окрашивание. Хлорная известь поэтому может служить реактивом на анилин.
В цилиндр или стакан наливают 200–300 мл воды, растворяют в ней несколько капель анилина и приливают очень немного свежеприготовленного и профильтрованного водного раствора хлорной извести. Образуется фиолетовое окрашивание (белый фон!). Если раствор анилина взят слишком концентрированный, опыт проходит менее наглядно, так как окраска образуется слишком темная. В таком случае смесь растворов следует разбавить водой. Химизм этой реакции с учащимися не рассматривается.
Получение анилина. Современное производство анилина основано на реакции восстановления нитробензола, открытой Н.Н. Зининым.
В школьных опытах получения анилина для ускорения реакции вместо железа используют обычно олово или цинк. Опыт с железом может быть перенесен на практические занятия или в химический кружок и поставлен там не только для иллюстрации основной химической реакции, но и с целью отражения важнейших производственных операций.
1. В колбочку емкостью 100 мл вносят 2–3 капли нитробензола, приливают 1–2 мл концентрированной соляной кислоты и вносят 2–3 маленьких кусочка цинка (или олова). Если реакция пойдет слишком бурно, колбочку охлаждают в струе холодной воды или в стакане с водой. Когда запах нитробензола исчезнет или почти исчезнет, в колбу приливают концентрированный раствор щелочи (30–40-процентной) до тех пор, пока образующийся вначале осадок гидроокиси цинка Zn(ОН)2 ввиду своей амфотерности не растворится при дальнейшем прибавлении щелочи:
Это будет гарантией того, что щелочь выделит анилин из хлористоводородной соли. Чтобы констатировать образование анилина, присоединяют к колбе холодильную трубку и отгоняют около 0,5–1 мл жидкости. Анилин гошпся вместе с парами воды в виде белой эмульсии. Разбавляют дистиллят водой, чтобы анилин растворился, и открывают его с помощью раствора хлорной извести. Одновременно убеждаются, что нитробензол не дает окрашивания хлорной известью.
Получение анилинформальдегидной смолы. Анилин по ряду свойств напоминает фенол (бромирование, нитрование и т.п.). Подобно фенолу он дает высокомолекулярные смолы с формальдегидом (формалином).
 |
В зависимости от соотношения исходных веществ и условий реакции анилинформальдегидные смолы имеют различное строение, например:
Вместо анилина берется насыщенный раствор хлористоводородной его соли, что дает возможность провести реакцию в гомогенной среде и поэтому достаточно быстро.
В небольшой химический стакан наливают 10 мл формалина (40-процентного) и такой же объем заранее приготовленного насыщенного раствора хлористоводородного анилина в воде. В середину стакана тотчас же ставят стеклянную палочку. Образуется густая смола. Палочка прочно удерживается в вертикальном положении. За палочку можно поднять стакан с его содержимым.
Полученная плотная масса имеет резкий удушливый запах от примеси формальдегида.
Продукт обносят по классу или извлекают его из стакана, разламывают на кусочки и на часовых стеклах передают учащимся для ознакомления.
Метиламин, диметиламин и триметиламин – газы, средние члены алифатического ряда – жидкости, высшие – твердые вещества. Между молекулами аминов в жидкой фазе образуются слабые водородные связи, поэтому температуры кипения аминов выше, чем у соответствующих углеводородов.
1. Основной способ получения аминов – алкилирование аммиака, которое происходит при нагревании алкилгалогенидов с аммиаком:
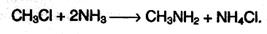
При избытке алкилгалогенида полученный первичный амин также может вступать в реакцию алкилирования, превращаясь во вторичный или третичный амин, например:
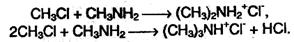
Практически в таких реакциях получается смесь солей первичного, вторичного и третичного аминов, из которой амины выделяют под действием щелочи и разделяют путем перегонки.
2. Первичные амины также получают восстановлением нитросоединений по схеме:
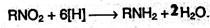
Для восстановления используют сульфид аммония (реакция Зинина), цинк или железо в кислой среде, алюминий в щелочной среде или непосредственно водород в газовой фазе.
3. Первичные амины можно получать восстановлением нитрилов:
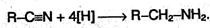
В качестве восстановителя используют алюмогидрид лития LiAlH4.
4. В биологических системах может происходить ферментативное декарбоксилирование аминокислот:
Читайте также:

