Колбы химические своими руками
Добавил пользователь Валентин П. Обновлено: 08.09.2024
При мытье и сушке посуды необходимо помнить следующее:
1. Посуда всегда должна быть чисто вымыта и ополоснута дистиллированной водой.
2. При работе с ершом нужно следить, чтобы нижним концом его не проткнуть дно или не пробить стенку сосуда.
3. При сушке посуды надо следить, чтобы она не загрязнилась.
4. При мытье посуды различными органическими растворителями необходимо экономить последние.
5 Осадки и растворы ценных веществ (иод, серебро, платина, ртуть и др.) при подготовке посуды к мытью нельзя выбрасывать, их следует собирать в отдельные склянки.
7. Концентрированные растворы кислот и щелочей, дурно пахнущие и ядовитые вещества, хромовую смесь металлический натрий и т. п. нельзя выливать или выбрасывать в раковину.
8. Выбирая способ мытья, прежде всего нужно учитывать, каким веществом загрязнена данная посуда.
9. При мытье посуды следует придерживаться правил техники безопасности и санитарии.
10 Все опасные и ядовитые вещества могут отмывать только люди, обученные обращению с такими веществами. Для мытья посуды с такими загрязнениями следует отводить отдельную раковину, помещенную под тягой.
11 Дурно пахнущие загрязнения отмывают только под тягой.
12 Следует соблюдать большую осторожность при использовании для мытья посуды концентрированных щелочей, концентрированных кислот, хромовой смеси и других окислителей.
13 При работе с органическими растворителями следует избегать вдыхания их паров, попадания растворителей на руки и одежду и помнить об огнеопасности многих органических растворителей.
14 По возможности следует механизировать процесс мытья химической посуды.
15 Для отмывания загрязнений применяют наиболее дешевые материалы.
Мытье химической посуды
Умение мыть химическую посуду является той частью лабораторной техники, знание которой обязательно для каждого работника лаборатории.
Химическая посуда должна быть совершенно чиста; без выполнения этого условия работать нельзя.
Для выбора способа мытья посуды в каждом отдельном случае необходимо следующее:
1. Знать свойства загрязняющих посуду веществ.
2. Использовать растворимость загрязнений в воде (холодной или горячей), в растворах щелочей, различных солей или кислот.
3. Использовать свойства окислителей окислять в определенных условиях органические и неорганические загрязнения, разрушать их с образованием легко растворимых соединений.
4. Для мытья могут быть использованы все вещества, обладающие поверхностно-активными свойствами (мыло, синтетические моющие вещества, моющие глины и пр.).
5. Если загрязняющий посуду осадок химически стоек, для удаления его можно применять механическую очистку (при помощи ершей и пр.).
6. Из реактивов для мытья следует применять только дешевые материалы.
Нужно всегда помнить о технике безопасности и возможности несчастных случаев при мытье посуды, особенно если работающий незнаком со свойствами загрязнений Каждый новый работник лаборатории должен быть ознакомлен с правилами техники безопасности.
Удалить загрязнения со стенок посуды можно различными методами: механическими, физическими, химическими, физико-химическими или комбинируя их.
Механические и физические методы очистки посуды
В тех случаях, когда химическая посуда не загрязнена смолой, жировыми и другими не растворяющимися в воде веществами, посуду можно мыть теплой водой. Стеклянная посуда считается чистой, если на стенках ее не образуется отдельных капель и вода оставляет равномерную тончайшую пленку.
Если на стенках посуды имеется налет каких-либо солей или осадок, посуду очищают (предварительно смочив водой) щеткой или ершом и уже затем окончательно моют водой.
При работе с ершом нужно следить, чтобы нижний конец его не ударялся ни о дно, ни о стенки посуды, так как этим концом можно выбить дно или проломить стен ку. Чтобы предотвратить возможность разбивания посуды металлическим концом ерша, на кончик его нужно надеть кусочек резиновой трубки подходящего размера.
Хорошо вымытую в теплой воде посуду обязательно два-три раза споласкивают дистиллированной водой для удаления солей, содержащихся в водопроводной воде.
В раковину нельзя выливать и выбрасывать концентрированные растворы кислот и щелочей, хромовую смесь , дурно пахнущие и ядовитые, вещества, металлический натрий и т. п. Концентрированные кислоты и щелочи необходимо предварительно сильно разбавить или, еще лучше, нейтрализовать во избежание разрушения канализационной сети.
К органическим растворителям относятся: диэтиловый (серный) эфир, ацетон, спирты, петролейный эфир, бензин, скипидар, четыреххлористый углерод и другие растворители. Органические растворители применяют для удаления из посуды смолистых и других органических веществ, которые не растворяются в воде.
Промытую растворителями посуду обрабатывают хромовой смесью или другими окислителями.
Большинство органических растворителей огнеопасны, работать с ними следует вдали от огня. Загрязненные органические растворители нужно собирать каждый в отдельности и время от времени регенерировать их. Регенерация состоит в том, что загрязненный растворитель отгоняют.
Для мытья посуды можно применять и другие вещества, например мыло и особенно 10%-ный раствор тринатрийфосфата, обладающий прекрасными моющими свойствами.
При мытье водой с мылом или тринатрийфосфатом полезно поместить в колбу кусочки чистой фильтровальной или какой-либо другой мягкой бумаги. При встряхивании колбы бумага механически удаляет со стенок приставшие к ним загрязнения.
Совершенно недопустимо применять для очистки посуды песок, так как он царапает стекло. Посуда, имеющая царапины при нагревании, обычно лопается.
Химические методы очистки посуды
Очень часто в лабораториях для мытья посуды применяют хромовую смесь, так как хромовокислые соли в кислом растворе являются сильными окислителями. Для приготовления хромовой смеси в концентрированную серную кислоту добавляют около 5% (от массы серной кислоты) размельченного в порошок кристаллического двухромовокислого калия и осторожно нагревают в фарфоровой чашке на водяной бане до растворения его.
Для приготовления хромовой смеси можно применять также двухромовокислый натрий, который растворяют в воде, а затем в раствор осторожно добавляют серную кислоту.
Смесь готовят из расчета:
Двухромовокислый натрий 6 г
Серная кислота, 1,84 100 мл
При мытье хромовой смесью посуду споласкивают сначала водой, а потом наливают слегка подогретую хромовую смесь до 1/3 - 1/4 объема сосуда и осторожно и медленно смачивают внутренние стенки. После этого хромовую смесь выливают обратно в тот же сосуд, в котором она хранится, причем стараются смочить ею оставшиеся не смоченными стенки посуды и особенно наиболее загрязненные ее края. Слив всю жидкость, посуду оставляют постоять несколько минут, затем ее моют сначала водопроводной водой (лучше теплой), потом дистиллированной. Сильно загрязненную посуду моют хромовой смесью несколько раз.
Труднее всего отмываются загрязнения на горлышках колб. Чтобы отмыть их, хромовую смесь наливают в стакан, опускают в него горло колбы, слегка обогретой (достаточно нагревания рукой), после того как колба охладится, жидкость несколько поднимается внутрь ее. Через одну-две минуты колбу вынимают, дают стечь хромовой смеси, а затем колбу моют водой, как описано выше.
Хромовая смесь служит довольно долго. После длительного употребления ее цвет из темио-оранжевого переходит в темно-зеленый, что служит признаком ее дальнейшей непригодности для мытья. В лаборатории всегда должен быть запас хромовой смеси.
Хромовая смесь очень сильно действует на кожу и одежду, поэтому обращаться с ней следует осторожно.
Неопытные работники при мытье пипеток и трубок часто набирают хромовую смесь в них ртом.
При этом случается, что хромовая смесь засасывается в рот, вызывая ожоги полости рта и порчу зубов. Хромовую смесь следует набирать в пипетку при помощи резиновой груши без баллона. Сжав рукой грушу, чтобы удалить из нее воздух, и закрыв большим пальцем отверстие для поступления воздуха, пипетку опускают в хромовую смесь. Постепенно разжимают руку (большой палец с отверстия не снимать), внутри пипетки образуется разрежение и хромовая смесь поднимается в нее. Набрав полную пипетку и продержав в ней хромовую смесь 1—2 мин, отнимают большой палец от отверстия груши и дают жидкости стечь.
Повторив несколько раз эту операцию, пипетку моют, как обычно,
Пипетки, бюретки и подобные им длинные трубки удобно также мыть хромовой смесью в толстостенном цилиндре такой высоты, чтобы трубки могли быть погружены в него более чем на половину. В цилиндр помещают подлежащие мытью трубки и заливают его почти доверху хромовой смесью. Через некоторое время трубки вынимают и помещают их в цилиндр обратными концами.
В качестве моющего средства можно применять также раствор К2Cr2О7 в концентрированной HNO3. Для приготовления этого раствора 200 г К2Cr2О7 растворяют в 1 л HN03. Такой раствор даже при комнатной температуре по своим моющим свойствам превосходит хромовую смесь и устойчив в течение длительного времени.
Хромовую смесь не применяют, если посуда загрязнена парафином, керосином, воском, минеральными маслами и вообще продуктами перегонки нефти. В этих случаях посуду моют паром или органическими растворителями.
Нужно избегать попадания в хромовую смесь спиртов— этилового или метилового, тотчас окисляющихся и восстанавливающих Cr2О7 2-. -ион до Сг3+. В результате этого раствор приобретает зеленую окраску и делается непригодным для дальнейшего применения.
Если посуда загрязнена солями бария, мыть ее хромовой смесью, содержащей серную кислоту, нельзя, так как получающийся сернокислый барий образует на стенках посуды трудно удаляемый осадок.
Нужно заметить, что хромовую смесь полезно применять слегка подогретой (до 45—50° С), тогда она действует сильнее.
Подогреть хромовую смесь можно по-разному:
1) отлив некоторое количество хромовой смеси в колбу, ее подогревают на горячей водяной бане;
2) осторожно добавляют в хромовую смесь немного воды и концентрированной серной кислоты;
3) можно также отмываемый предмет предварительно сполоснуть горячей водой.
Если хромовая смесь попадает на кожу рук или одежду, их следует прежде всего обмыть большим количеством воды,затем раствором соды (двууглекислого натрия) или аммиака.
Хорошим средством для мытья посуды является 4%-ный раствор марганцево- кислого калия
Раствор марганцевокислого калия — сильный окислитель, особенно когда он подогрет и подкислен серной кислотой; его наливают в посуду, которую нужно предварительно вымыть горячей водой и вычистить ершом или щеткой. Затем тонкой струей добавляют немного концентрированной серной кислоты, что вызывает разогревание, вполне достаточное, чтобы все загрязнения на стенках быстро окислились. Серную кислоту следует брать в таком количестве, чтобы после добавления ее температура раствора была около 50—60° С. Обычно на 100 мл раствора марганцевокислого калия бывает достаточно добавить 3—5 мл концентрированной серной кислоты.
Нужно брать именно серную кислоту и ни в каком случае не соляную, так как последняя окисляется марганцевокислым калием с образованием свободного хлора.
Иногда после мытья посуды раствором марганцево- кислого калия на стенках ее появляется бурый налет; его можно удалить, споласкивая посуду 5%-ным раствором кислого сернокислого натрия (NaHS03), растворами закисного сернокислого железа (FeSO4), соли Мора или органических кислот, лучше всего щавелевой. После этого посуду моют водой.
При работе с подкисленным раствором марганцевокислого калия следует придерживаться тех же приемов мытья и мер предосторожности, которые описаны выше для хромовой смеси.
Отработанный подкисленный раствор марганцевокислого калия обычно выливают и повторно не используют. Если же применялся неподкисленный раствор, его можно использовать несколько раз.
Подкисленным раствором марганцевокислого калия очень хорошо очищаются ртутные насосы, трубки барометров и нр.
Иногда можно применять раствор марганцевокислого калия, в который добавляют какую-нибудь щелочь. Такой раствор является более мягким окислителем, и по еле мытья им стенки посуды покрываются бурым налетом двуокиси марганца, удаление которого проводится одним из приемов, описанных выше.
- Мытье смесью соляной кислоты и перекиси водорода.
Очень удобным и доступным окислителем, который с успехом можно применять для мытья химической посуды, является смесь Комаровского, состоящая из равных объемов 6 н. раствора НС1 и 5—6%-ного раствора перекиси водорода. Эта смесь действует очень энергично, особенно при небольшом подогревании, при этом она не влияет на стекло, чего нельзя сказать о хромовой смеси пли подкисленном растворе марганцевокислого калия. Вместо соляной кислоты можно пользоваться и уксусной.
Для мытья смесь наливают в слегка подогретую посуду (мерную посуду нагревать нельзя) или же подогревают смесь до 30—40° С. Обмывают стенки посуды смесью, затем выливают ее в ту же посуду, в которой она хранилась, для повторного использования. После этого посуду моют водой, как обычно.
- Мытье серной кислотой и растворами щелочей.
Когда посуда загрязнена смолистыми веществами, нерастворимыми в воде, а также в тех случаях, когда в лаборатории нет хромовой смеси, посуду можно мыть концентрированной серной кислотой или концентрированным (до40%) раствором щелочи (NaOH, КОН). Смолы большей частью растворяются или в кислоте, или в щелочи. Загрязненный сосуд заполняют на 1/4 щелочью (если смолы много, жидкость наливают так, чтобы вся смола была покрыта ею, но сосуд можно было бы свободно встряхивать). Когда смолы много, операцию повторяют несколько раз.
Продолжительность обработки кислотой или щелочью зависит от особенностей смолы. В одних случаях смолу можно удалить, встряхивая колбу в течение 5—10 мин, в других же случаях приходится отмывать смолу в течение нескольких часов, периодически встряхивая колбу.
Обращаться с концентрированными серной кислотой и щелочью нужно осторожно; кислоту нельзя выливать в раковину. Загрязненную смолой серную кислоту или щелочь следует сливать в глиняные или стеклянные банки, которые всегда должны стоять около водопроводной раковины. Сливать в одну банку кислоту и щелочь нельзя, так как при этом будет происходить нейтрализация, сопровождающаяся сильным разогреванием, вследствие чего содержимое банки может разбрызгиваться.
Кроме растворов едких натра или кали, полезно пользоваться и менее сильными щелочами, например известковым молоком, что, в частности, очень удобно для мытья посуды, загрязненной керосином. Для этого в посуду наливают раствор известкового молока (5—10%) и энергично встряхивают. Повторяя операцию два-три раза, очищают посуду от следов керосина. Много известкового молока брать не следует. На колбу емкостью 1 л достаточно взять 100—200 мл.
После обработки известковым молоком посуду моют теплой водой.
Смешанные способы мытья посуды
Наилучшим примером сочетания различных способов очистки является мытье бюреток. Процесс мытья бюретки очень кропотливый и трудоемкий.
Сначала бюретку, если это необходимо, тщательно протирают ершом, на ручку которого надета резиновая трубка, чтобы не царапать стекло бюретки. Затем вынимают кран, стирают с него и с муфты крана вазелин или другую смазку, которыми всегда смазывают кран. Хорошо очищенный кран вставляют в муфту и прикрепляют резиновым кольцом, чтобы во время мытья он не выпал и не разбился. После этого бюретку, в зависимости от загрязнения, моют кислотой, растворами щелочей, насыщенным раствором марганцевокислого калия, подкисленным серной кислотой или хромовой смесью. Эту операцию повторяют, но нескольку раз, сливая и вновь наливая в бюретку моющий раствор. В отдельных случаях можно влить раствор в бюретку, закрепленную в штативе, и оставить на ночь, подставив под бюретку стакан на тот случай, если кран начнет протекать. Затем бюретку промывают водопроводной водой и ополаскивают несколько раз дистиллированной водой, прочищают кран и муфту фильтровальной бумагой, смазывают их тонким слоем вазелина или другой смазкой и вставляют кран в муфту.
В хорошо вымытой бюретке мениск всегда имеет правильную вогнутую поверхность и на стенках не образуются капли.
Для некоторых работ требуется особенно чистая посуда.
Стекло и кварц, из которых делают лабораторную посуду, обладают способностью сорбировать. многие ионы.
Например, после мытья хромовой смесью кварцевой или стеклянной посуды на стенках ее остаются ионы хромовой кислоты. На стенках посуды могут также сорбироваться многие ионы металлов, например Pb2+, Си2+, Zn2+, Cd2+ и пр. Присутствие всех этих ионов может вызвать ошибки при аналитических определениях. Поэтому вымытую посуду, в которой были растворы, содержащие ионы тяжелых металлов, после ополаскивания водой следует обмыть 5%-ным раствором комплексона III (Трилон Б), а для удаления хромат-ионов — ополоснуть разбавленным раствором щавелевой кислоты (~0,01 н. раствор). Затем посуду еще раз хорошо обмывают водой, еще раз ополаскивают комплексоном III (Трилон Б) и заканчивают мытье, как обычно.
Для аналитических работ чистота посуды имеет особо важное значение. Нередко ошибки в определениях могут происходить именно вследствие недостаточно чисто вымытой посуды.
Сушка химической посуды
Иногда вымытая посуда должна быть хорошо высушена. Сухая посуда нужна, когда работу необходимо проводить в отсутствие следов влаги (очень многие органические реакции).
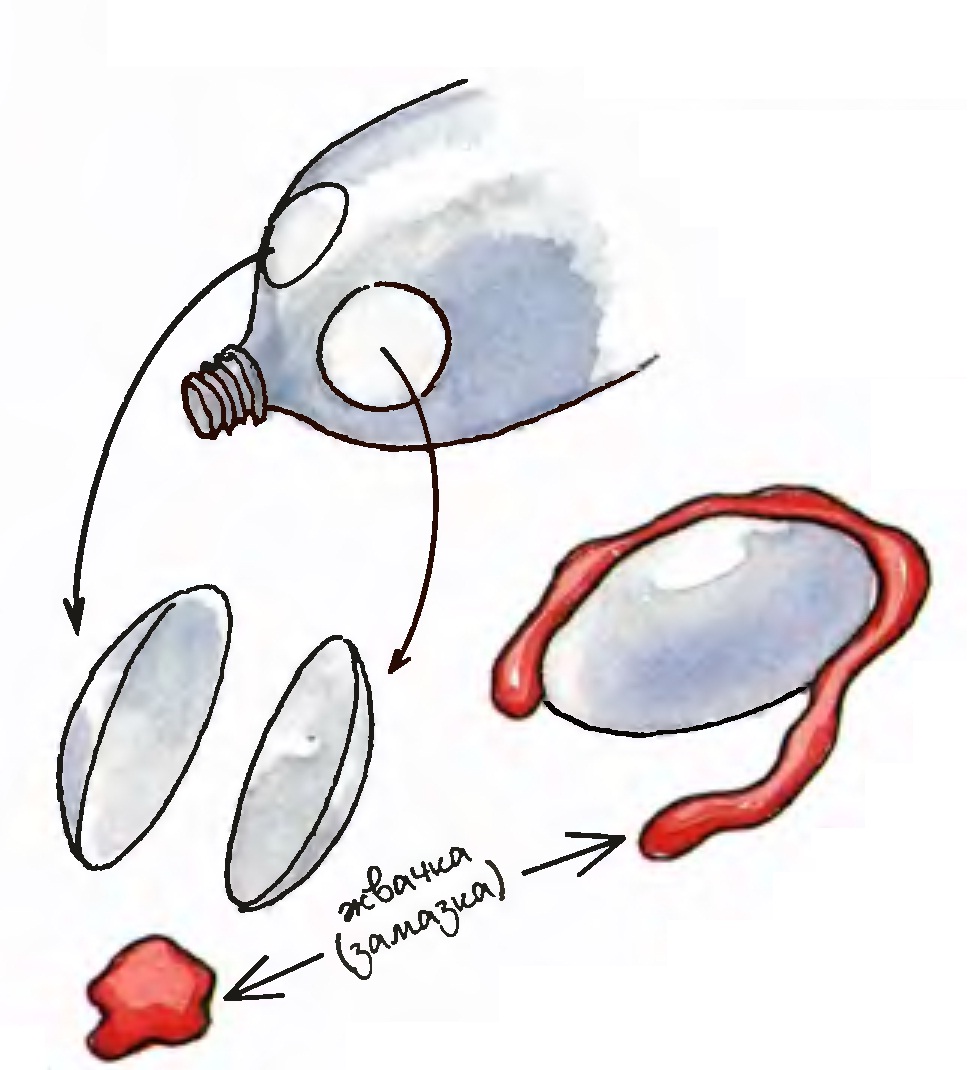
Для проведения этого опыта в одной скляночке готовят ~100мл слабо-желтого (3-процентного) раствора хлорида железа(|||), а вдругой столько же 3-процентного раствора роданида калия (другое название - тиоцианид калия). В принципе можно брать любую соль, содержащую роданид, но калий роданид наиболее доступный. Также заранее готовят раствор фторида натрия (калия) и смачивают им небольшую тряпочку.
Для демонстрации этого опыта удобно использовать детский пластмассовый нож, но также можно взять тупой кухонный нож с возможно более широким лезвием. Ваткой, смоченной раствором хлорида железа(|||) протирают ладонь, а нож смачивают раствором роданида калия. При этом надо стремиться к тому, чтобы на ноже и на ладони осталось как можно больше соответствующих растворов. Если теперь провести ножом по ладони, то на пол обильно капают капли "крови". После окончания опыта ладонь протирают тряпочкой, смоченной раствором фторида натрия и тщательно моют руки.
В основе этого опыта лежит взаимодействие ионов Fe3+ с ионами SCN -, при этом образуется кроваво-красное комплексное соединение - роданид железа(|||):
FeCl3 + 3KSCN => 3KCl + Fe(SCN)3
Примечание: роданид калия - очень токсичное вещество, поэтому соблюдайте осторожность при работе с ним.
Примечание 2: если вы собираетесь показать этот опыт родителям, то предупредите их, пожалуйста, о том, что это всего лишь опыт, т. к . при правильном проведении он очень реалистичен.
Дым без огня
Берутся 2 конические колбы с горлышками одного диаметра, одну из них наполняют аммиаком, другую - хлороводородом. Не забудьте, какой газ тяжелее, а какой - легче воздуха! Затем колбы соединяют горлышками и переворачивают, после чего можно наблюдать белый дым образовавшегося хлорида аммония.
Мгновенная кристаллизация
Для проведения этого опыта готовят насыщенный при 80С раствор английской соли (MgSO4*7H2O) и осторожно, не встряхивая, медленно охлаждают его до комнатной температуры.
Затем вносят в раствор несколько крупинок английской соли и наблюдают мгновенное выпадение крупных кристаллов. Этот опыт можно демонстрировать в виде фокуса, предварительно положив затравочные кристаллы на край декоративного флакона с раствором, и затем незаметно смахнув их в раствор "волшебной палочкой" - обычным карандашом
"Заживление раны".
Кожу руки обильно смачивают "йодом" (слабый раствор хлорного железа), якобы для дезинфекции. После этого набирают в тонкую трубочку раствор роданида калия и проводят концом этой трубочки по смоченному месту (для усиления эффекта опыта можно использовать тупой нож). На руке появляется "кровоточащая рана", которую легко смывают затем обычной водой, а руку вытирают насухо полотенцем.
Примечание. Реакцию образования раствора роданида железа (III) можно использовать для получения хорошей имитации крови.
"Золотой дождь."
Существует множество веществ с сильной температурной зависимостью растворимости. Именно на этом явлении и основан данный опыт. Для проведения этого опыта необходимо взвесить равные количества ацетата свинца(||) и йодида калия. Я советую по 0,5г. Далее готовят два раствора. В два химических стакана наливают по 50 мл дистиллированной воды. В один добавляют ~1мл столового уксуса (или ~0,2 мл концентрированной уксусной кислоты) и растворяют ацетат свинца. Кислота добавляется для того, чтобы подавить гидролиз ионов Pb2+. Во втором растворяют KI. Затем оба раствора сливают в колбу из огнеупорного стекла объёмом 150мл. При этом происходит реакция двойного обмена между ацетатом свинца и йодидом калия:
Pb(CH3COO)2 + 2KI => 2KCH3COO + PbI2
После смешивания растворов выпадает жёлтый осадок йодида свинца(||). Смеси растворов в колбе необходимо дать отстояться, чтобы осадок осел полностью. После этого с осадка осторожно сливают жидкость и вместо неё доливают 100мл дистиллированной воды. Теперь раствор необходимо нагреть до кипения и кипятить втечении 2-3мин. Осадок должен раствориться полностью.
Если всё было сделано правильно, то после охлаждения раствора выпадет множество золотистых кристалликов, которые при встряхивании колбы будут парить в толще воды. Размер кристалликов очень сильно зависит от скорости охлаждения: чем медленнее охлаждать, тем более крупными и красивыми будут кристаллики. Для большей их прочности перед кипячением в раствор добавляют немного глицерина (~0,5мл на 100 мл раствора).
Фараоновы змеи.
Вы поджигаете небольшую палочку, вспыхивает слегка заметный огонёк и из палочки, извиваясь, начинает выползать чёрно-зелёная пористая масса, по форме напоминающая змею.
Это одна из разновидностей опыта, известного под названием "Фараоновы змеи". Далее будет описана наиболее безопасная разновидность этого опыта, т. к. существует несколько вариаций, но почти во всех используются высокотоксичные соединения ртути. Для того, чтобы провести этот опыт вам понадобятся три довольно доступных вещества: нитрат калия, дихромат калия и сахар. Вот состав смеси:
Все компоненты смеси тщательно растирают в ступке и смешивают. Далее небольшими порциями (буквально по несколько капель) добавляют воду. После каждой новой порции воды смесь тщательно перемешивают. Увлажнение необходимо прекратить тогда, когда смесь будет иметь консистенцию творога. Теперь у вас довольно легко получится скатать из неё палочки диаметром ~5-8мм и длиной около 5см.
Лучше всего проводить этот опыт на керамической плитке или на листе железа.
Примечание1: Этот опыт получится ещё интересней, если из смеси сформировать не палочки, а шарики диаметром ~1-2см. Но поджигать их необходимо с трёх сторон сразу, тогда получится не змея, а настоящий дракон.
Примечание2: Пористая масса, которая составляет "змею", - это большей частью токсичный оксид хрома(|||), так что прорводите этот опыт очень осторожно и обязательно вымойте руки после его проведения
Обугливание сахара
В химический стакан ёмкостью 150мл насыпьте 40гр растёртого в порошок сахара и слегка смочите его 3-4мл воды. Теперь в полученную массу добавьте 20-25мл концентрированной серной кислоты и размешайте смесь стеклянной палочкой. Палочку не вынимайте. Через несколько минут смесь потемнеет, температура повысится, и из стакана начнёт "выростать" чёрная пенообразная масса. Это пористый уголь, появление которого объясняется дегитратацией сахара серной кислотой:
C12H22O11 => 12C + 11H2O
Кроме этого происходит восстановление серной кислоты углём:
2H2SO4 + C => CO2 + 2SO2 + 2H2O
Получение "золота".
Готовят равные объемы 3%-ного раствора иодида калия и 4%-ного раствора ацетата свинца. Перед опытом растворы доводят до кипения и горячими сливают вместе в колбу. При остывании в осадок выпадает иодид свинца, который хорошо растворим в горячей воде, но весьма мало в холодной (менее 0.1%). Осадок образуется в виде тонких блестящих на свету чешуек золотистого цвета. Размеры их зависят от скорости охлаждения, чем медленнее охлаждается раствор, тем крупнее кристаллы.
Несгораемый платок.
Небольшой платочек погружают в раствор силиката натрия (смешивают силикатный клей с водой в отношении 1:10), хорошо смачивают и отжимают. Затем платочек берут за уголок пинцетом, погружают в стакан с ацетоном (можно брать этиловый спирт, денатурат, бензин и другие легко воспламеняющиеся жидкости), вынимают и тут же поджигают над пламенем спиртовки или с помощью лучинки. Ацетон быстро сгорает, а платочек остается невредимым ( дело в том, что ацетон имеет настолько малую теплоту сгорания, что тепла едва хватает на то, чтобы просушить платок, поэтому платочек можно просто слегка смочить водой). После опыта платочек начисто отстирывают в теплой воде и его снова можно использовать по назначению
Окрашивание пламени
Для выполнения опыта необходимо приготовить несколько кусочков фильтровальной бумаги. Бумагу помещают в насыщенный раствор хлората калия, вымачивают некоторое время, затем достают и сушат. При поджигании приготовленных таким образом высушенных листков наблюдается пламя белого цвета. Для получения окрашенного пламени необходимо к раствору хлората калия добавить нитрат стронция(красное пламя), бария(зеленое пламя) или меди(голубое пламя).
Аммиачный фонтан
Для опыта необходимы две колбы, соединенные следующим образом: на одну из них, широкогорлую, одевается пробка с отверстием для стеклянной трубки и пипетки; другая колба, более узкая соединяется со стеклянной трубкой с помощью подходящей пробки. В узкую колбу наливают воду так, чтобы уровень жидкости доходил до стеклянной трубки. В пипетку набирают несколько капель раствора фенолфталеина, а широкую колбу наполняют аммиаком. После этого прибор собирают, как указано выше, надежно закрепляя колбу с водой внизу. С помощью пипетки несколько капель жидкости добавляют в широкогорлую колбу и наблюдают красивый фонтан жидкости, окрашивающейся в розовый цвет при выходе из трубки.
Кристаллический дождик.
Оборудывание: пробирка, спиртовка, 10% расстворы иодида калия (KI) и нитрата свинца II (Pb(NO3)2).
В пробику налейте 5мл KI (иодида калия) и прилейте 4мл Pb(NO3)2, при их смешивании выпадает желтый осадок иодида свинца (PbI2). Хорошо прогрейте пробирку на спиртовке, затем резко охладите под краном или влажной тряпкой. На солнце или при свете настольной лампы можно наблюдать кристаллический дождик в пробирке
Взрыв с серной кислотой и марганцовкой.
Всем известно, что "марганцонвка" довольно сильный окислитель. Но ангидрид марганцевой кислоты - Mn2O7, куда сильнее. Это соединение вызывает воспламенение, а порой и взрыв, при соприкосновении с различными органическими и другими веществами, ведь температура при которой высший оксид марганца разлагается на свободный кислород и низшие оксида марганца чуть выше 50 гадусов.
Оборудывание: марганцовокислый калий (марганцовка KMnO4), концентрированная серная кислота (H2SO4), вата. Насыпьте маленькую горочку марганцовки. Полейте ее серной кислотой. Если кинуть ватку на горку то происходит хлопок и смесь воспламеняется. Опыт следует ставить только на открытом воздухе, т. к. при хлопке происходит большой разброс пачкающего продукта. Произошла реакция: 2Mn2O7+C6H10O5=6CO2+5H2O+4MnO2
Выделение и возгорание фосфина.
Фосфин (PH3) ядовитый газ, светится в темноте легко воспламеняется.
Оборудование: красный фосфор (можно обводнившийся), пробирка, металлический натрий, спиртовка.
На дно пробирки киньте 0,5 гр влажного красного фосфора (очень хорошо если фосфор обводнившийся). Туда же опустите маленький кубик (0,4 см3) металлического натрия. Начните греть пробирку на спиртовке и вскоре из пробирки вырвется пламя. Это возгорелся фосфин образовавшийся при гидролизе фосфида натрия.
Люминофоры на основе борной кислоты.
Когда мы посмотрим на светящуюся в темноте игрушку или часы, мы смело можем сказать - фосфор. Хотя это далеко не фосфор, и содержания фосфора там совсем нет. Это – люминофоры, вещества, возбуждающиеся при свете. Для приготовления таких люминофоров, чтобы светились несколько часов, понадобится много компонентов. В домашней лаборатории можно приготовить люминофоры, которые будут светиться всего несколько секунд, но и это, тоже неплохо.
Оборудывание: керамическая чашечка для выпаривания или алюминиевый стаканчик от электролитического конденсатора, борная кислота (H2BO3), какой-нибудь компонент (см.ниже), газовая плита или штатив с кольцом и спиртовая горелка, фотовспышка.
В чашечку для выпаривания, или на худой конец, в маленькую консервную банку положите 2 гр порошковой борной кислоты (продается в аптеке) и такое-же количество компонента; прилейте чуть-чуть воды, чтоб при размешивании получилась густая кашица. Затем начинайте греть. Сначала смесь начнет кипеть, потом получится густая стекловидная масса. После ее образования, снимите сосуд с огня и поставьте остывать. Как только смесь остынет, при облучении получившегося продукта фотовспышкой, можно наблюдать свечение (в абсолютной темноте).
Взятие пробы на алкоголь
Юному химику потребуется газовая промывалка, если ее нет, нужно собрать ее аналог, используя подходящие колбу и стеклянные трубки. Выходящую из промывалки трубку с помощью пробки соединяют с трубкой большего диаметра, в котоую помещается кристаллический хромат калия. Промывалку наполняют 0.1% раствором этанола в воде и начинают продувать воздух ( можно - ртом, можно - с помощью целлофанового пакета из соображений безопасности). В трубке с хроматом калия наблюдается возникновение зеленой окраски (Cr III), хорошо заметной на желтом фоне. Нетрудно заметить, что глубина и степень распространения окраски пропорциональны концентрации алкоголя. Таким образом, потренировавшись, можно заняться тестированием родных и знакомых.
Примечание: ставить подобные опыты на себе не рекомендуется
Получение фенолформальдегидной смолы
В пробирку помещают 10 капель жидкого фенола и 8 капель 40% формальдегида. Смесь нагревают на водяной бане до растворения фенола. Через 3 минуты в пробирку добавляют 5 капель концентрированной соляной кислоты и помещают ее в стакан с холодной водой. После образования в сосуде двух четких фаз следует слить воду и вылить полимер из пробирки. В течение нескольких минут образовавшаяся новолачная смола затвердевает.
Пламя-художник
На белом листе плотной бумаги делается надпись или рисунок 10-20% раствором серной кислоты. После высушивания надпись или рисунок на бумаге незаметны. Если теперь лист подержать над пламенем (oсторожно !) горелки, то через некоторое время на бумаге появляется надпись или рисунок черного цвета. Вместо пламени спиртовки можно использовать настольную электрическую лампу или утюг, нагрев которыми осуществляется более равномерно и исключает воспламенение бумаги.
"Вода" зажигает костер
На асбестовую сетку ставится небольшая фарфоровая чашечка (можно часовое стекло) с небольшим количеством смеси перманганата калия с серной кислотой. На фарфоровую чашечку и вокруг нее накладывают сухие лучинки, имитирующие костер. Для зажигания полученного костра смачивают кусок ваты "водой" (этиловым спиртом) и выжимают над ним так, чтобы капли попали в чашечку. Спирт (можно брать денатурат) воспламеняется, поджигая затем лучинки
Чтобы решить задачи Турнира, участникам нужно проводить эксперименты, поэтому в данной статье будут рассмотрены основные виды лабораторной посуды, которые могут пригодиться участникам в выполнении работ.
Химические стаканы


Причём нагревать термостойкие стаканы можно только на нагревательной плитке или на штативе/треноге, подложив между подставкой и стаканом асбестовую сетку. Нагревать химические стаканы на открытом огне нельзя!

Колбы плоскодонные


Также как и стаканы предназначены для работы с жидкостями: фильтрования, растворения твёрдых веществ, приготовления растворов и т.д. Их можно закупоривать пробками, если содержимое летуче и/или имеет неприятный запах, также используются при перегонке в качестве приёмника очищенной жидкости и в количественном анализе.
Существуют также и круглодонные колбы, у них даже может быть не одно, а сразу несколько горлышек. Такие колбы используются для синтеза различных веществ.
Мерная посуда

Всем уже знакомые цилиндрические пробирки, так же могут быть пластиковые и стеклянные. Нагревать можно только последние, причём обязательно с использованием держателя.

Также пробирки могут быть и совсем маленькими, объёмом до 1 мл. Они часто используются в биологии и биохимических исследованиях, где работают с очень маленькими объёмами и концентрациями. Исследователи между собой называют их эппендорфами (в честь немецкой фирмы Eppendorf, впервые их выпустившей) или просто - дурацкими пробирками.

В таких пробирках производители часто упаковывают плазменные семена для посева (очень маленькие, которые легко просыпать или повредить в обычном бумажном мешочке).
Газоотводные трубки

Предназначены для отвода газа из реакционной системы. Как правило, резиновые, силиконовые или стеклянные, с одной или с двух сторон на таких трубках закреплены резиновые или корковые пробки, чтобы закупорить реакционный сосуд, в котором образуется газ.
Если газ нужно пропустить через жидкость, кончик газоотводной трубки погружается в раствор.
Ложечки и шпатели, палочки

Ложечки и шпатели используются для перемещения сыпучих веществ из банки в какую-либо ёмкость. Шпателем можно отскрести прилипший ко дну осадок. Могут быть стеклянными, фарфоровыми и пластиковыми. Стеклянные палочки используются для перемешивания и переливания растворов (их переливают по палочке чтобы жидкость не разбрызгалась)
Иногда при получении чего-либо требуется, чтобы реакционный сосуд нагревался всё время при одной температуре. Этого добиваются, помещая реакционный сосуд в т.н. баню – кастрюльку с водой, песком или высококипящей жидкостью, - наполнение бани изменяют в зависимости от назначения. Если нужно поддерживать температуру до 100 ° С используют водяную баню, контролируя при необходимости температуру бани с помощью термометра.

Если, наоборот, нужно резко охладить содержимое до 0 ° С, баню заполняют смесью воды и льда, добавив немного поваренной соли.
Выпаривательные чаши
Когда имеется небольшое количество раствора с осадком или жидкой смеси, из которой при удалении растворителя выпадают кристаллы, жидкую фазу от твёрдой удаляют выпариванием. Для этого фарфоровую чашку подходящего объёма заполняют наполовину и нагревают на огне (через асбест), на плитке или даже просто на солнышке (если растворитель летучий).
В выпаривательных чашках нельзя измельчать и размалывать порошки, они очень хрупкие! Для измельчения кристаллов лучше использовать ступку и пестик.

Помимо мерных, есть просто небольшие пипетки, которые помогают добавлять жидкость по каплям (например, конц. кислоты)
Часовые стёкла и чашки Петри

Часовые стёкла могут использоваться для взвешивания небольших количеств порошкообразных веществ, а также предназначены для проведения капельных реакций, когда при смешивании нескольких реагентов выпадает очень незначительное количество кристаллов, которое не будет заметно в пробирке, либо когда образуются просто красивые кристаллы.

Чашки Пéтри широко используются для выращивания культур бактерий и других микроорганизмов, в химии используются для высушивания или хранения каких-либо твёрдых образцов.
Но что делать, если школьная лаборатория не располагает такими ресурсами? Или преподаватель не хочет, чтобы Вы добили ту немногую посуду, которую не добили Ваши предшественники? Есть несколько вариантов.
Во-первых, вспомните, вдруг Вам или кому-то из Ваших друзей вдруг дарили набор юного химика? Как правило, в таких наборах есть не только минимальный набор пластиковой посуды (которая ничем не хуже стеклянной, греть в них нельзя, зато не разобьются), но и некоторые реагенты для простых опытов.
Во-вторых, можно проявить смекалку и воспользоваться медицинской посудой. Например, химические стаканы можно заменить контейнерами для анализов.

Их преимущества в том, что они мерные, у них есть завинчивающаяся крышка, их можно подписывать обычным маркером, а у контейнера для сдачи кала даже лопаточка есть. Их же можно использовать как пробирки, поскольку они имеют довольно небольшой объём.
Вместо колб для приготовления растворов можно использовать пластиковые бутылки по 0,5 или 1 л, а в качестве часового стекла – круглый срез с бока бутыли (на ютубе даже есть видео, как из таких срезов можно сделать лупу).
Капельные пипетки также продаются в аптеке, они называются глазные пипетки, а в качестве мерных пипеток – шприцы (иголку перед этим лучше снимать).

Возможно, Вы сможете отыскать дома бытовые технические весы. Их следует использовать большой осторожностью, если они контактируют с продуктами питания, кухонные весы лучше не использовать. Перед работой с весами лучше накрыть их пакетом или защитной плёнкой и после работы тщательно протереть.
Категорически запрещено использовать кухонную посуду для экспериментов! Как бы тщательно Вы её не вымыли перед тем, как вернуть домой, на ней всё равно останутся следы от реагентов. Использовали Вы суповую тарелку для перекристаллизации медного купороса и вернули на место, но ионы меди остались. Предельно допустимая концентрация ионов меди в воде 0,001 г/мл, т.е. достаточно немного превысить эту концентрацию, чтобы организму человека был нанесён непоправимый вред. Поэтому не травите себя и своих близких и не используйте кухонную посуду и свой дом для опытов.

В химии большое значение имеет эксперимент. Эксперимент служит как источником получения знаний, так и критерием истинности знаний. Чтобы опыты проходили удачно, необходимо знать и соблюдать правила техники безопасности. Из материалов первого практического занятия вы не только узнаете о правилах безопасной работы в химической лаборатории, но и познакомитесь с видами лабораторного оборудования и способами нагревания веществ.
Посуда химическая лабораторная (п.х.л.) - изделия, изготовленные из стекла, кварца, фарфора и др. материалов, которые применяются для препаративных и химико-аналитических работ.
Требования, которым должна соответствовать химическая посуда:
- Термоустойчивость, малый коэффициент теплового расширения материала
- Устойчивость к воздействию химических реагентов
- Загрязнения должны легко отмываться
В данной статье мы классифицируем всю химическую посуду на три группы по ее назначению: мерная, немерная и специального применения.
Мерная химическая посуда
Мерная посуда имеет точную градуировку, нагреванию ее не подвергают.
Пипетки служат для отбора жидкостей (до 100 мл) и газов (от 100 мл)

Применяются для измерения точных объемов, титрования (метод количественного/качественного анализа в аналитической химии)

С помощью мерных колб, мензурок и цилиндров отмеривают и хранят определенные объемы жидкостей.

Немерная химическая посуда (общего назначения)
К такой химической посуде относятся изделия, многие из которых употребляются с нагревом: пробирки, стаканы, колбы (плоскодонные, круглодонные, конические), реторты.

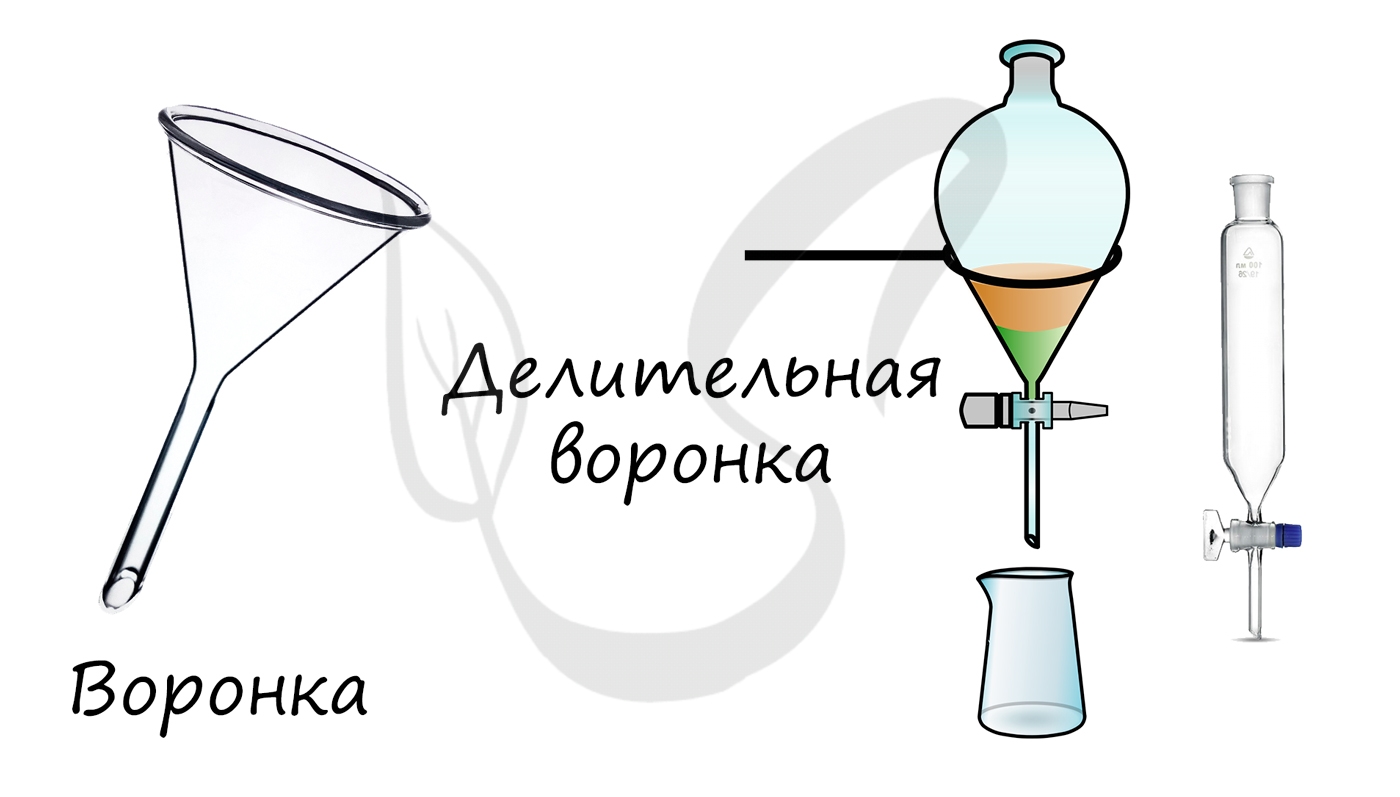
Служат для переливания и фильтрования жидкостей. Делительные воронки применяются для разделения несмешивающихся жидкостей.
Используется для выпаривания растворов и очистки веществ путем перекристаллизации - методе, основанном на различии растворимости вещества в растворителе при различных температурах.

Сифон химический применяется для безопасного перекачивания жидких сред из бутылей, бочек, канистр. Особенно важен сифон в работе с агрессивными опасными химическими веществами.

Банки служат для хранения твердых веществ, склянки - для хранения жидких веществ, а также в качестве резервуара, из которого жидкость поступает в другой раствор, например, в бюретки в ходе титрования.
Бюкс - баночка с притертой пробкой, используется как емкость при исследовании, в ходе которых высушиваются и взвешиваются сыпучие материалы

Химическая капельница применяется для дозирования растворов и индикаторов.

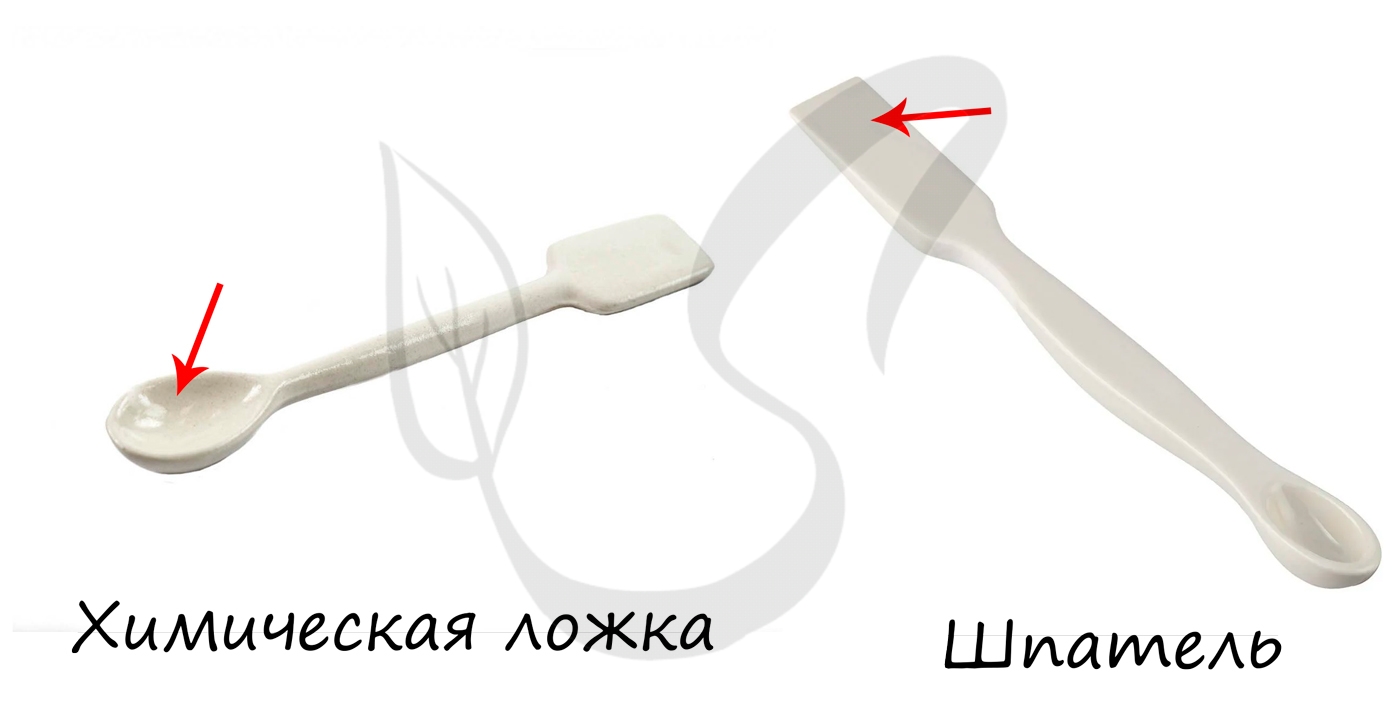
Используются с целью взятия твердых и сыпучих веществ. Могут служить для перемешивания жидкостей.
Применяется для одновременного размещения и закрепления множества пробирок.

Химическая посуда специального назначения
Данная посуда отличается тем, что предназначена для какой-либо одной цели.
-
Колбы для дистилляции (колбы Вюрца)
Круглодонная колба с отводом для вставки прямоточного холодильника. Используется для перегонки различных веществ.

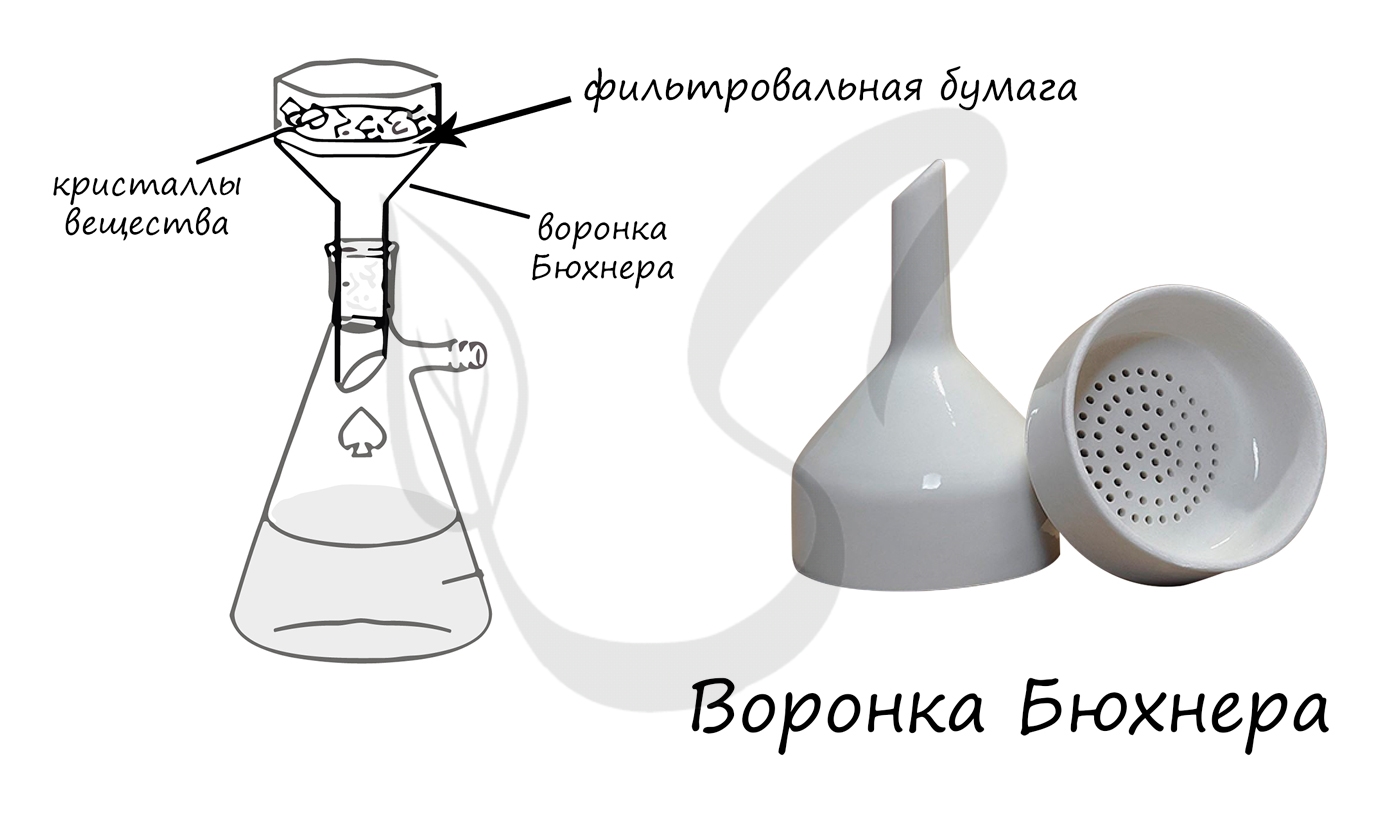
Плоскодонная коническая колба, которая применяется для вакуумного фильтрования.

Применяется для фильтрования растворов при помощи фильтровальной бумаги под вакуумом.
Фильтр Шотта представляет собой стеклянную пористую пластинку. Фильтр Шотта используют в ходе вакуумного фильтрования.

Применяется для конденсирования паров и отвода образовавшегося конденсата из системы, сбор конденсата происходит в колбу-приемник.
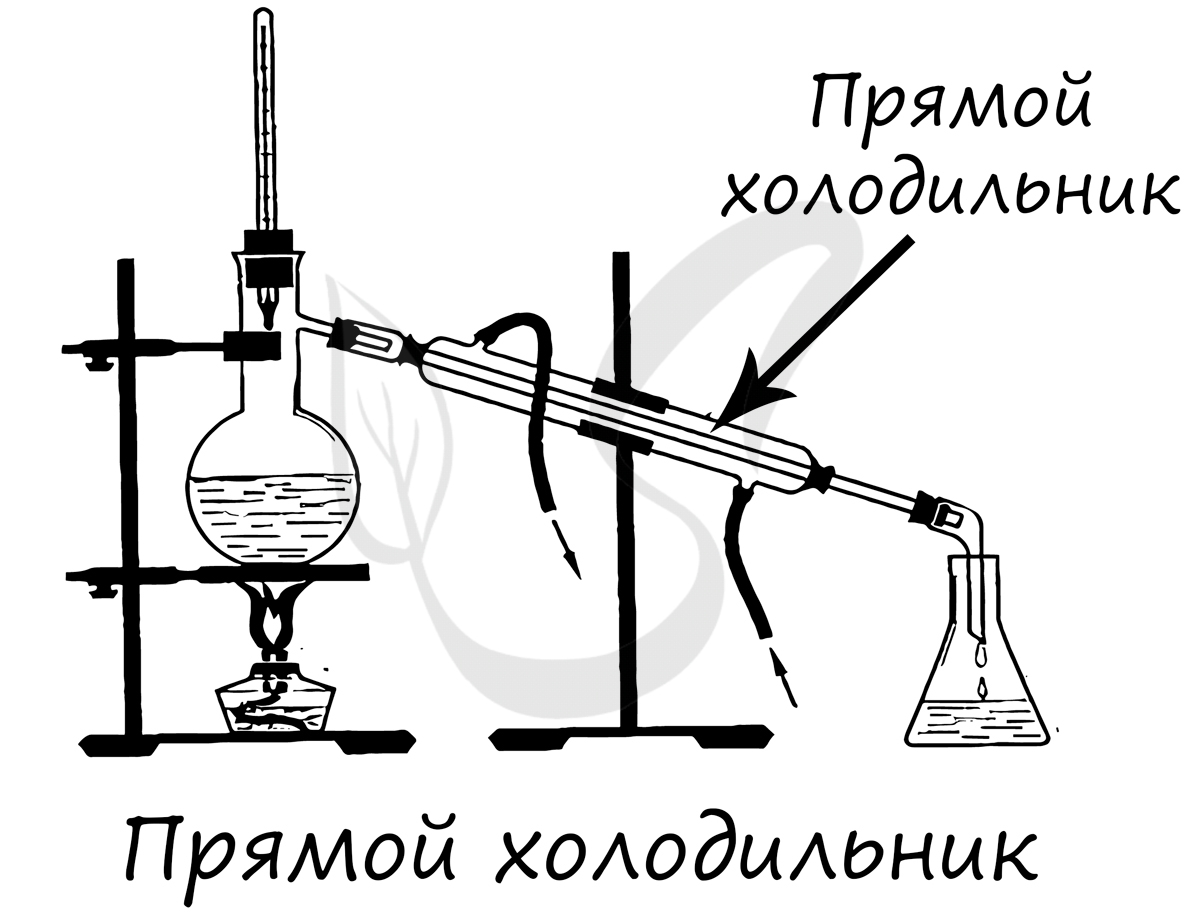
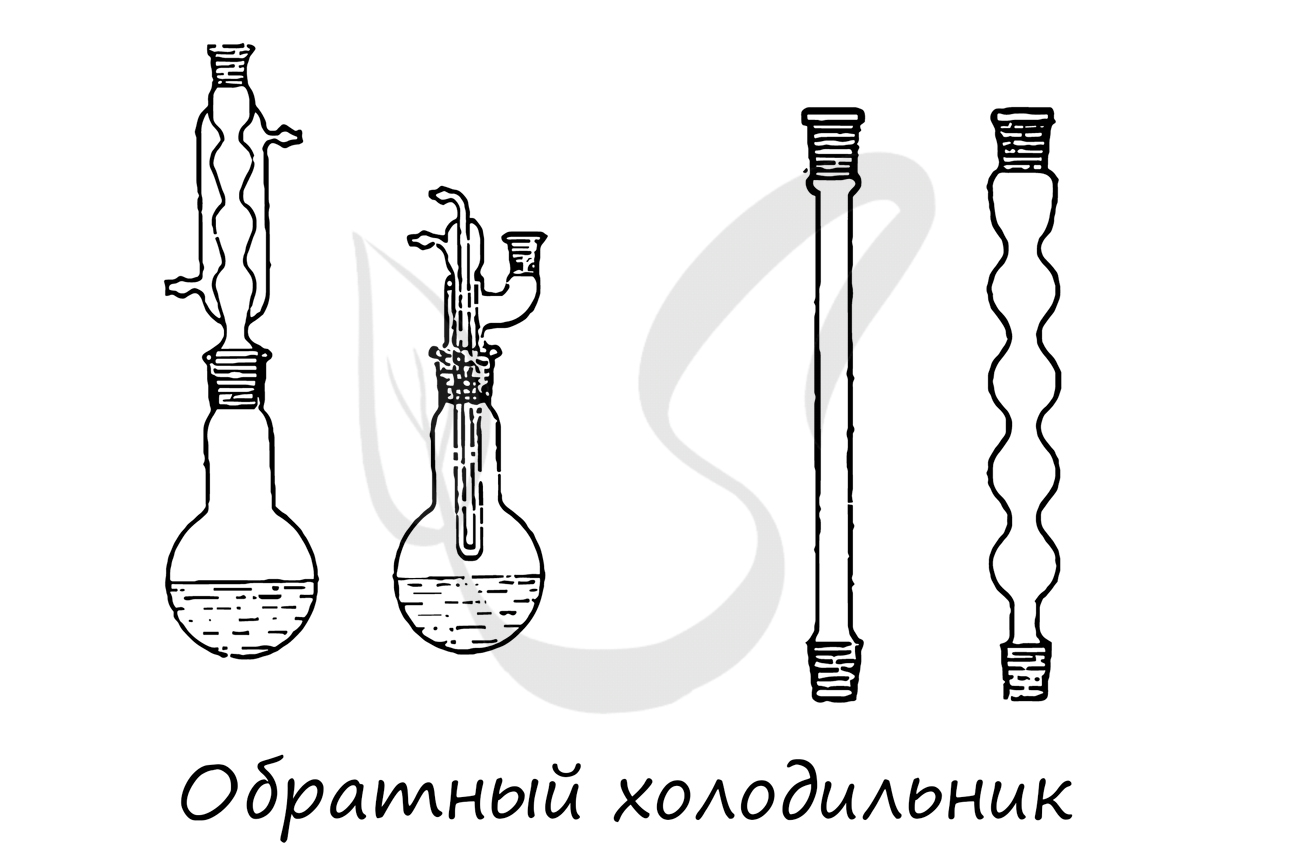
Применяется для конденсирования паров и возврата конденсата в реакционную массу. Обычно устанавливается вертикально.
Конструктивный элемент химических приборов, чаще всего используется для соединения холодильника с приемником.
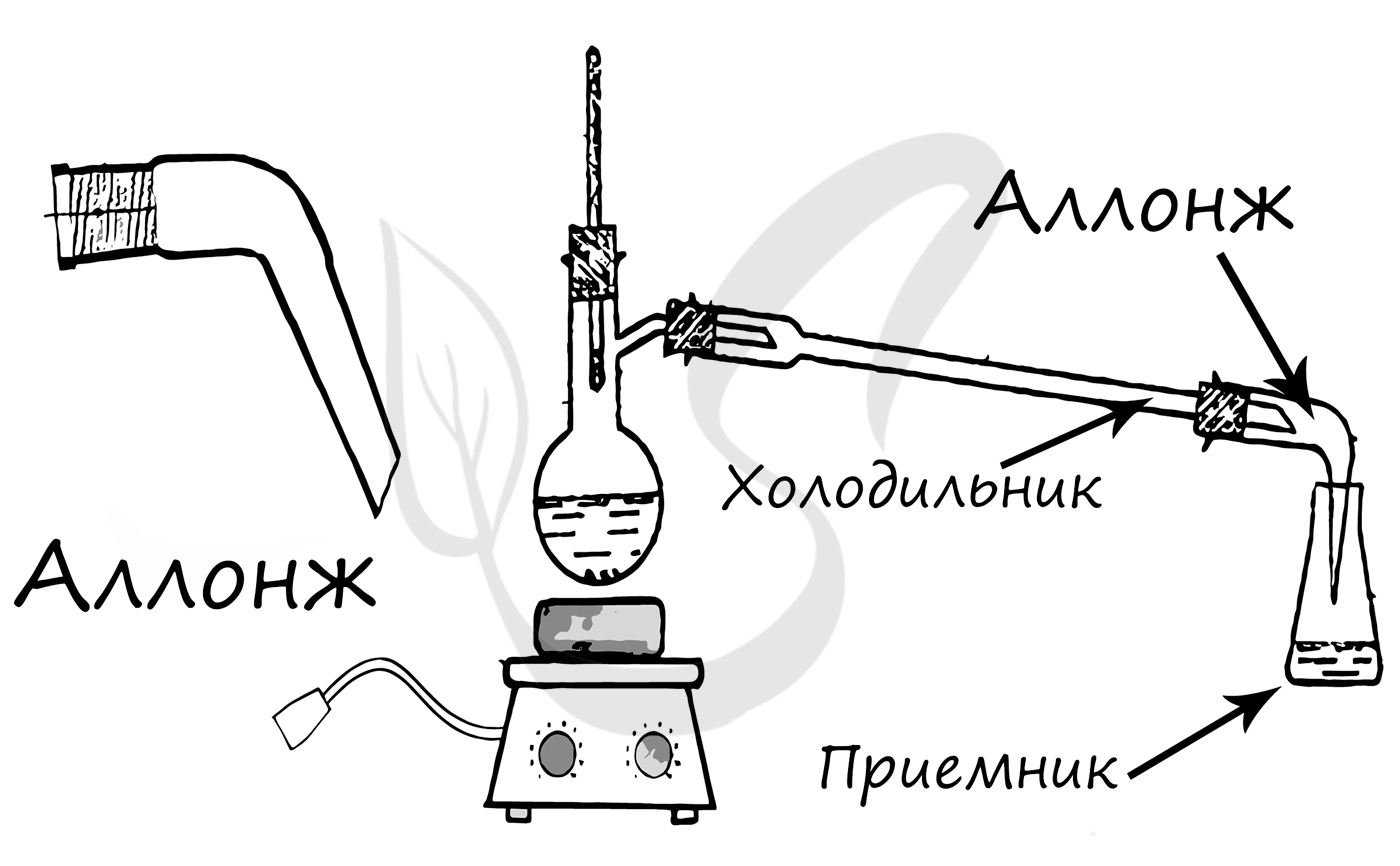
Используется в качестве приемника при перегонке. Одним из предназначений колбы Кьельдаля является определения азота в веществах по методу Кьельдаля.

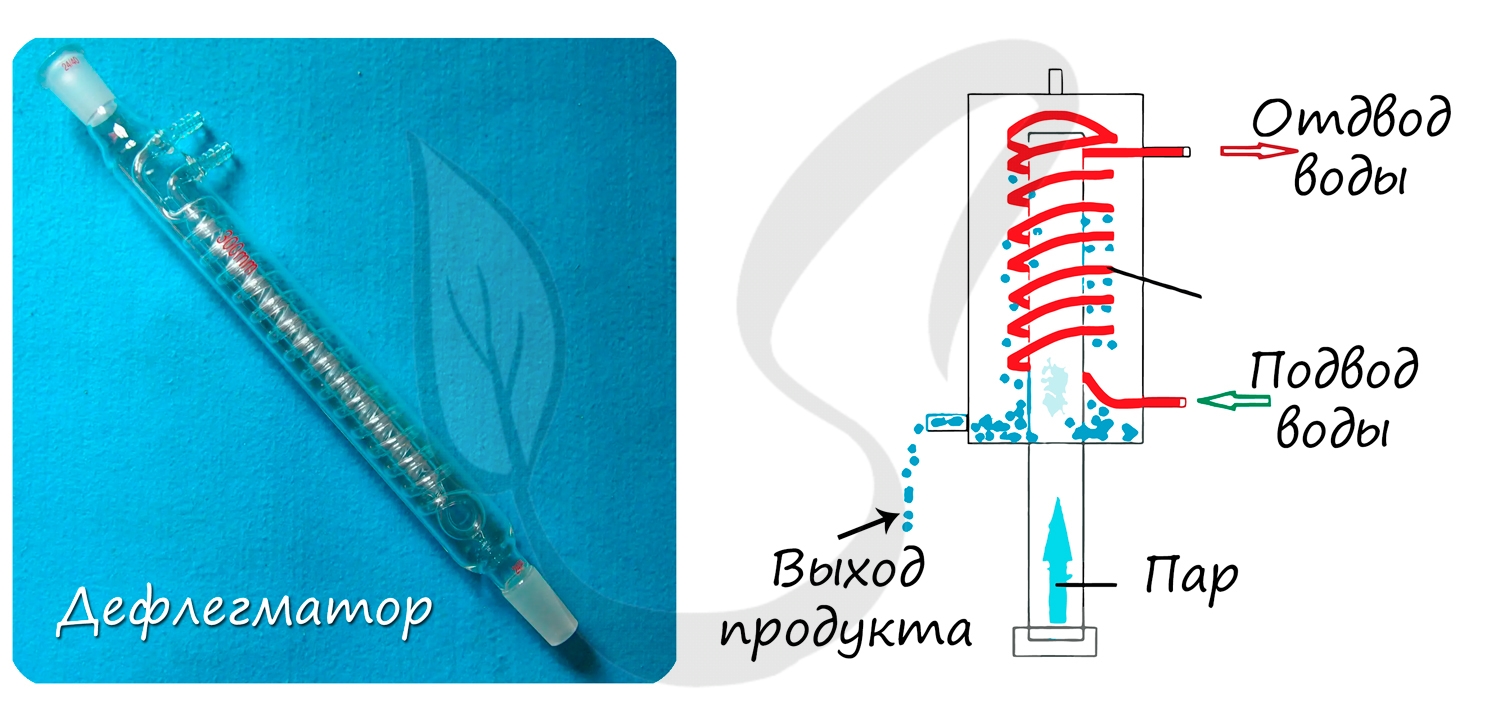
Используется для частичной или полной конденсации паров жидкостей, которые разделяют перегонкой или ректификацией (разделение, основанное на многократной дистилляции.)
Толстостенный стеклянный сосуд, с пришлифованной крышкой, на дно которого помещают влагопоглощающее вещество, в результате чего в эксикаторе поддерживается влажность воздуха приблизительно равная нулю. Эксикатор используется для высушивания и хранения различных веществ.

Склянка Дрекселя - сосуд, используемый для промывания и очистки газов. В результате пропускания газа через склянку Дрекселя он освобождается от механических примесей.

Служат для очистки газов от механических примесей. Также хлоркальцевые трубки применяют для предохранения растворов от попадания в них воды и углекислого газа: с этой целью их заполняют нужным поглотителем.

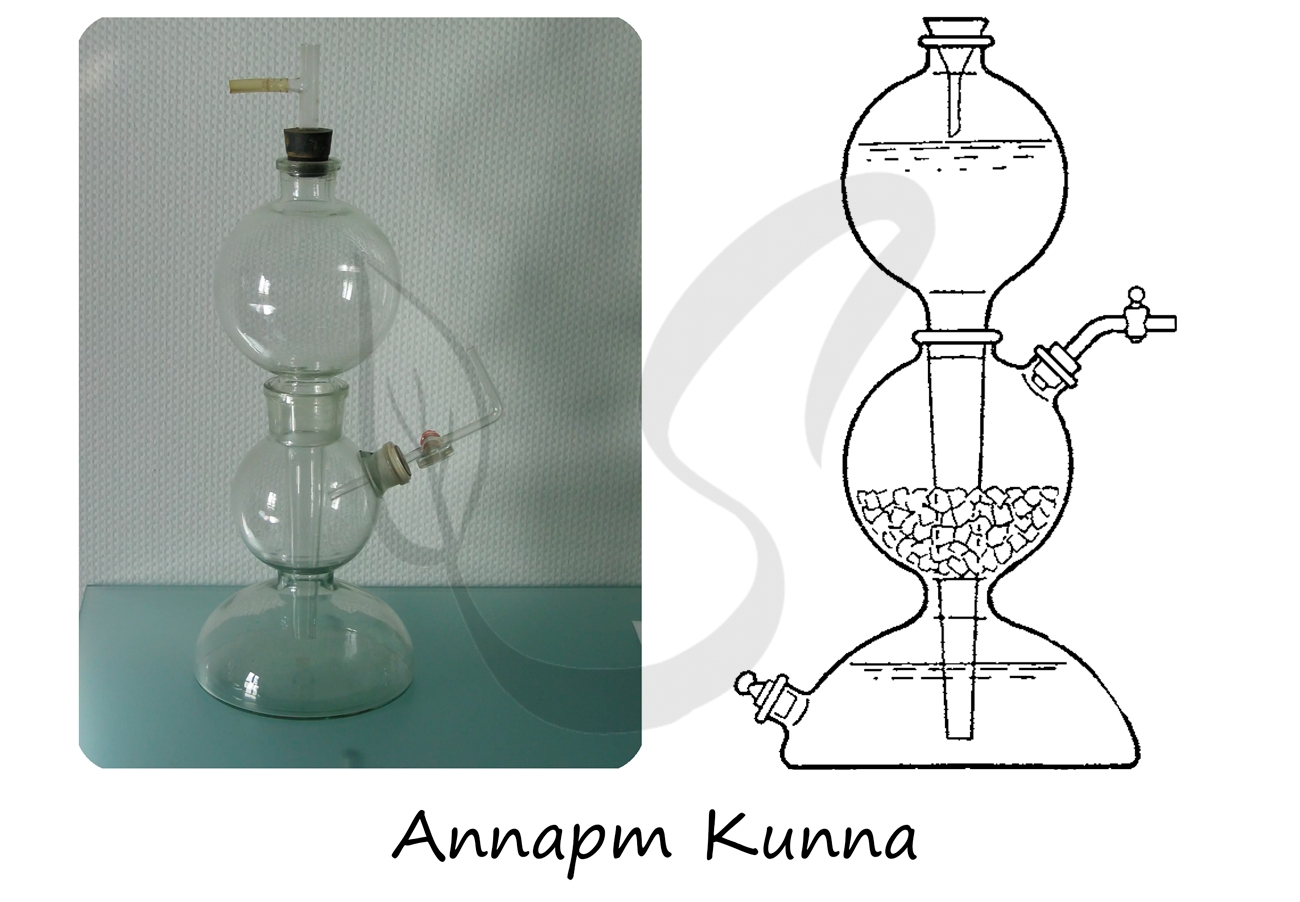
Применяется для получения газов при действии на твердые вещества растворов кислот и щелочей.
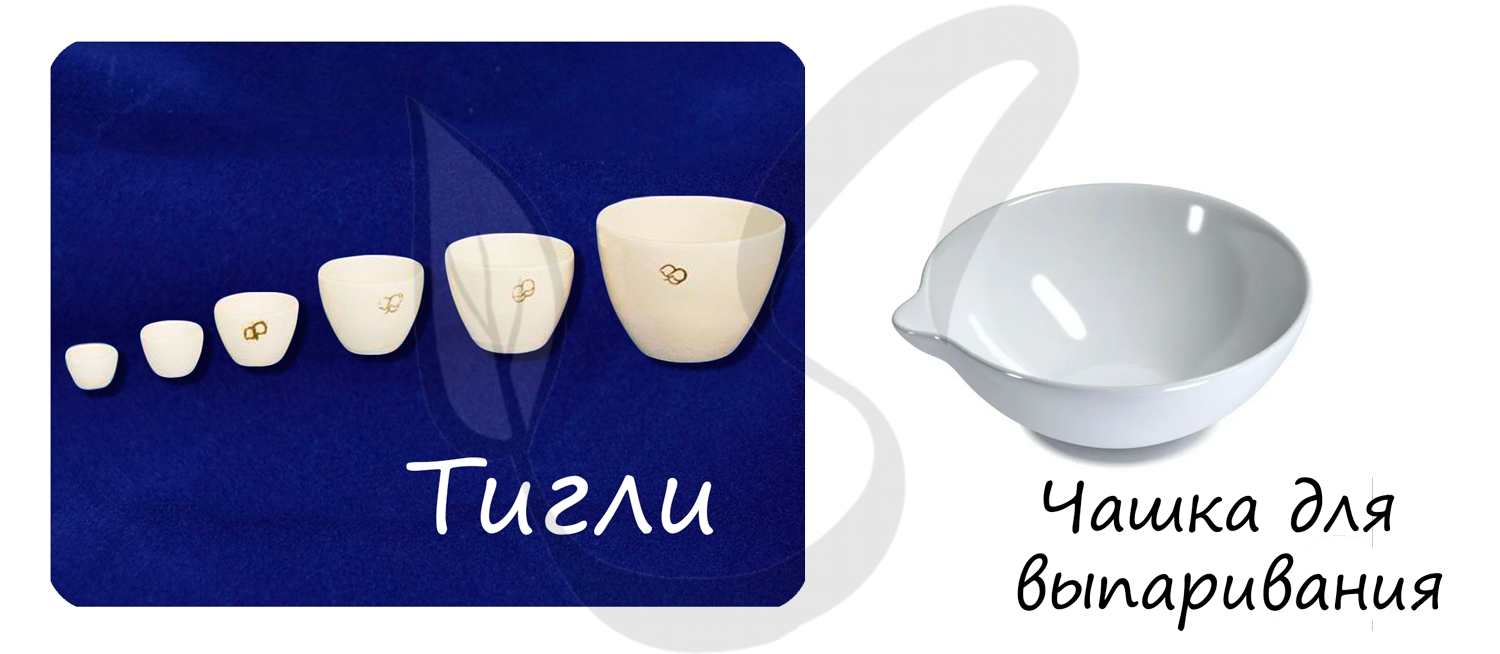
Тигель (от нем. Tiegel — горшок) - термостойкий сосуд-чаша (фарфоровый, глиняный) для нагрева, высушивания, сжигания и обжига различных материалов. Применяют для сплавления.
Чашки для выпаривания используют для выпаривания (упаривания) растворов.
Применяется для измельчения твердых веществ.

Применяются для прокаливания веществ в печи.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Лабораторная посуда
Разделения смешивающихся жидкостей Выпаривания растворов Измерения точного объема Перегонки жидкостей
Химическая бюретка применяется для измерения точного объема.
Перегонки жидкостей Измерения точного объема Разделения смешивающихся жидкостей Выпаривания растворов
Реторта используется главным образом для перегонки жидкостей.
Упаривают растворы Осуществляют перегонку жидкостей Осуществляют вакуумное фильтрование Разделяют несмешивающиеся жидкости
С помощью делительной воронки разделяют несмешивающиеся жидкости.
Кристаллизатор применяется для выпаривания (упаривания) растворов.
Выпаривания растворов Безопасного перекачивания жидкостей Разделения смешивающихся жидкостей Вакуумного фильтрования
Химический сифон служит для безопасного перекачивания жидкостей.
С помощью капельницы дозируют растворы.
Колба Вюрца применяется для дистилляции: например, для разделения жидкостей с разной температурой кипения.
Колбу Вюрца и эксикатор Капельницу и фильтр Шотта Колбу Бунзена и фильтр Шотта Воронку Бюхнера и колбу Вюрца
Для вакуумного фильтрования из всего перечисленного применяют: колбу Бунзена, фильтр Шотта и воронку Бюхнера.
Воронка Бюхнера служит для вакуумного фильтрования.
Сплавления веществ Высушивания и хранения различных веществ Дистилляции Очистки газов от механических примесей
Эксикатор используется для высушивания и хранения различных веществ.
Хлоркальцевые трубки применяются для очистки газов от механических примесей.
Тигли используются для сплавления веществ, сжигания различных материалов.
Читайте также:

