Как сделать электронную конфигурацию марганца
Добавил пользователь Дмитрий К. Обновлено: 19.09.2024
Электронные структуры атомов марганца и брома
Задача 4
Исходя из электронных структур атомов марганца и брома, их места в периодической системе, объясните сходство и различие их химических свойств.
Решение:
Марганец - 25 –й элемент таблицы Менделеева. Электронная формула марганца имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5
Валентные электроны находятся на 4s и 3d подуровнях. На валентных орбиталях атома марганца находится 7электронов.
Бром – 35 элемент периодической таблицы Электронная формула брома имеет вид:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5
Валентные электроны находятся на 4s и 4р подуровнях. На валентных орбиталях атома находится 7 электронов.
Таким образом, марганец и бром не являются электронными аналогами и не должны размещаться в одной и той же подгруппе. Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов – 7. Поэтому оба элемента помещают в одну и ту же группу периодической системы Д.И.Менделеева. Марганец – d-элемент VIIB-группы, а бром – p-элемент VIIA-группы.
На внешнем энергетическом уровне у атома марганца два электрона, а у брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Электронная формула ванадия
Задача 5.
Напишите электронно-графическую формулу для 23 элемента, определите его валентные электроны и охарактеризуйте их с помощью квантовых чисел.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s>2s>2р>3s>3р>4s>3d>4р>5s>4d>5р>6s>(5d1) >4f>5d>6р>7s>(6d1-2)>5f>6d>7р
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для 23 элемента - ванадия( V –порядковый № 23) электронная формула имеют вид:
V23 1s 2 2s 2 2р 6 3s 2 3р 6 4s 2 3d 3
Валентные электроны ванадия - 4s 2 3d 3 - находятся на 4s и 3d подуровнях На валентных орбиталях атома ванадия находится 5 электронов. Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева.
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.


- MnO2 - пиролюзит
- MnO(OH) - бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 - браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + C = (t) Mn + CO
-
Реакции с неметаллами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.

При нагревании марганец вытесняет водород из воды.
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие соли.

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если выпадает осадок, выделяется газ или образуется слабый электролит.
При действии сильных окислителей ион Mn 2+ способен переходить в ион Mn 7+
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).

В реакциях с щелочами марганец переходит в СО +6, в кислой среде - принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда - щелочная)

Соединения марганца (VI) - MnO3, H2MnO4 - неустойчивы, в свободном виде не получены. Обладают кислотными свойствами. Наиболее устойчивые соли - манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.

Соединения марганца (VII) - неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 - проявляют кислотные свойства. Соли марганцовой кислоты - перманганаты.
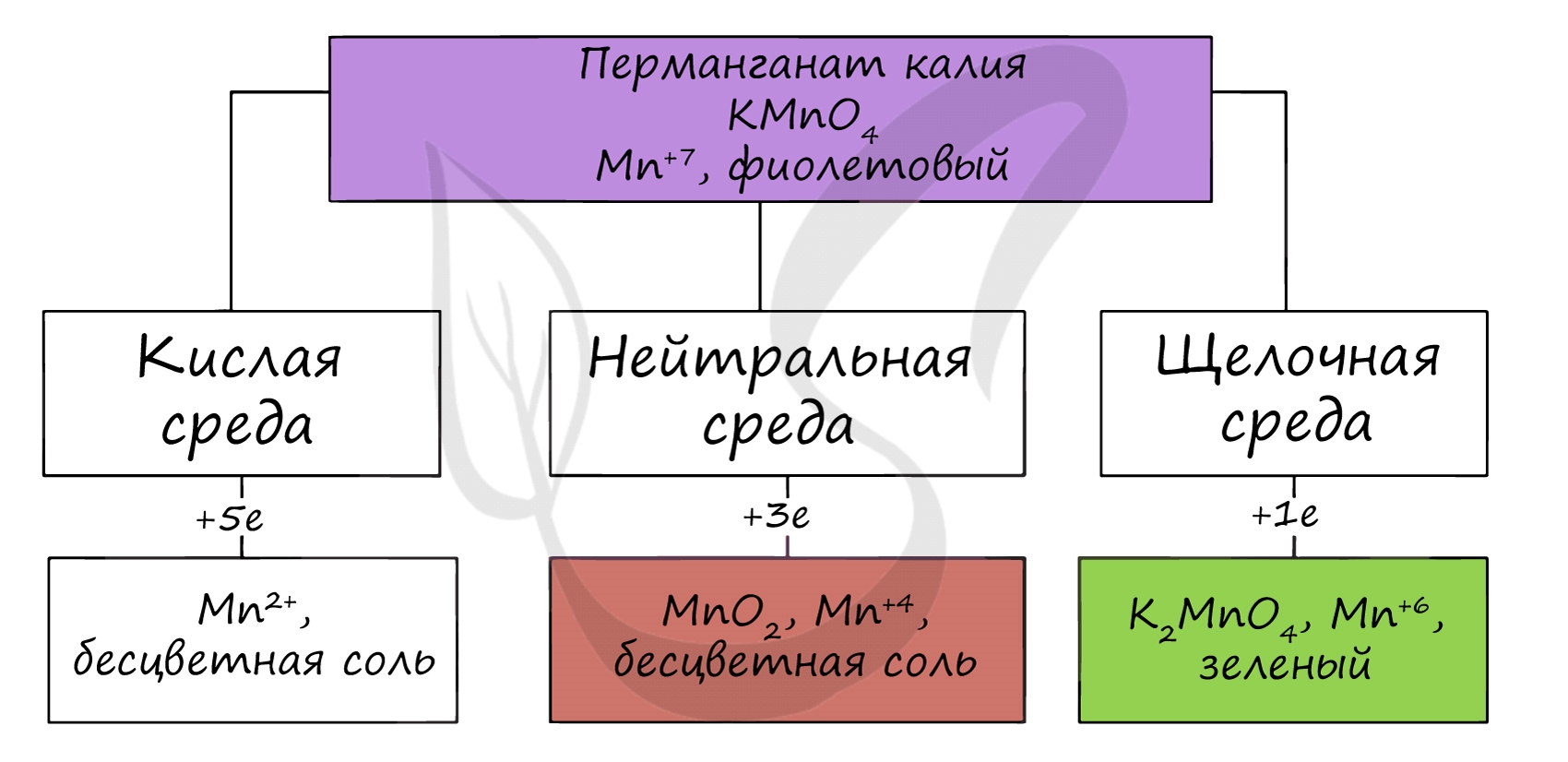
В различных средах - кислотной, нейтральной и щелочной - марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты - перманганаты.
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
При нагревании перманганата калия (в быту - марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.

При стоянии в растворе постепенно разлагается водой.
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) - Mn 2+ , в щелочной - Mn 6+ .
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke - зубец. С древнейших времен известен сплав меди с цинком - латунь.

Для цинка характерна постоянная степень окисления +2.

- ZnS - цинковая обманка, сфалерит
- ZnO - цинкит
- ZnCO3 - симсонит, цинковый шпат
- 2ZnO*SiO2*H2O - гемиморфит

Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка различными восстановителями: чаще всего C, также возможно CO и H2.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
-
Реакции с неметаллами (и аммиаком :)
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
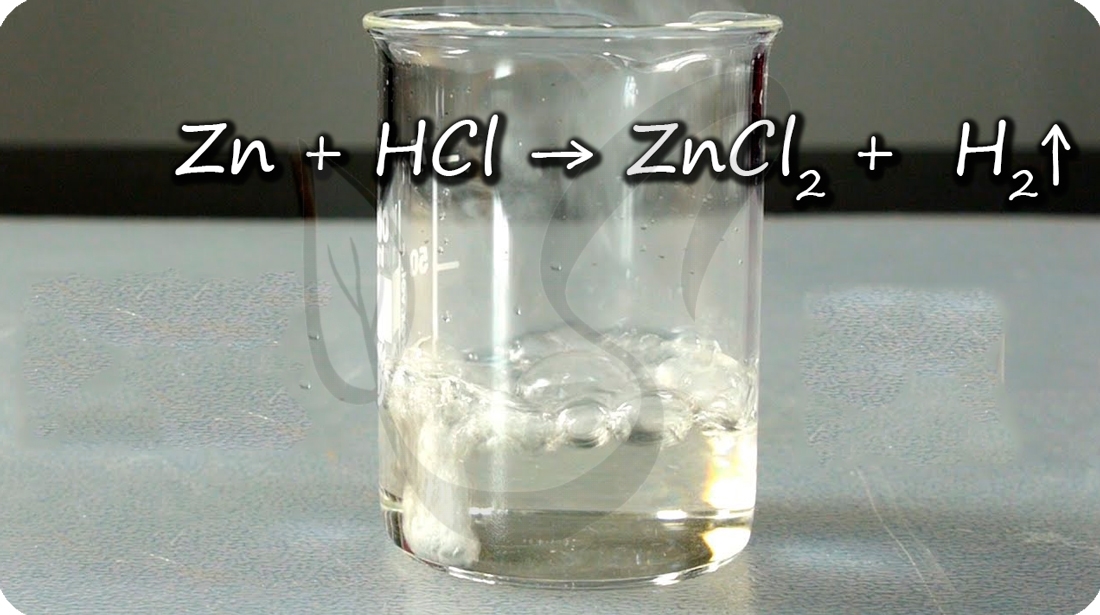
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями. При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или при разложении нитрата цинка.
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
При прокаливании комплексные соли распадаются, вода испаряется.
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом, серебро обладает низкой реакционной способностью.

-
Реакции с неметаллами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов. При нагревании с серой получается сульфид серебра.
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.

В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра - аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Еще один d-элемент — марганец — Mn.
Электронное строение атома

Серебристо-белый металл. Так же, как и хром, малоактивный — легко на воздухе пассивируется — окисляется кислородом.
-
Взаимодействие с кислородом: Mn + O2 = MnO2
Оксиды марганца:
- MnO — серо-зеленый , быстро окисляется до MnO2,
- Mn2O3 — коричнево-черный ,
- MnO2 — темно-коричневый ,
- Mn2 O 7 — кислотный оксид, очень сильный окислитель — жидкость зелено-бурого цвета . Очень неустойчивый
- Взаимодействие с водой: Mn + 2H2O = (t) =Mn(OH)2 + H2
-
Взаимодействие с кислотами:
- Mn + HNO3 (конц) ≠
- 3Mn + 8HNO3 (разб) = 3Mn(NO3)2 + 2NO + 4H2O
- Mn + 2H2SO4 (конц)= MnSO4 + SO2 + 2H2O
- Mn + H2SO4 (разб) = MnSO4 + H2
с кислотами-неокислителями:
В школьном курсе химии чаще всего встречаются соединения марганца: соли Mn(+2), оксид MnO2 и соли — перманганаты. Их свойства мы и рассмотрим.
- Mn(2+) — вступает в обычные обменные реакции:
MnCl2 + H2SO4 = MnSO4 + 2HCl
MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl - MnO2 — часто реагирует как окислитель:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O.
-
Оксиду Mn2O7 соответствует кислота HMnO4 — марганцовая кислота. В свободном виде она встречается очень редко. А вот соли ее используются широко и обычно это растворы малинового цвета . Это очень мощные окислители:
2KMnO4 + 2H2S = 2MnO2 + SO2 + K2S + 2H2O
- Манганаты: K2MnO4 раствор зеленого цвета — тоже очень сильные окислители.
- Восстановление перманаганатов происходит следующим образом:
- в кислой среде — до соединений Mn(2+)
- в нейтральной — до Mn(4+) — MnO2, например.
- в щелочной — до Mn (6+)
![марганец и его соединения]()
Эта схема отражает изменение цветов соединений марганца при повышении степени окисления.
Этот металл играет значительную роль в жизнедеятельности всего человечества. Он абсолютно необходим при производстве чугуна и стали, и до сих пор не найдено ни одного элемента, способного заменить марганец в таких применениях. Хотя его количество, используемое для изготовления тонны стали, невелико, но без него нельзя производить этот фундаментальный промышленный материал современного общества.
- Незаменимый элемент
- Нахождение в природе
- История открытия
- Прикладное значение
- Физические свойства
- Химические особенности
- Биологическая роль
- Влияние на окружающую среду
- Меры предосторожности
![Металл марганец]()
Незаменимый элемент
От древнего выдувания стекла до производства стали, от борьбы с кислородными радикалами до фотосинтеза, марганец всегда играл захватывающую роль в химии, геологии и биологии.
Марганец представляет собой типичный металл с атомным номером 25, расположенный в группе 7 периодической таблицы элементов Менделеева. Общепринятое обозначение — Mn. Конфигурация или электронная формула марганца [Ar] 3d5 4s2. Строение атома состоит из положительно заряженного ядра (+25) (с 25 протонами и 30 нейтронами), вокруг которого по четырём орбитам движутся 25 электронов. Присутствие пяти неспаренных электронов свидетельствует о том, что в его соединениях марганец может быть валентный от II до VII. Структурная (графическая) формула O = Mn = О показывает, как связаны атомы между собой внутри молекулы.
![Незаменимый элемент марганец]()
Нахождение в природе
Этот металл — чрезвычайно универсальный элемент. Он может существовать в шести различных состояниях окисления, но никогда не встречается в природе как чистый элемент. Его обычно находят либо в его восстановленном состоянии +2, которое легко растворяется в воде, либо в состоянии +4, образуя ещё многие типы нерастворимых оксидов.
Обычный способ получения — это нагревание диоксида марганца (MnO 2) с углеродом или алюминием. Реакция с этими элементами удаляет кислород и оставляет чистый металл.
Наиболее распространённые руды, содержащие марганец: пиролузит, манганит, псиломелан и родохрозит. Крупнейшими поставщиками руды в мире считаются:
![Марганец в Южной Африке]()
- Китай.
- Южная Африка.
- Украина.
- Бразилия.
- Австралия.
- Габон и Казахстан.
Этот элемент также в изобилии встречается на дне океана. По оценкам учёных, до 1,5 триллионов метрических тонн марганцевых конкреций может находиться на дне мирового океана и больших озёр. Но в настоящее время не существует эффективного способа добывания этих руд.
История открытия
Марганец в форме чёрного рудного пиролуцита использовался ещё пещерными людьми для наскальных рисунков около 30 000 лет назад. Соединения этого металла применялись египтянами и римлянами для обесцвечивания стекла.
![Марганец в форме чёрного рудного пиролуцита]()
Еще в древности отличные руды были обнаружены в регионе Магнезия, Греция. Отсюда и началась проблема с названиями. Все минералы, поступающие из этого региона, содержащие магний и марганец, стали называть магнезией. Магнитный железняк, обнаруженный в этом регионе тоже был назван Lapis magnis или магнезиальным камнем.
В течение некоторого времени происходило общее смешение названий, касающееся марганца и магния, но в конце XVIII века группа шведских химиков во главе с Торберном Бергманом доказала, что марганец является отдельным веществом. В 1774 году Шееле, член группы, представил эти выводы Стокгольмской академии, а позже в том же году Иоганн Ган стал первым человеком, который получил этот металл в результате химической реакции.
Прикладное значение
Сегодня марганец используется в бесчисленных промышленных целях, из которых наиболее важной является производство стали. Когда изобрели сталь, в 1856 году, она раскололась при горячей ковке. Проблема была решена позже в том же году, когда Роберт Фостер Муше обнаружил, что добавление небольших количеств марганца в расплавленное железо решает этот вопрос. С тех пор вся сталь содержит этот минерал. Фактически около 90% марганца, производимого сегодня, используется для изготовления стали.
Наиболее распространённым сплавом является ферромарганец. Он содержит около 48 процентов марганца в сочетании с железом и углеродом. Ферромарганец является исходным материалом для производства самых разнообразных стальных изделий, включая:
- инструменты;
- тяжёлое машинное оборудование;
- железнодорожные пути;
- банковские хранилища;
- строительные компоненты;
- автомобильные детали.
![Распространённым сплавом является ферромарганец]()
Другим распространённым сплавом является силикомарганец. Он содержит марганец, кремний и углерод в дополнение к железу. Используется для конструктивных элементов и пружин.
Марганец также применяется для изготовления сплавов с металлами, отличными от железа или стали. Например, сплав, известный как манганин, состоит из 84 процентов меди, 12 процентов марганца и 4 процентов никеля. Манганин используется в электрических приборах.
Возможно, наиболее важным коммерческим применением этих соединений является диоксид марганца (MnO2), используемый для изготовления сухих батарей, которые применяются в электронном оборудовании, фонариках и пейджерах. Использование диоксида в сухом элементе предотвращает накопление газообразного водорода в батарее при выработке электричества.
Другое соединение, хлорид марганца (MnCl2), является добавкой в корм для коров, лошадей, коз и других домашних животных. Удобрения для растений также содержат хлорид марганца.
В медицине используют так называемую марганцовку (марганцовокислый калий) в качестве антисептического средства, для полоскания горла, очистки ран, обработки ожогов и промывания желудка при отравлениях.
Наконец, небольшие количества соединений применяют в качестве красителей в кирпичах, текстиле, красках, чернилах, стекле и керамике. Кроме всего этого, марганец применяют в следующих областях:
![Марганец в бензине]()
- Его соединения добавляют в неэтилированный бензин. Это увеличивает октановое число топлива.
- Большинство алюминиевых банок для напитков содержит от 0,8% до 1,5% марганца.
- В химии применяется для окисления бензилового спирта.
- В некоторых странах этот металл используется для изготовления монет.
Физические свойства
Марганец — серый, твёрдый, блестящий, хрупкий металл. Он настолько хрупок, что его невозможно обработать в чистом виде. Под механической обработкой понимается изгибание и резка. Температура плавления составляет 1245 °C (2273 °F), а температура кипения около 2100 °C (3800 °F). Его плотность составляет 7,47 грамма на кубический сантиметр.
Этот металл может быть ферромагнитным, но только после прохождения специальной обработки. Он существует в четырёх аллотропных формах. Аллотропы — это формы элемента с различными физическими и химическими свойствами. Элемент изменяется от одной формы к другой, когда температура повышается. Форма, которая существует от комнатной температуры до примерно 700 °C (1300 °F), является наиболее распространённой.
Химические особенности
Этот химический элемент имеет символ Mn, атомный номер 25 и молярную массу ядра 54,938. Химические свойства марганца определяются его умеренной активностью. При нагревании он медленно соединяется с кислородом в воздухе, образуя диоксид (MnO2). При более высоких температурах реагирует с неметаллами и может даже гореть, испуская яркий белый свет. Он медленно реагирует с холодной водой, образуя гидроксид, но быстрее с горячей водой или паром, давая студнеобразный светло-розовый осадок.
![Химические особенности марганца]()
Марганец растворяется в большинстве кислот с выделением газообразного водорода, объединяется с фтором и хлоридом для получения дифторида (MnF 2) и дихлорида (MnCl 2).
Все соединения, кроме содержащих MnII, являются яркоокрашенными. Например, перманганат калия, KmnO4, при разложении даёт водные растворы пурпурно-красного цвета; Манганат калия, K2MnO4, даёт глубокие зелёные растворы.
Биологическая роль
Марганец является очень распространённым соединением, которое можно найти повсюду на земле. Он содержится в организмах всех растений и животных, является одним из трёх основных токсичных микроэлементов, что означает — он не только необходим для выживания организмов, но и вреден, когда присутствует в высоких концентрациях.
Это важный элемент для всех форм жизни, так как абсолютно необходим для активности нескольких ферментов, включая супероксиддисмутазу, которая защищает от вредного воздействия токсических кислородных радикалов.
![Фотосинтез, полностью зависит от марганца.]()
Одна из наиболее важных реакций в биологии, фотосинтез, полностью зависит от марганца. Это ключевой игрок в реакционном центре фотосинтезы II, где молекулы воды превращаются в кислород. Без него не было бы фотосинтеза, и в атмосфере отсутствовал кислород.
Потребление его людьми в основном происходит через продукты питания, такие как шпинат, чай и травы. Продукты, которые содержат самые высокие концентрации, — это зерновые, рис, соевые бобы, яйца, орехи, оливковое масло, зелёная фасоль и устрицы.
После попадания в организм человека металл транспортируется через кровь в печень, почки, поджелудочную железу и эндокринные железы. Его воздействие в основном происходит в дыхательных путях и мозге. Симптомами отравления являются галлюцинации, забывчивость и повреждение нервов. Он также может вызывать паркинсонизм, эмболию лёгких и бронхит.
Когда люди подвергаются его воздействию в течение длительного периода времени, ущерб может стать значительным и иметь следующие симптомы: шизофрения, депрессия, мышечная слабость, головная боль и бессонница. Но поскольку марганец является важным элементом для функционирования организма человека, его отсутствие также может вызвать негативные последствия для здоровья:
- непереносимость глюкозы;
- проблемы с кожей;
- низкий уровень холестерина;
- врождённые дефекты;
- изменения в цвете волос;
- неврологические симптомы.
Влияние на окружающую среду
Соединения марганца существуют в природе в виде твёрдых частиц в почве, воздухе и мелких частиц в воде. Люди увеличивают его концентрацию в результате промышленной деятельности и сжигания ископаемых продуктов. Этот металл, полученный искусственным путём, также может попадать в почву на поверхность воды в качестве пестицида.
Высокотоксичные концентрации в почве могут вызвать воспаление клеточной стенки растений, жжение листьев и коричневые пятна на них. Недостаток этого элемента может также вызывать эти эффекты.
Меры предосторожности
![Неблагоприятное воздействие марганца]()
Марганец является важным элементом, но длительное воздействие его соединений может вызвать неблагоприятное воздействие на нервную, дыхательную систему и создать другие проблемы со здоровьем
Эти проблемы включают слабость, сонливость, усталость, эмоциональные нарушения и даже паралич. Единственный способ получить такую большую дозу — работа на фабрике или в шахте. Наиболее распространённые случаи отравления связаны с производством стали, керамики, стекла, краски, линолеума, фосфора, сухих батарей и фейерверков.
Читайте также:











