Как сделать электронную формулу по химии
Добавил пользователь Дмитрий К. Обновлено: 19.09.2024
Элементы побочной подгруппы еще называют d-элементами или переходными металлами. Они отличаются тем, что их валентные электроны расположены не только на s-подуровне внешнего энергетического слоя, но и на d-подуровне предвнешнего слоя. Валентными электронами называют те, что способны участвовать в образовании химической связи.
Что бы построить модель атома такого элемента, нам необходимо знать одно важное отличие этих элементов от элементов А-подгрупп: если у элементов главных (А) подгрупп количество электронов на внешнем уровне определяется по номеру группы (например, у лития один электрон на внешнем слое, у бериллия – два, у бора – три и так далее), то у элементов побочных подгрупп это количество не зависит от номера группы.
Для определения количества электронов на внешнем уровне, легче всего просто запомнить несколько распространённых примеров (они выделены красным):
Количество электронов на внешнем уровне
Cu, Ag, Au, Nb, Cr, Mo, Ru, Rh, Pt, Ds
Все остальные элементы B-подгрупп, кроме палладия.
Остальные правила работают как с элементами А-подгрупп, так и с элементами Б-подгрупп. Например, заряд ядра определяется по порядковому номеру элемента, количество энергетических уровней по расположению в определенном периоде.
Рассмотрим конфигурацию нескольких элементов побочных подгрупп:
Построение структурно-электронной формулы элементов B-подгрупп
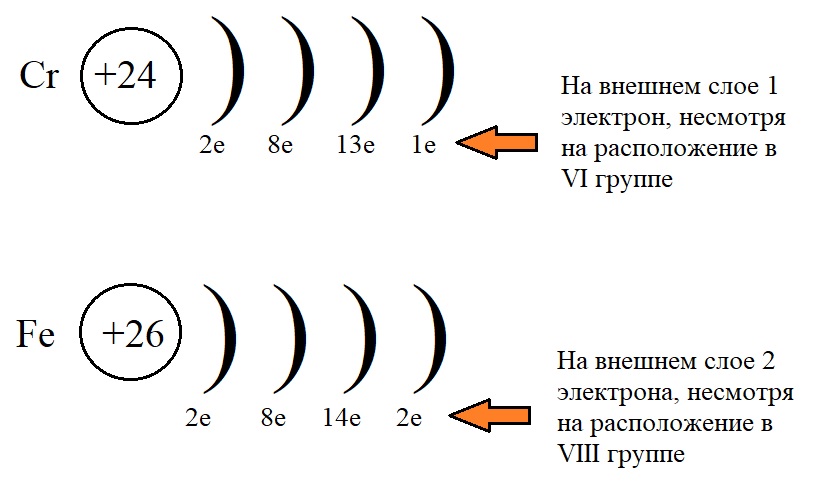
Конфигурация хрома и железа
На рисунке показано, что несмотря на положение элементов в определенных подгруппах, количество электронов у них не равно этой группе.
Для сравнения изучим еще один рисунок, на котором мы можем сравнить элементы А- и Б-подгрупп одной и той же группы:
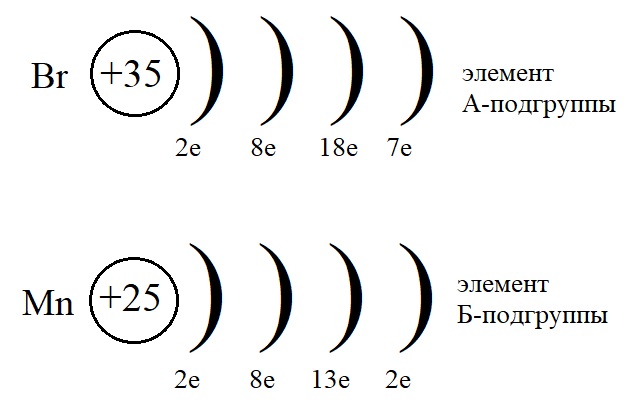
На этом рисунке мы снова можем убедиться, что элементы, находящиеся в одной и той же группе. В одном и том же периоде, но в разных подгруппах имеют разное строение.
Что бы разобраться, почему эти элементы называются d-элементами, разберем структурно-электронные формулы некоторых из них, например, хрома, железа и марганца, строение которых описывалось выше. Как уже было сказано, у этих элементов валентными являются не только внешний. Но и предвнешний уровень.
3s 2 3p 6 3d 5 4s 1
3s 2 3p 6 3d 6 4s 2
3s 2 3p 6 3d 5 4s 2
d-орбиталь содержит неспаренные электроны, которые могут вступать в химическую связь. Поэтому высшая валентность хрома равна не двум (по количеству электронов на внешнем уровне), а шести – по общему количеству электронов внешнего энергетического уровня и d-электронов предвнешнего уровня.
Вы можете встретить немного измененный порядок заполнения орбиталей, например, у марганца: 3s 2 3p 6 4s 2 3d 5 . s- и d-подуровень поменялись местами, в таких формулах учтен уровень энергии орбиталей: чем меньшей энергией обладает орбиталь, тем быстрее она будет заполняться электронами.
Правильнее будет заполнять электроны в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p…
Тренировочные задания ЕГЭ
Задание 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных элементов имеют электронную конфигурацию внешнего энергетического уровня ns 2 (n-1) d 10
Решение задания:
Для начала разберемся со страшной формулой ns 2 (n-1) d 10 . Попробуем заменить переменную n на любое число, например, на 4, тогда мы получим 4s 2 (4-1)d 10 или 4s 2 3d 10 . Эта формула отображает порядок распределения электронов согласно их энергии. Если для нас такой порядок непривычен, то мы можем поменять его местами, тогда получим 3d 10 4s 2 . Получившаяся формула приблизительна, вместо нее может быть 4d 10 5s 2 или 5d 10 6s 2 , но по этой формуле мы понимаем, что должны искать элемент с двумя электронами на внешнем энергетическом уровне (это приводит к тому, что медь выбывает из списка претендентов на правильный ответ), и элемент должен иметь d-орбиталь на внешнем уровне (кальций и стронций выпадают)
Верный ответ: 23
Задание 2.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных в ряду элементов не имеют на внешнем энергетическом уровне неспаренных электронов.
Решение: построим электронные конфигурации данных атомов.
Сурьма – Sb, элемент главной подгруппы пятой группы (А), у таких элементов валентные электроны находятся только на внешнем слое: 5s 2 5p 3 , что соответствует структурно-электронной формуле:
Элемент имеет три неспаренных p-электрона.
Последовательность расположения электронов на энергетических уровнях выражается следующим рядом чисел:
\u0414\u0430\u043b\u044c\u0448\u0435 \u0442\u0440\u0435\u0442\u0438\u0439 \u0443\u0440\u043e\u0432\u0435\u043d\u044c - 3s\u00b2 \u0438 3\u04406 (\u0442\u043e\u0436\u0435 6 \u0432\u0432\u0435\u0440\u0445\u0443 \u043f\u0438\u0448\u0435\u043c)
\u0418 \u0442\u0430\u043a \u0434\u0430\u043b\u0435\u0435 (\u0434\u0443\u043c\u0430\u044e, \u0447\u0442\u043e d \u0438 f \u0442\u0435\u0431\u0435 \u0435\u0449\u0451 \u043d\u0435 \u043d\u0443\u0436\u043d\u044b). \u0422\u0430\u0431\u043b\u0438\u0446\u0430 \u041c\u0435\u043d\u0434\u0435\u043b\u0435\u0435\u0432\u0430 \u0441\u0438\u0441\u0442\u0435\u043c\u0430\u0442\u0438\u0437\u0438\u0440\u043e\u0432\u0430\u043d\u0430 \u0442\u0430\u043a, \u0447\u0442\u043e \u043a\u043e\u043b\u0438\u0447\u0435\u0441\u0442\u0432\u043e \u044d\u043b\u0435\u043a\u0442\u0440\u043e\u043d\u043e\u0432 \u0432 \u0430\u0442\u043e\u043c\u0430\u0445 \u044d\u043b\u0435\u043c\u0435\u043d\u0442\u043e\u0432 \u0440\u0430\u0441\u0442\u0451\u0442 \u0441 \u043f\u043e\u0440\u044f\u0434\u043a\u043e\u0432\u044b\u043c \u043d\u043e\u043c\u0435\u0440\u043e\u043c.
\u041f\u0440\u0438\u0432\u0435\u0434\u0443 \u043f\u0440\u0438\u043c\u0435\u0440 \u0441\u0442\u0440\u0443\u043a\u0442\u0443\u0440\u043d\u043e\u0439 \u044d\u043b\u0435\u043a\u0442\u0440\u043e\u043d\u043d\u043e\u0439 \u0444\u043e\u0440\u043c\u0443\u043b\u044b \u00a0\u0425\u043b\u043e\u0440\u0430:
Cl - 1s\u00b2\u00a02s\u00b2\u00a02p6\u00a03s\u00b2 3p5
\u0412 3\u04405 \u043f\u0438\u0448\u0435\u043c \u043f\u044f\u0442\u0451\u0440\u043a\u0443, \u043f\u043e\u0442\u043e\u043c\u0443 \u0447\u0442\u043e \u044d\u043b\u0435\u043a\u0442\u0440\u043e\u043d \u0425\u043b\u043e\u0440\u0430, \u0441\u043e\u043e\u0442\u0432\u0435\u0442\u0441\u0442\u0432\u0443\u044e\u0449\u0438\u0439 \u0435\u0433\u043e \u043f\u044f\u0442\u043e\u043c\u0443 \u043f\u043e\u0440\u044f\u0434\u043a\u043e\u0432\u043e\u043c\u0443 \u043d\u043e\u043c\u0435\u0440\u0443 \u0432 \u0440-\u043e\u0440\u0431\u0438\u0442\u0430\u043b\u0438 \u0442\u043e\u0436\u0435 \u0443\u0447\u0438\u0442\u044b\u0432\u0430\u0435\u0442\u0441\u044f \u043f\u0440\u0438 \u0437\u0430\u043f\u0438\u0441\u0438.
\u041e\u0442\u043c\u0435\u0442\u044c \u043c\u043e\u0439 \u043e\u0442\u0432\u0435\u0442 \u043a\u0430\u043a \u043b\u0443\u0447\u0448\u0438\u0439. \u041c\u043d\u0435 \u043e\u0447\u0435\u043d\u044c \u043d\u0443\u0436\u043d\u0430 \u0442\u0432\u043e\u044f \u043f\u043e\u043c\u043e\u0449\u044c, \u0432\u0435\u0434\u044c \u044f \u0441\u0442\u0430\u0440\u0430\u043b\u0430\u0441\u044c \u043f\u043e\u043c\u043e\u0447\u044c \u0442\u0435\u0431\u0435.">]" data-testid="answer_box_list">

P и s - это орбитали электронных уровней. Есть p, s, d и f-орбитали. Всего есть 7 уровней. Первый уровень содержит только 1s орбиталь, на которой помещаются только 2 электрона (т.е. пишем 1s²). Это электроны водорода и гелия в таблице. Ниже в таблице - литий и берили - 2s², и бор, углерод, азот, кислород, фтор и неон - это 2p6 (верхний индекс) в p-орбитали могут расположиться только 6 электронов.
Дальше третий уровень - 3s² и 3р6 (тоже 6 вверху пишем)
И так далее (думаю, что d и f тебе ещё не нужны). Таблица Менделеева систематизирована так, что количество электронов в атомах элементов растёт с порядковым номером.
Приведу пример структурной электронной формулы Хлора:
Cl - 1s² 2s² 2p6 3s² 3p5
В 3р5 пишем пятёрку, потому что электрон Хлора, соответствующий его пятому порядковому номеру в р-орбитали тоже учитывается при записи.
Отметь мой ответ как лучший. Мне очень нужна твоя помощь, ведь я старалась помочь тебе.
Новые вопросы в Химия
СРОЧНООООООООООООООООООООО. обчисліть масові частки елементів у сульфур |v оксид та сульфур v| оксид
Помогите пожалуйста!1. Найди на первом игровом поле ряд или столбик, в которых степень окисления серыравна -ІІ.2. Найдите на втором игровом поле ряд и … ли столбик, в которых степень окисления хромаравна VI.
помогите,пожалуйста,решить!!Задачи на растворы образец решения задач – учебник - стр. 105-пример 1 1). В 250 г воды растворили 50 г соли. Найдите масс … овую долю соли в этом растворе. 2) В результате выпаривания 500 г раствора образовалось 50 г соли. Найдите массовую долю соли. образец решения задач – учебник - стр. 106-пример 2 3. Сколько воды и соли надо взять для приготовления 400 г 10% раствора соли Подумать самим. 3. В 200 г 10% раствора добавили 10 г соли. Найдите массовую долю соли в новом растворе. 4. В 200 г 10% раствора добавили 10 г воды. Найдите массовую долю соли в новом растворе.
Приведите 5 примеров элементов из щелочных металлов, галогенов, инертных элементов. помогите пожалуйста
Выясним, как составить электронную формулу химического элемента. Этот вопрос является важным и актуальным, так как дает представление не только о строении, но и о предполагаемых физических и химических свойствах рассматриваемого атома.
Правила составления
Для того чтобы составить графическую и электронную формулу химического элемента, необходимо иметь представление о теории строения атома. Начнем с того, что есть два основных компонента атома: ядро и отрицательные электроны. Ядро включает в себя нейтроны, которые не имеют заряда, а также протоны, обладающие положительным зарядом.
Рассуждая, как составить и определить электронную формулу химического элемента, отметим, что для нахождения числа протонов в ядре, потребуется периодическая система Менделеева.
Номер элемента по порядку соответствует количеству протонов, находящихся в его ядре. Номер периода, в котором располагается атом, характеризует число энергетических слоев, располагаются на которых электроны.
Для определения количества нейтронов, лишенных электрического заряда, необходимо из величины относительной массы атома элемента, отнять его порядковый номер (количество протонов).

Инструкция
Для того чтобы понять, как составить электронную формулу химического элемента, рассмотрим правило заполнения отрицательными частицами подуровней, сформулированное Клечковским.
В зависимости от того, каким запасом свободной энергии обладают свободные орбитали, составляется ряд, характеризующий последовательность заполнения уровней электронами.
Каждая орбиталь содержит всего два электрона, которые располагаются антипараллельными спинами.
Для того чтобы выразить структуру электронных оболочек, применяют графические формулы. Как выглядят электронные формулы атомов химических элементов? Как составлять графические варианты? Эти вопросы включены в школьный курс химии, поэтому остановимся на них подробнее.
Существует определенная матрица (основа), которую используют при составлении графических формул. Для s-орбитали характерна только одна квантовая ячейка, в которой противоположно друг другу располагается два электрона. Их в графическом виде обозначаются стрелками. Для р-орбитали изображают три ячейки, в каждой также находится по два электрона, на d орбитали располагается десять электронов, а f заполняется четырнадцатью электронами.
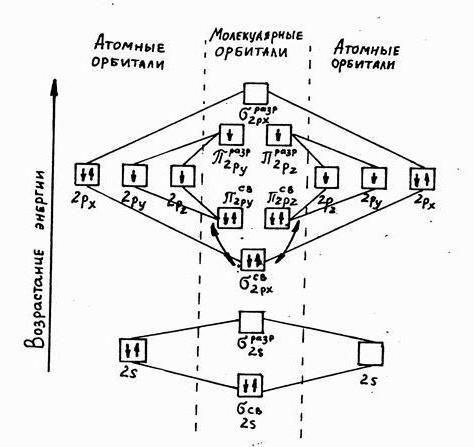
Примеры составления электронных формул
Продолжим разговор о том, как составить электронную формулу химического элемента. Например, нужно составить графическую и электронную формулу для элемента марганца. Сначала определим положение данного элемента в периодической системе. Он имеет 25 порядковый номер, следовательно, в атоме располагается 25 электронов. Марганец - это элемент четвертого периода, следовательно, у него четыре энергетических уровня.
Как составить электронную формулу химического элемента? Записываем знак элемента, а также его порядковый номер. Пользуясь правилом Клечковского, распределяем по энергетическим уровням и подуровням электроны. Последовательно располагаем их на первом, втором, а также третьем уровне, вписывая в каждую ячейку по два электрона.
Далее суммируем их, получая 20 штук. Три уровня в полном объеме заполнены электронами, а на четвертом остается только пять электронов. Учитывая, что для каждого вида орбитали характерен свой запас энергии, оставшиеся электроны распределяем на 4s и 3d подуровень. В итоге готовая электронно-графическая формула для атома марганца имеет следующий вид:
1s2 / 2s2, 2p6 / 3s2, 3p6 / 4s2, 3d3
Практическое значение
С помощью электронно-графических формул можно наглядно увидеть число свободных (неспаренных) электронов, определяющих валентность данного химического элемента.
Предлагаем обобщенный алгоритм действий, с помощью которого можно составить электронно-графические формулы любых атомов, располагающихся в таблице Менделеева.
В первую очередь необходимо определить количество электронов, используя периодическую систему. Цифра периода указывает на численность энергетических уровней.
Принадлежность к определенной группе связана с количеством электронов, находящихся на наружном энергетическом уровне. Подразделяют уровни на подуровни, заполняют их с учетом правила Клечковского.

Заключение
Выясним, как составить электронную формулу химического элемента. Этот вопрос является важным и актуальным, так как дает представление не только о строении, но и о предполагаемых физических и химических свойствах рассматриваемого атома.
Правила составления
Для того чтобы составить графическую и электронную формулу химического элемента, необходимо иметь представление о теории строения атома. Начнем с того, что есть два основных компонента атома: ядро и отрицательные электроны. Ядро включает в себя нейтроны, которые не имеют заряда, а также протоны, обладающие положительным зарядом.
Рассуждая, как составить и определить электронную формулу химического элемента, отметим, что для нахождения числа протонов в ядре, потребуется периодическая система Менделеева.
Номер элемента по порядку соответствует количеству протонов, находящихся в его ядре. Номер периода, в котором располагается атом, характеризует число энергетических слоев, располагаются на которых электроны.
Для определения количества нейтронов, лишенных электрического заряда, необходимо из величины относительной массы атома элемента, отнять его порядковый номер (количество протонов).

Инструкция
Для того чтобы понять, как составить электронную формулу химического элемента, рассмотрим правило заполнения отрицательными частицами подуровней, сформулированное Клечковским.
В зависимости от того, каким запасом свободной энергии обладают свободные орбитали, составляется ряд, характеризующий последовательность заполнения уровней электронами.
Каждая орбиталь содержит всего два электрона, которые располагаются антипараллельными спинами.
Для того чтобы выразить структуру электронных оболочек, применяют графические формулы. Как выглядят электронные формулы атомов химических элементов? Как составлять графические варианты? Эти вопросы включены в школьный курс химии, поэтому остановимся на них подробнее.
Существует определенная матрица (основа), которую используют при составлении графических формул. Для s-орбитали характерна только одна квантовая ячейка, в которой противоположно друг другу располагается два электрона. Их в графическом виде обозначаются стрелками. Для р-орбитали изображают три ячейки, в каждой также находится по два электрона, на d орбитали располагается десять электронов, а f заполняется четырнадцатью электронами.

Примеры составления электронных формул
Продолжим разговор о том, как составить электронную формулу химического элемента. Например, нужно составить графическую и электронную формулу для элемента марганца. Сначала определим положение данного элемента в периодической системе. Он имеет 25 порядковый номер, следовательно, в атоме располагается 25 электронов. Марганец - это элемент четвертого периода, следовательно, у него четыре энергетических уровня.
Как составить электронную формулу химического элемента? Записываем знак элемента, а также его порядковый номер. Пользуясь правилом Клечковского, распределяем по энергетическим уровням и подуровням электроны. Последовательно располагаем их на первом, втором, а также третьем уровне, вписывая в каждую ячейку по два электрона.
Далее суммируем их, получая 20 штук. Три уровня в полном объеме заполнены электронами, а на четвертом остается только пять электронов. Учитывая, что для каждого вида орбитали характерен свой запас энергии, оставшиеся электроны распределяем на 4s и 3d подуровень. В итоге готовая электронно-графическая формула для атома марганца имеет следующий вид:
1s2 / 2s2, 2p6 / 3s2, 3p6 / 4s2, 3d3

Практическое значение
С помощью электронно-графических формул можно наглядно увидеть число свободных (неспаренных) электронов, определяющих валентность данного химического элемента.
Предлагаем обобщенный алгоритм действий, с помощью которого можно составить электронно-графические формулы любых атомов, располагающихся в таблице Менделеева.
В первую очередь необходимо определить количество электронов, используя периодическую систему. Цифра периода указывает на численность энергетических уровней.
Принадлежность к определенной группе связана с количеством электронов, находящихся на наружном энергетическом уровне. Подразделяют уровни на подуровни, заполняют их с учетом правила Клечковского.

Заключение
Читайте также:

