Как сделать электролиз
Обновлено: 04.07.2024
Перед тем, как сделать водородный генератор, необходимо изучить все тонкости - экономическую целесообразность, безопасность. Предлагаем несколько простых схем и конструкций водородного генератора.
Описание и принцип работы водородного генератора
Есть несколько методик выделения водорода и из других веществ, перечислим наиболее распространенные:
- Электролиз, данная методика наиболее простая и может быть реализована в домашних условиях. Через водный раствор, содержащий соль, пропускается постоянный электрический ток, под его воздействием происходит реакция, которую можно описать следующим уравнением: 2NaCl + 2H2O→2NaOH + Cl2 + H2↑. В данном случае пример приведен для раствора обычной кухонной соли, что не лучший вариант, поскольку выделяющийся хлор является ядовитым веществом. Заметим, что полученный данным способом водород наиболее чистый (порядка 99,9%).
- Путем пропускания водяного пара над каменноугольным коксом, нагретым до температуры 1000°С, при таких условиях протекает следующая реакция: Н2О + С ⇔ СО↑ + H2↑.
- Добыча из метана путем конверсии с водяным паром (необходимое условие для реакции – температура 1000°С): СН4 + Н2О ⇔ СО + 3Н2. Второй вариант – окисление метана: 2СН4 + О2 ⇔ 2СО + 4Н2.
- В процессе крекинга (переработки нефти) водород выделяется в качестве побочного продукта. Заметим, что в нашей стране все еще практикуется сжигание этого вещества на некоторых нефтеперерабатывающих заводах ввиду отсутствия необходимого оборудования или достаточного спроса.
Из перечисленных вариантов последний наименее затратный, а первый наиболее доступный, именно он положен в основу большинства генераторов водорода, в том числе и бытовых. Их принцип действия заключается в том, что в процессе пропускания тока через раствор, положительный электрод притягивает отрицательные ионы, а электрод с противоположным зарядом – положительные, в результате происходит расщепление вещества.

Пример электролиза на растворе хлорида натрия
Основные достоинства отопления на водороде
Данный способ обогрева дома имеет несколько существенных преимуществ, которыми обусловлена возрастающая популярность системы.
- Впечатляющий КПД, который нередко достигает 96%.
- Экологичность. Единственный побочный продукт, выделяющийся в атмосферу – это водяной пар, который не способен навредить окружающей среде в принципе.
- Водородное отопление постепенно заменяет традиционные системы, освобождая людей от необходимости в добыче природных ресурсов – нефти, газа, угля.
- Водород действует без огня, тепловая энергия образуется путем каталитической реакции.
Область применения
Сегодня электролизёр — такое же привычное устройство, как и генератор ацетилена или плазменный резак. Изначально водородные генераторы использовались сварщиками, поскольку носить за собой установку весом всего несколько килограмм было намного проще, чем перемещать огромные кислородные и ацетиленовые баллоны. При этом высокая энергоёмкость агрегатов решающего значения не имела — всё определяло удобство и практичность. В последние годы применение газа Брауна вышло за рамки привычных понятий о водороде, как топливе для газосварочных аппаратов. В перспективе возможности технологии очень широки, поскольку использование HHO имеет массу достоинств.
- Сокращение расхода горючего на автотранспорте. Существующие автомобильные генераторы водорода позволяют использовать HHO как добавку к традиционному бензину, дизелю или газу. За счёт более полного сгорания топливной смеси можно добиться 20 – 25 % снижения потребления углеводородов.
- Экономия топлива на тепловых электростанциях, использующих газ, уголь или мазут.
- Снижение токсичности и повышение эффективности старых котельных.
- Многократное снижение стоимости отопления жилых домов за счёт полной или частичной замены традиционных видов топлива газом Брауна.
- Использование портативных установок получения HHO для бытовых нужд — приготовления пищи, получения тёплой воды и т. д.
- Разработка принципиально новых, мощных и экологичных силовых установок.
Конструкция водородного генератора
Для постройки генераторов водорода своими руками обычно берут в качестве основы классическую схему установки Брауна. Такой электролизёр средней мощности состоит из группы ячеек, каждая из которых содержит группу пластинчатых электродов. Мощность установки определяется общей площадью поверхности пластинчатых электродов.
Ячейки помещаются внутрь ёмкости, хорошо изолированной от внешней среды. На корпус резервуара выводятся патрубки для подключения водяной магистрали, вывода водорода, а также контактная панель подключения электричества.

Аппарат генерации водорода, спроектированный по схеме Брауна. По всем расчётам эта установка вполне должна обеспечить домашнее хозяйство теплом и светом. Другой вопрос – какие габариты и мощности позволят это сделать (+)
Схема генератора Брауна, кроме всего прочего, предусматривает наличие водяного затвора и обратного клапана. За счёт этих элементов организуется защита установки от обратного хода водорода. По такой схеме теоретически не исключается сборка водородной установки, к примеру, для организации отопления загородного дома.
Как изготовить генератор
Масса интернет-ресурсов публикуют самые разные схемы и чертежи генератора для получения водорода, но все они действуют по одному принципу. Мы предложим вашему вниманию чертеж простого устройства, взятый из научно-популярной литературы:

Здесь электролизер представляет собой группу металлических пластин, стянутых между собой болтами. Между ними установлены изоляционные прокладки, крайние толстые обкладки тоже изготовлены из диэлектрика. От штуцера, вмонтированного в одну из обкладок, идет трубка для подачи газа в сосуд с водой, а из него – во второй. Задача емкостей – отделять паровую составляющую и накапливать смесь водорода с кислородом, чтобы подавать его под давлением.
Совет. Электролитические пластины для генератора надо делать из нержавеющей стали, легированной титаном. Он послужит дополнительным катализатором реакции расщепления.

Пластины, что служат электродами, могут быть произвольного размера. Но надо понимать, что производительность аппарата зависит от их площади поверхности. Чем большее число электродов удастся задействовать в процессе, тем лучше. Но при этом и потребляемый ток будет выше, это следует учитывать. К концам пластин припаиваются провода, ведущие к источнику электричества. Здесь тоже есть поле для экспериментов: можно подавать на электролизер разное напряжение с помощью регулируемого блока питания.

В качестве электролизера можно применить пластиковый контейнер от водяного фильтра, поместив в него электроды из нержавеющих трубок. Изделие удобно тем, что его легко герметизировать от окружающей среды, выводя трубку и провода через отверстия в крышке. Другое дело, что этот самодельный водородный генератор обладает невысокой производительностью из-за малой площади электродов.

Делаем простейший генератор водорода своими руками пошагово
Расскажем, как можно сделать самодельный генератор для получения смеси водорода и кислорода (ННО). Его мощности на отопления дома не хватит, но для газовой горелки для резки металла количество полученного газа будет достаточным.

Рис. 8. Схема газовой горелки
Обозначения:
- а – сопло горелки;
- b – трубки;
- c – водные затворы;
- d – вода;
- е – электроды;
- f – герметичный корпус.
В первую очередь делаем электролизер, для этого нам понадобится герметичная емкость и электроды. В качестве последних используем стальные пластины (их размер выбираем произвольно, в зависимости от желаемой производительности), прикрепленные к диэлектрическому основанию. Соединяем между собой все пластины каждого из электродов.
Когда электроды готовы их надо укрепить в емкости таким образом, чтобы места подключения проводов питания были выше предполагаемого уровня воды. Провода от электродов идут к блоку питания на 12 вольт или автомобильному аккумулятору.
В крышке емкости делаем отверстие под трубку для выхода газа. В качестве водных затворов можно использовать обычные стеклянные банки емкостью 1 литр. Заполняем их на 2/3 водой и подключаем к электролизеру и горелке, как показано на рисунке 8.
Горелку лучше взять готовую, поскольку не каждый материал может выдержать температуру горения газа Брауна. Подключаем ее к выходу последнего водного затвора.
Наполняем электролизер водой, в которую добавлена обычная кухонная соль.
Подаем напряжение на электроды и проверяем работу устройства.
Отопление дома газом Брауна
Водород является самым распространенным химическим элементом, поэтому экономически выгодно его использовать.
Ученые, благодаря своим разработкам, позволили многим использовать такое устройство для получения газа. Установка способна генерировать водород (газ Брауна) и этот газ будет использован для получения энергии.
Можно это соединение представить химической формулой, как hho. Данный газ можно получить из воды с помощью метода электролиза. Есть много примеров в жизни, когда люди хотят свой дом отапливать оксиводородом. Но чтобы этот вид топлива получил популярность, надо сначала научиться получать его (газ Брауна) в бытовых условиях.
Пока еще нет технологии водородного отопления частного дома, которая была бы достаточно надежной.
Смотрите видео, в котором опытный пользователь разъясняет, как сделать водородный генератор своими руками:
Безопасность установки
Многие умельцы размещают пластины в пластиковых ёмкостях. Не стоит экономить на этом. Нужен бак из нержавеющего металла. Если его нет, можно использовать конструкцию с пластинами открытого типа. В последнем случае необходимо применять качественный изолятор тока и воды для надёжной работы реактора.

Датчик температуры рабочей жидкости, давления и амперметр не будут лишними в конструкции установки. Особое внимание стоит уделить гидрозатвору на выходе из реактора. Он жизненно необходим. Если произойдёт воспламенение смеси, такой клапан предотвратит распространение пламени в реактор.
Водородный генератор для отопления жилых и производственных помещений, работающий на тех же принципах, отличается в несколько раз большей производительностью реактора. В таких установках отсутствие гидрозатвора представляет смертельную опасность. Водородные генераторы на автомобилях в целях обеспечения безопасной и надёжной работы системы также рекомендуется оборудовать таким обратным клапаном.
Генератор промышленного изготовления
На уровне промышленного производства технологии изготовления водородных генераторов бытового назначения постепенно осваиваются и развиваются. Как правило, выпускаются энергетические станции домашнего применения, мощность которых не превышает 1 кВт.
Такой аппарат рассчитан на выработку водородного топлива в режиме постоянного функционирования не более чем в течение 8 часов. Главное их предназначение – энергоснабжение отопительных систем.
Также разрабатываются и производятся установки под эксплуатацию в составе кондоминиумов. Это уже более мощные конструкции (5-7 кВт), назначение которых не только энергетика отопительных систем, но также выработка электричества. Такой комбинированный вариант быстро набирает популярность в западных странах и в Японии.
Комбинированные водородные генераторы характеризуются как системы с высоким КПД и небольшим выбросом углекислого газа.

Пример реально действующей промышленно изготовленной станции мощностью до 5 кВт. Подобные установки в перспективе планируется делать под оснащение коттеджей и кондоминиумов
Планируется использовать самые разные типы топливных элементов в процессе разработки и производства:
- протонно-обменные мембранные;
- ортофосфорно-кислотные;
- протонно-обменные метанольные;
- щелочные;
- твердотельные оксидные.
Между тем процесс электролиза является обратимым. Этот факт говорит о том, что есть возможность получать уже нагретую воду без сжигания водорода.
Кажется, это очередная идея, ухватившись за которую можно запускать новый виток страстей, связанных с бесплатной добычей топлива для домашнего котла.
Экономическая целесообразность
В домашних условиях изготовить качественную водородную установку очень сложно. Мастеру придется учитывать массу параметров. Например, нужно точно подобрать металл для электродов. Он должен обладать определенными свойствами.

Всеми любимая нержавейка — доступное, но недолговечное решение. Топливные ячейки на них довольно быстро выйдут из строя.
Также при сборке гидролизатора нужно соблюдать монтажные размеры. Чтобы их получить, нужно произвести сложные расчеты с учетом качества воды, необходимой мощности на выходе и т. д.
При изготовлении устройства значение имеет даже сечение проводов, по которым на электроды подается ток. Речь идет не о производительности генератора, а о безопасности его эксплуатации, но и этот важный нюанс нужно учитывать.
Главная проблема таких приборов — большие затраты электричества для получения оксиводорода. Они превышают энергию, которую можно получить от сжигания такого топлива.
Из-за низкого КПД цена водородной установки для дома делает производство этого газа и его последующее использование для отопления невыгодным. Чем впустую расходовать электричество, проще установить любой электрокотел. Он будет эффективнее.

Что касается автомобильного транспорта, то здесь картина не сильно отличается. Да, можно сделать гидролизер для экономии топлива, но при этом снижается безопасность и надежность.
Единственное, где водород можно эффективно применять как топливо, — газосварка. Аппараты на hydrogen весят меньше, они компактнее, чем кислородные баллоны, но намного эффективнее. К тому же стоимость получения смеси здесь не играет никакой роли.
Давно хотели заняться химией? Для взрыва квартиры надоедливого соседа ещё пока рановато, но надо же с чего-нибудь начинать. В этом видео я покажу как провести электролиз поваренной соли дома - получится водород, гидроксид натрия и хлорид меди. Если же заменить одну из палочек (проводок с зарядом плюс) на углеродную - получится хлор, ядовитый зелёный газ. Вот им мы и будет травить соседа.
Если будет спрос, в следующий раз покажу как из обычной поваренной соли получить соляную кислоту (HCl) и едкий натр (NaOH) - начальный набор любого химика без закупки реактивов в хим маге.
Здравствуй новый день ))

Мой балкон - моя крепость. )


Сосед превратил пустырь в цветущий сад
Десять лет подряд он в каждую свободную минуту выходил на пустырь возле своего дома. Теперь на месте участка, заросшего травой и мусором, цветущий сад с редкими для севера деревьями, зонами отдыха и даже детской площадкой.

Магия гальванопластики
Как превратить высохший лист дуба в медный с помощью гальванопластики
Сернокислый электролит блестящего меднения

Ночник из картона своими руками
Привет, Друзья! В этом выпуске покажу как сделать ночник из картона своими руками.
Пустячок, а приятно
В этом году встретили Новый год в новой квартире и в процессе подготовки немного украсили подъезд: пара милых наклеек в лифте, небольшая инсталляция на первом этаже и лёгкий квест для наших и соседских детей в процессе которого они украсили новогодними шариками (приклеили по шарику) все двери в подъезде.
Получилось мило и нарядно.
И вот получили обратную связь:

Пустячок, а так приятно!
Приятно, что смогли поднять людям настроение и привнести свою лепту в создание праздничного настроения.
В следующем году обязательно повторим!
А может кто из соседей подключится :)
Серебряный шар
Изготовление зеркал способом серебрения основано на принципе осаждения (восстановления) из азотнокислого серебра металлического серебра.
Amalgama chto eto takoe 810x540
Осаждение серебра осуществляется при помощи восстановителей - инвертированного сахара, виннокаменной кислоты и др. и возможно только из щелочных растворов азотнокислого серебра.
Основными активными веществами, с помощью которых ведется процесс серебрения, являются соли серебра; главным образом азотнокислое серебро и восстановители. Для создания среды, благоприятствующей быстрому выделению серебра из растворов его солей, обычно пользуются аммиаком и едким натрием, или едким калием.
Необходимо указать, что создание щелочной среды еще не всегда бывает достаточным для успешного ведения процесса серебрения. Так, например, если применять сахар-рафинад в виде восстановителя, это не даст хороших результатов, так как сам сахар не обладает восстановительной способностью. Эта особенность свойственна только одной его составной части — виноградному сахару. Поэтому, для того чтобы восстановить металлическое серебро из раствора азотнокислого серебра при помощи сахара-рафинада, надо путем добавления небольшого количества серной или азотной кислоты разложить сахар на составные части.
Для успешного осуществления процесса серебрения необходимо создать определенные условия, при которых температура окружающей среды должна быть не выше 25°.
Так, например, если серебрение производить в обычных условиях, применяя в качестве восстановителя концентрированный раствор инвертированного сахара, то серебряный слой образуется через 10 минут и зеркало получается хорошего качества. При низкой окружающей температуре воздуха серебряный слой образуется только через 30 минут и качество зеркала будет плохое.
Горячий концентрированный раствор может дать хорошее качество зеркала, но практически процесс серебрения в этих условиях осуществить трудно, так как все металлическое серебро может быть выделено в сосудах прежде, чем произойдет осаждение серебра на поверхность стекла.
Все вещества, применяемые в процессе серебрения, должны быть химически чистыми. Это в равной степени относится и к воде, которая играет важную роль в подготовительных и вспомогательных процессах серебрения (промывка, разбавление растворов и т. п.), поэтому она должна быть дистиллированной.
Способы серебрения
Существуют два способа серебрения стекла: холодный и горячий.
При ведении процесса серебрения стекла горячим способом все операции с растворами на наводном столе производят с подогревом, три температуре наводного стола 35-40°.
При ведении серебрения холодным способом все операции с растворами и на наводном столе производят без подогрева, при температуре наводного веха, которая обычно бывает 25-26°.
air bubbles 3054937 1280
Горячий способ серебрения
Серебрение горячим способом производят на специальных, закрытого типа столах, обогреваемых паром или горячей водой, циркулирующей по трубам внутри стола.
Столы для этой цели применяют чугунные или деревянные обитые жестью снаружи и цинком изнутри, а крышки покрывают сланцевыми пластинами и водонепроницаемым составом, выдерживающим высокую температуру, или плотно спрессованным войлоком. Крышка не должна пропускать пар во время процесса серебрения, так как это может испортить серебряную амальгаму.
Процесс серебрения осуществляют следующим образом: предварительно промытое стекло укладывают на крышку горячего стола и покрывают серебрильной жидкостью, состоящей из раствора азотнокислого серебра, нашатырного спирта и едкого натра или едкого калия, к которым в самый последний момент примешивают восстановитель. Стол устанавливают в строго горизонтальном положении, чтобы уровень жидкости был одинаковым на всей поверхности стекла. С момента прибавления восстановителя жидкость отставляют в состоянии покоя на 10-15 минут, а затем раствор с поверхности стекла убирается ручной кожаной воздуходувкой.
Серебрение таким способом производят обычно два раза. Горячий способ более кропотлив и требует большой точности ведения процесса, но слой серебра получается более стойким.
Холодный способ серебрения
Холодный способ серебрения осуществляется наливным методом и с помощью пульверизатора.
Наливной метод состоит в следующем: смесь серебрильной жидкости и восстановителя быстро выливают на поверхность стекла, уложенного строго горизонтально на специальных столах. При выливании серебрильного раствора нужно следить, чтобы он равномерно распределялся по всей поверхности стекла. В зависимости от рецептуры серебрения продолжительность процесса осаждения серебра длится от 5 до 10 минут. Наибольшее количество серебра выделяется при первом заливе за первую минуту. Как правило, за 5-6 минут достигается максимальная толщина слоя серебра, и дальнейшее удерживание серебрильного раствора на поверхности стекла бесполезно.
Температура среды и температура растворов имеет при этом большое значение – оптимальный показатель 25°. При температуре ниже 25° осаждение серебра идет медленнее, а серебро за 6 минут полностью не осядет. Температура выше 25° не увеличивает интенсивность осаждения слоя серебра. Серебрение растворами, нагретыми до 40-60°, приводит к браку на зеркалах.
Время от времени жидкость с поверхности стекла сдувают при помощи ручных мехов. Отсутствие жидкости благоприятствует получению осадка в виде однородного слоя -пленки.
По окончании процесса выделения металлического серебра остаток серебрильной жидкости сливают с поверхности стекла, и оно сушится.
При серебрении методом пульверизации серебрильную жидкость и восстановитель не выливают, а распыляют по поверхности пульверизатором. Пульверизаторы бывают разных конструкций, вследствие чего различается принцип их действия.
Холодный способ серебрения проще и удобнее горячего, но слой серебра, нанесенный на стекло холодным способом, менее устойчив: если зеркало попадет в сырое помещение, металлический слой серебра начинает разлагаться, и на поверхности зеркала выступят различные пятна и полосы.

Схема электролиза без мембраны: два параллельных электрода располагаются на расстоянии в несколько сотен микрометров
Не секрет, что чистый водород — один из наиболее перспективных видов альтернативного топлива. Водород добывают из любого водного раствора, а при сгорании он превращается обратно в воду, что может быть прекраснее?
Проблема только в стоимости добычи водорода. Электролиз воды предполагает, что электроды погружаются в воду, а между ними находится полимерная мембрана. Ток идёт от катода к аноду, а на своём пути он (при помощи катализатора) расщепляет воду на кислород и водород. Полимерная мембрана выполняет важную функцию, разделяя получившиеся газы.
На сегодняшний в качестве мембраны с ионной проводимостью практически повсеместно используется нафион или другой тип мембраны. Но все они отличаются дороговизной и ограниченным сроком службы. К тому, мембраны требуют особых условий проведения электролиза. Например, нафион работает в жидкости только с низкой кислотностью и только с определёнными катализаторами.
Изобретение химиков из EPFL под руководством Деметри Псалтиса (Demetri Psaltis) позволяет избавиться от этих ограничений и намного удешевить электролиз воды.
Они провели ряд экспериментов с микроустройством, размещая электроды на разном расстоянии друг от друга и прогоняя между ними воду на разной скорости. Оказалось, что при определённом расстоянии между электродами H2 и O2 сами разлетаются в разные стороны, без всякой мембраны!

Причина такого поведения ионов — эффект Сегре-Зильберберга, когда при движении жидкости находящиеся в ней частицы поток уносит в стороны.

Учёные надеются, что им удастся приспособить прибор для работы с любыми видами жидких электролитов и любыми катализаторами, поскольку больше нет риска повреждения хрупкой мембраны. Исчезнут обязательные требования использовать только благородные металлы вроде платины из-за ограничений на кислотность (pH) жидкости.
Если получится масштабировать микроустройство до промышленного образца, то это кардинально снизит стоимость водорода, получаемого при электролизе воды.
Научная работа “A membrane-less electrolyzer for hydrogen production across the pH scale” опубликована в журнале “Energy & Environmental Science”, DOI: 10.1039/C5EE00083A (зеркало).
Электролиз (греч. elektron - янтарь + lysis — разложение) - химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
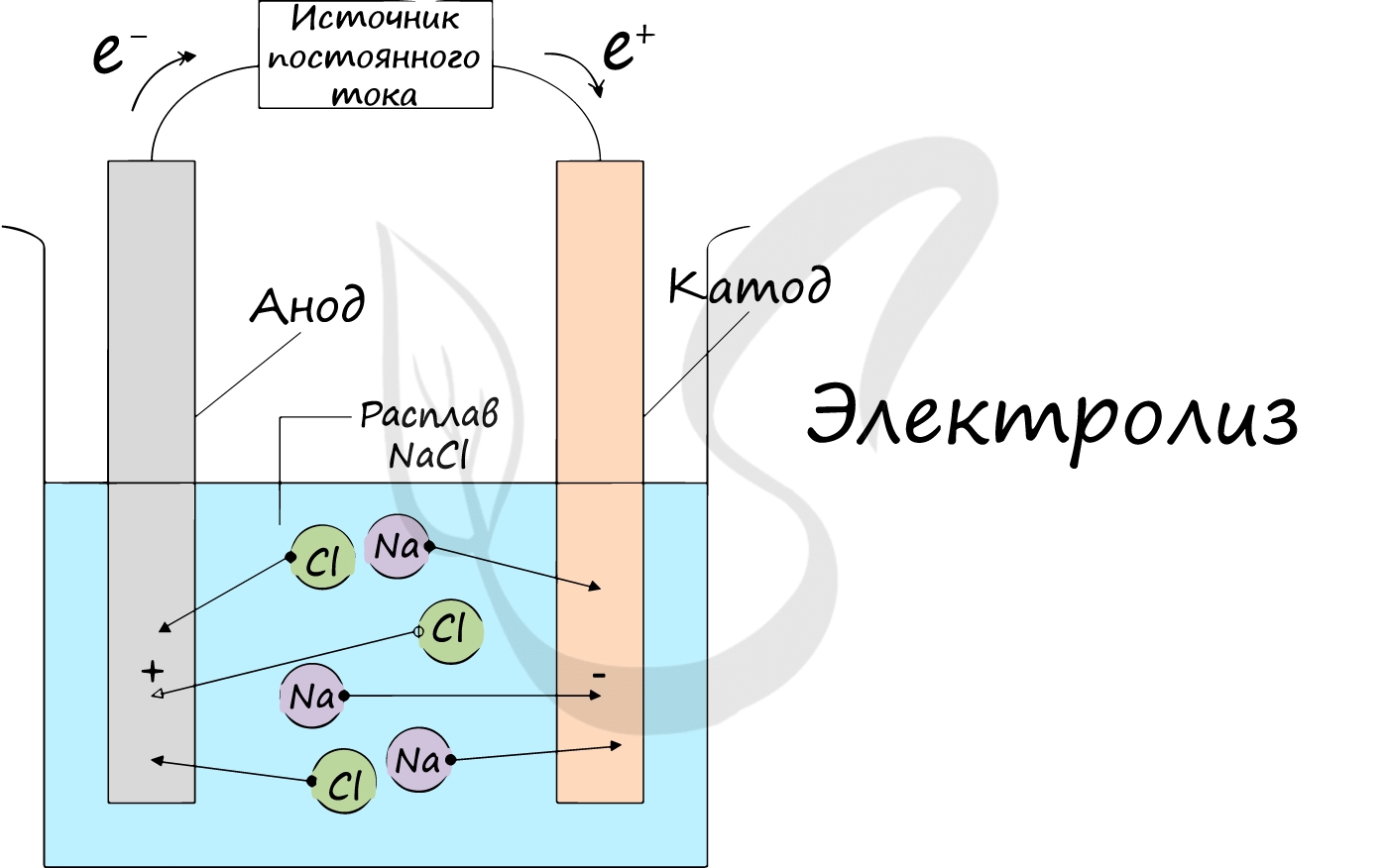
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы - положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) - на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды - выделяется водород.
В случае, если на катод поступают ионы водорода - H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + - 2e = H2
К аноду притягиваются анионы - отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl - , Br - , I - , F - , S 2- , CH3COO - .

При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- - на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор - если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор - самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ - CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
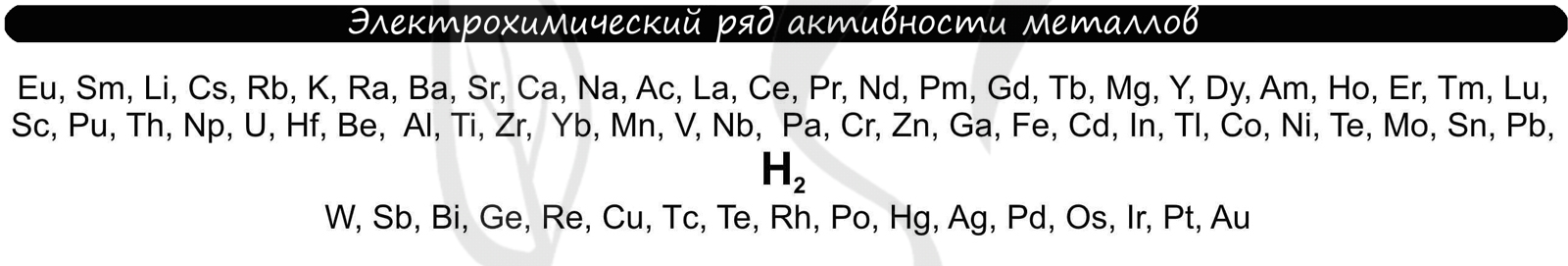
Теперь вы точно будете знать, что выделяется на катоде ;-)
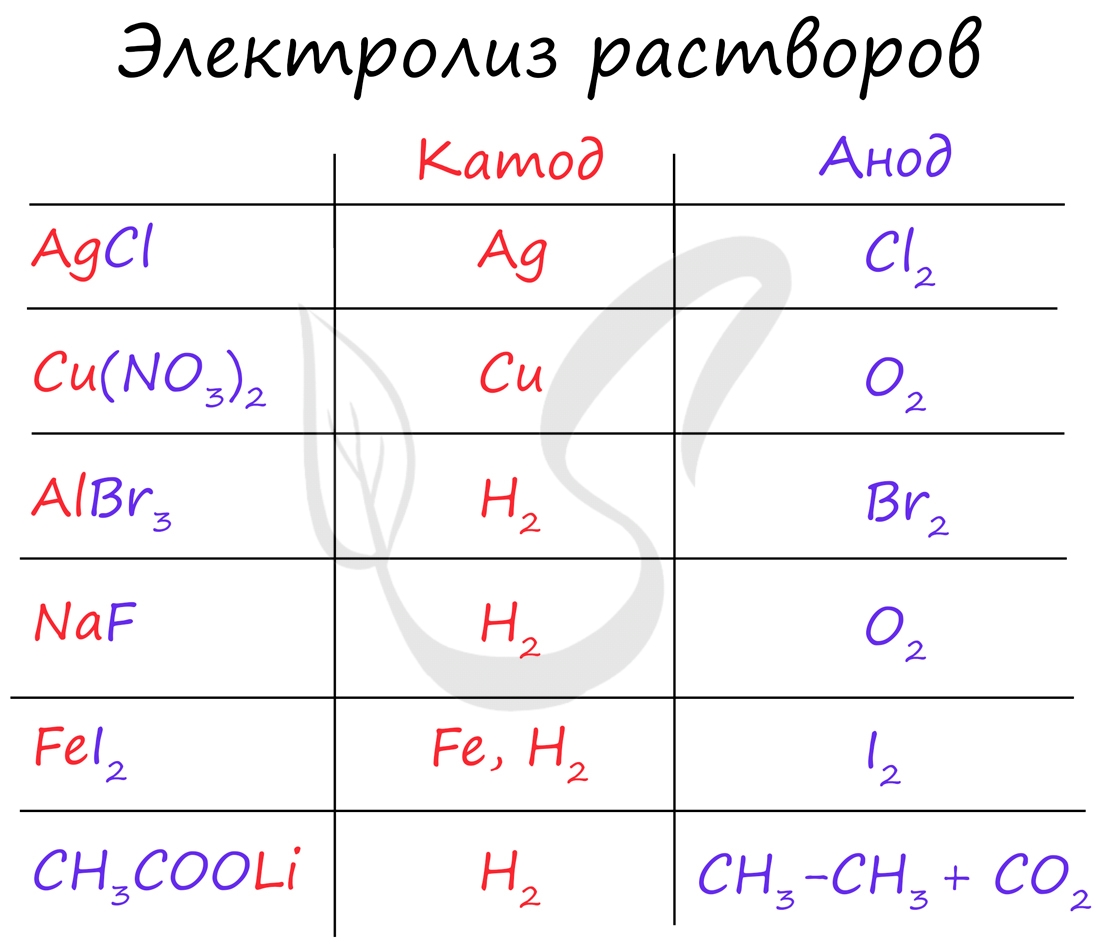
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись "NaOH", не подвергая его дальнейшему электролизу)
Натрий - активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген - хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно :) Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача - получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
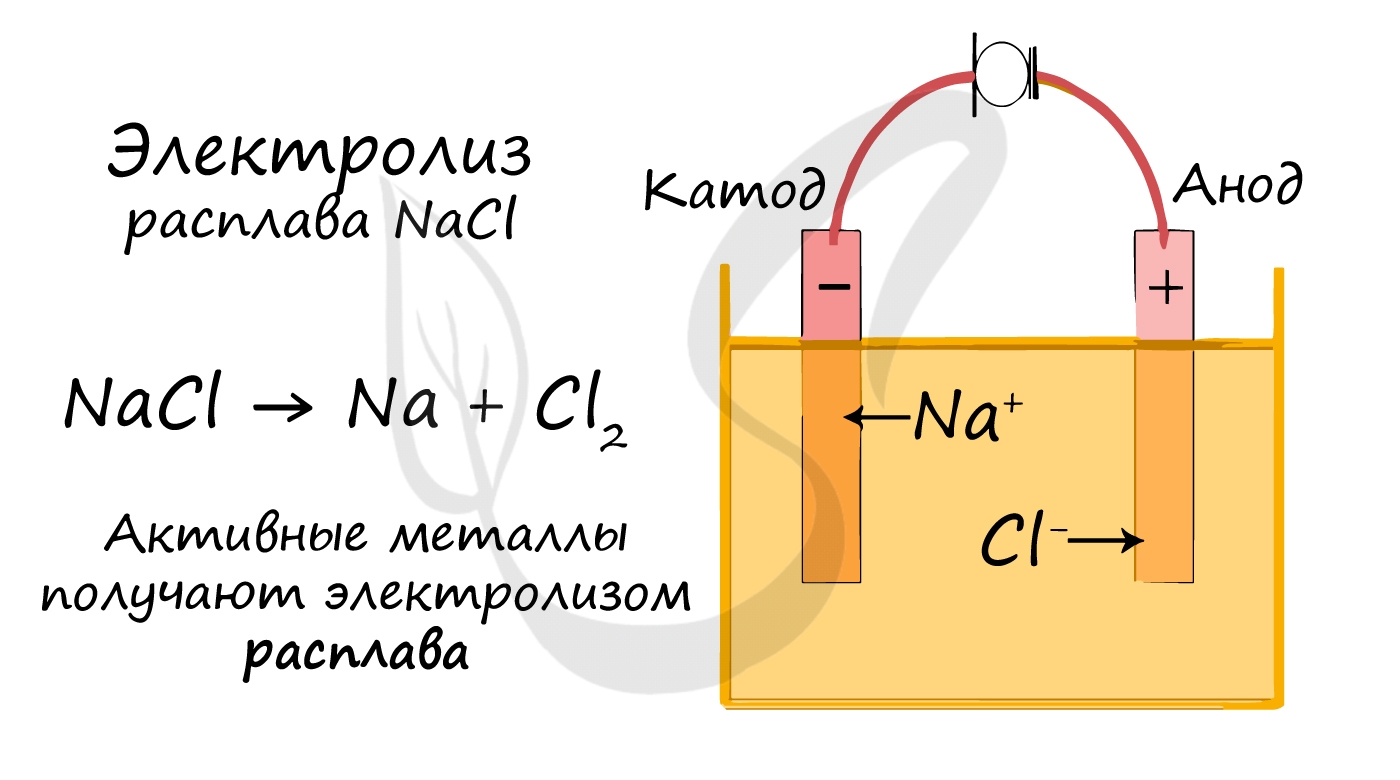
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

