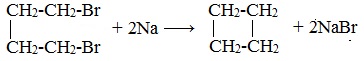Как сделать циклогексан
Добавил пользователь Валентин П. Обновлено: 04.10.2024
циклогексан представляет собой алкен или циклический олефин с молекулярной формулой C6H10. Он состоит из бесцветной жидкости, не растворим в воде и смешивается со многими органическими растворителями. Он характеризуется тем, что является легковоспламеняющимся, и в природе его обычно можно найти в каменноугольной смоле..
Циклогексен синтезируется путем частичного гидрирования бензола и дегидратации спирта циклогексанолом; то есть более ржавая форма. Как и другие циклоалкены, он подвергается реакциям электрофильного присоединения и со свободными радикалами; например, реакция галогенирования.
Этот циклический алкен (верхнее изображение) образует азеотропные смеси (не отделяемые дистилляцией) с низшими спиртами и уксусной кислотой. Он не очень стабилен при длительном хранении, так как разлагается под действием солнечного света и ультрафиолетового излучения..
Циклогексен используется в качестве растворителя и, следовательно, имеет множество применений, таких как: стабилизатор высокооктановых бензинов и для экстракции масел.
Но самое главное, что циклогексен служит промежуточным продуктом и сырьем для производства многих полезных соединений, среди которых: циклогексанон, адипиновая кислота, малеиновая кислота, циклогексан, бутадиен, циклогексилкарбоновая кислота и т. Д..
- 1 Структура циклогексена
- 1.1 Межмолекулярные взаимодействия
- 2.1 Химические названия
- 2.2 Молекулярный вес
- 2.3 Внешность
- 2,4 Запах
- 2.5 Точка кипения
- 2.6 Точка плавления
- 2.7 Температура вспышки
- 2.8 Растворимость в воде
- 2.9 Растворимость в органических растворителях
- 2.10 Плотность
- 2.11 Плотность паров
- 2.12 Давление пара
- 2.13 Самовоспламенение
- 2.14 Разложение
- 2.15 Вязкость
- 2.16 Теплота сгорания
- 2.17 Тепло испарения
- 2.18 Поверхностное натяжение
- 2.19 Полимеризация
- 2.20 Порог запаха
- 2.21 Показатель преломления
- 2,22 рН
- 2.23 Стабильность
- 2.24 Реакции
Структура циклогексена
![]()
Структура циклогексена с моделью сфер и стержней показана на изображении выше. Можно заметить шесть углеродных колец и двойную связь, обе ненасыщенности соединения. С этой точки зрения кажется, что кольцо плоское; но это совсем не так.
Для начала, атомы углерода двойной связи имеют sp-гибридизацию 2 , что дает им геометрию тригональной плоскости. Следовательно, эти два атома углерода и те, которые примыкают к ним, находятся в одной плоскости; в то время как два атома углерода на противоположном конце (к двойной связи) находятся выше и ниже указанной плоскости.
Нижнее изображение прекрасно иллюстрирует только что объясненное.
![]()
Обратите внимание, что черная полоса состоит из четырех атомов углерода: два из двойной связи, а другие прилегающие к ним. Открытая перспектива - это та, которая была бы получена, если бы зритель поместил свой глаз прямо перед двойной связью. Тогда видно, что углерод находится выше и ниже этой плоскости..
Поскольку молекула циклогексена не является статичной, два атома углерода будут обмениваться: один будет опускаться, а другой подниматься над плоскостью. Таким образом, вы ожидаете, что эта молекула будет вести себя.
Межмолекулярные взаимодействия
Циклогексен является углеводородом, и поэтому его межмолекулярные взаимодействия основаны на дисперсионных силах Лондона.
Это связано с тем, что молекула является неполярной, без постоянного дипольного момента, и ее молекулярный вес является фактором, который в наибольшей степени способствует сохранению ее когезии в жидкости..
Кроме того, двойная связь увеличивает степень взаимодействия, поскольку она не может двигаться с такой же гибкостью, как у других атомов углерода, и это способствует взаимодействию между соседними молекулами. По этой причине циклогексен имеет немного более высокую температуру кипения (83 ° C), чем циклогексан (81 ° C)..
Циклоалканы (циклопарафины, нафтены) - циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда - CnH2n.
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки "цикло-" к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д.
![Номенклатура циклоалканов]()
Как и у алканов, атомы углерода циклоалканов находятся в sp 3 гибридизации.
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
![Изомерия циклоалканов]()
Получение циклоалканов
-
Из ароматических углеводородов
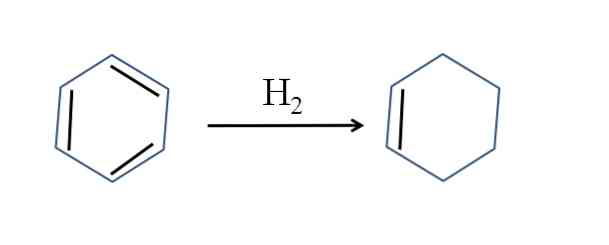
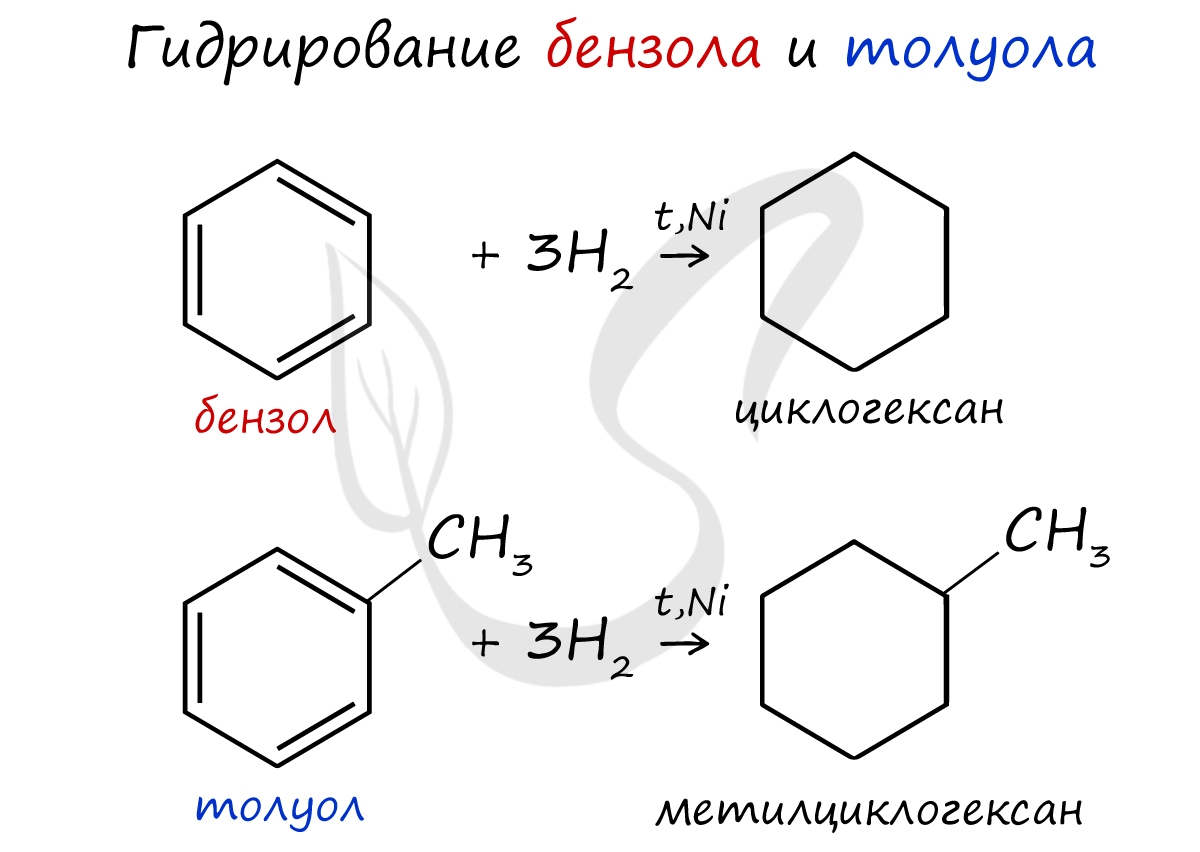
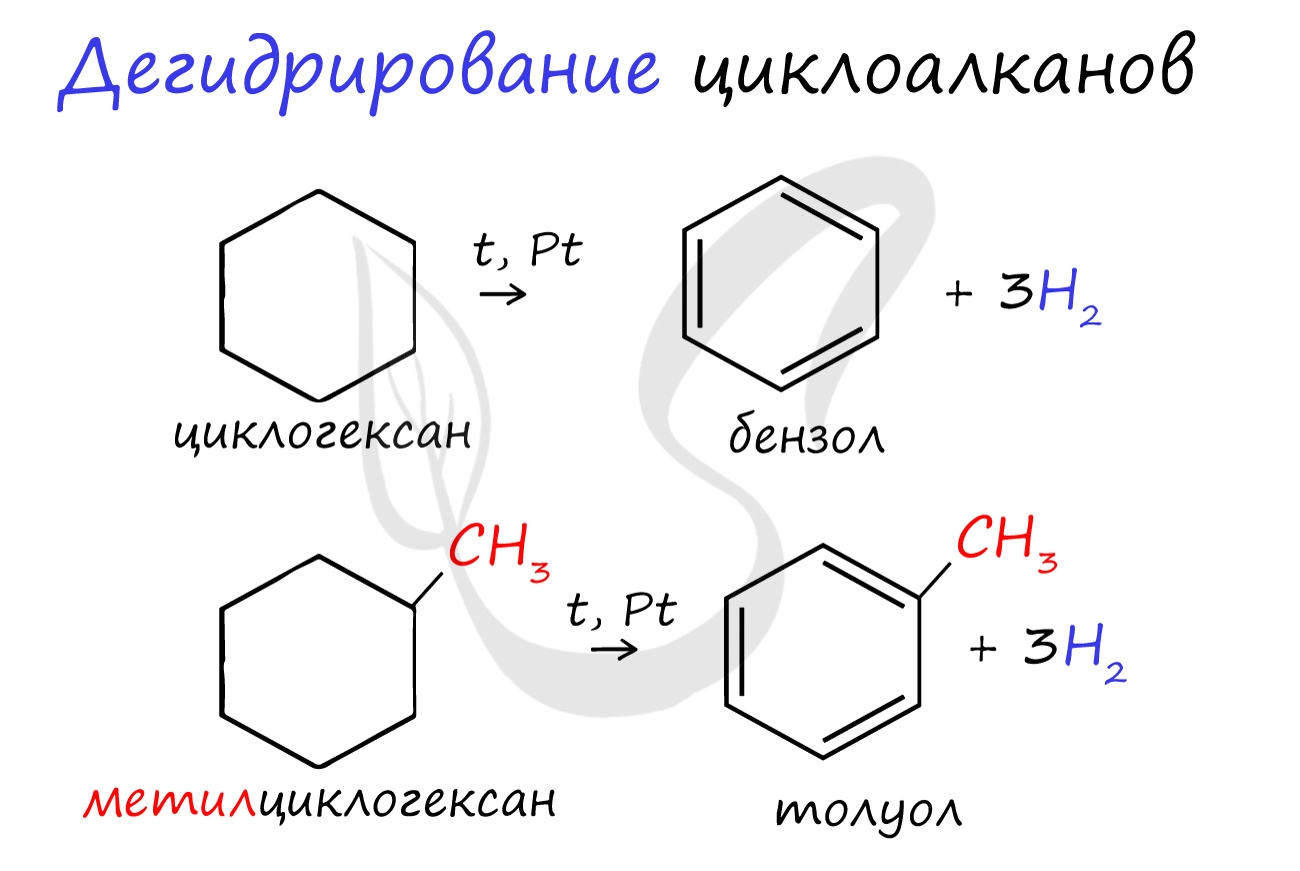
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.
![Дегидрирование бензола]()
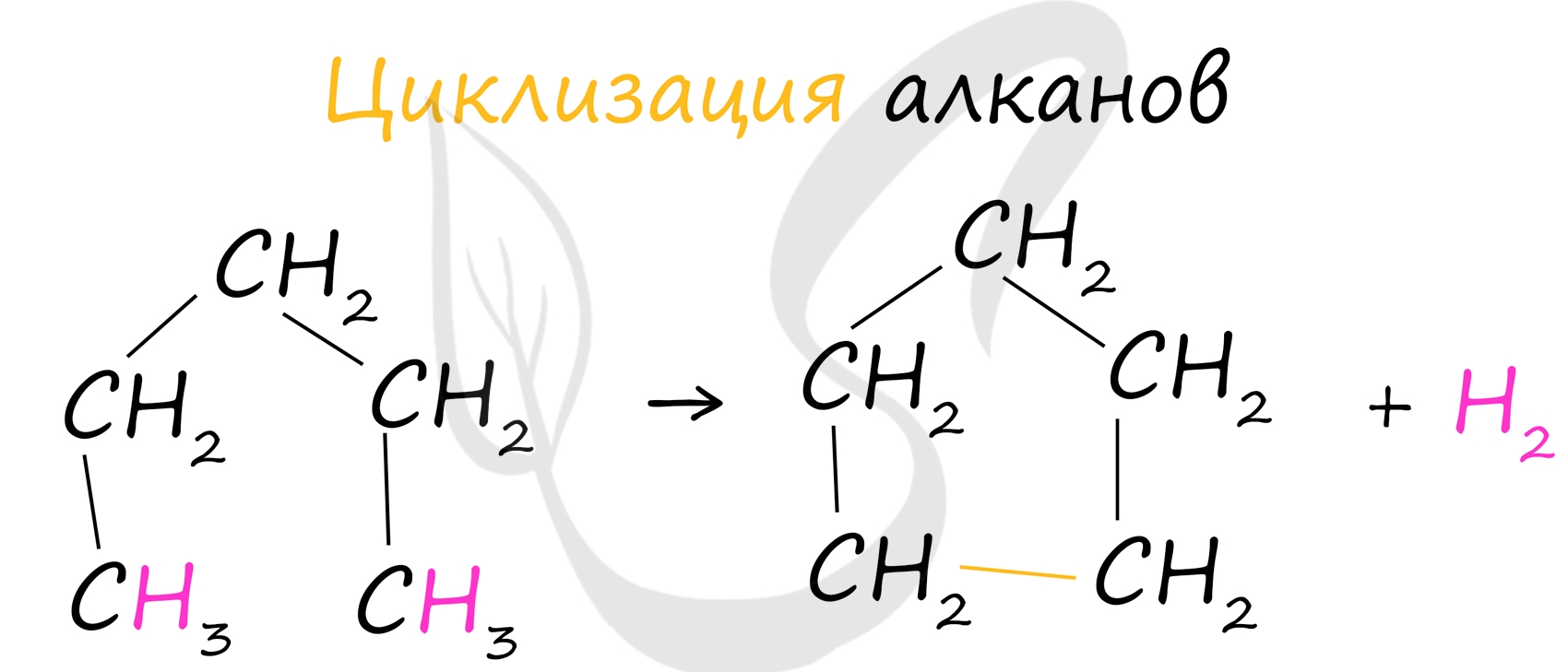
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
![Циклизация алканов]()
-
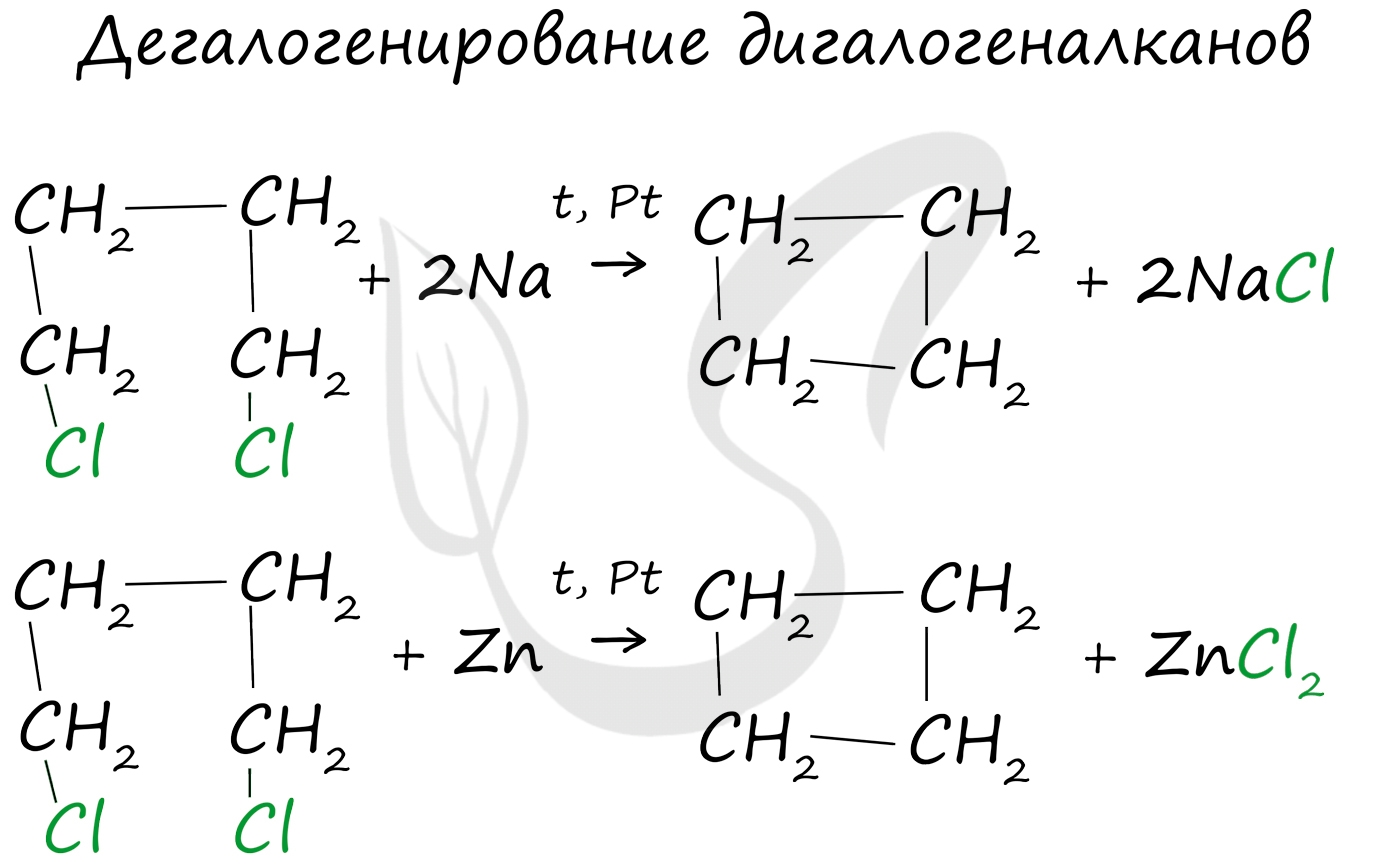
Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)
![Дегалогенирование дигалогеналканов]()
Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования (в рамках вопросов ЕГЭ - не вступают, но на самом деле эти реакции идут, просто крайне затруднены).
![Гидрирование циклоалканов]()
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
![Галогенирование циклоалканов]()
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
![Гидрогалогенирование циклоалканов]()
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов - гомологи бензола.
![Дегидрогалогенирование циклоалканов]()
В ходе нагревания с катализатором - AlCl3 циклоалканы образуют изомеры.
![Изомеризация циклоалканов]()
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
В промышленности
1. Из нефти (входят в состав нафтеновых нефтей)
Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий – нафтены). При переработке нефти выделяют главным образом циклоалканы С5 – С7.
2. Гидрирование циклоалкенов или ароматических углеводородов
Циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки:
3.Дегидроциклизация алканов
Важным промышленным способом получения циклоалканов С5 и С6 является реакция дегидроциклизации алканов.
В лаборатории
1. Циклизация дигалогеналканов
Действие активных металлов на дигалогензамещенные алканы (внутримолекулярная реакция Вюрца) приводит к образованию различных циклоалканов:
![]()
Вместо металлического натрия можно использовать порошкообразный цинк.
Строение образующегося циклоалкана определяется структурой исходного дигалогеналкана. Этим путем можно получать циклоалканы заданного строения. Например, для синтеза 1,3-диметилциклопентана следует использовать 1,5-дигалоген-2,4-диметилпентан:
![]()
Циклогексан содержится в нефти, и его можно извлекать из легких нефтяных фракции экстрактивной перегонкой, фракционной кристаллизацией и т.п. На практике циклогексан преимущественно получают каталитическим гидрированием бензола. Это объясняют трудностями, связанными с выделением чистого циклогексана из нефтяного сырья.
Окисление циклогексана можно осуществлять как в паровой, так и в жидкой фазе - некаталитическим путем или в присутствии катализатора.
Главным первичным продуктом окисления является гидроперекись циклогексила:
![]()
Каталитическое окисление циклогексана проводится в жидкой фазе воздухом или техническим кислородом при повышенном давлении и температуре. Катализаторами являются поливалентные металлы, например кобальт или медь в виде солей. Суммарный выход циклогексанола и циклогексанона достигает 85 %.
Наряду с циклогексанолом и циклогексаноном образуюся продукты более глубокого окисления, главным образом дикарбоновые кислоты (адипиновая, глутаровая и янтарная кислоты).
2. Дегидрирование (окисление) циклогексанола. Циклогексанол тоже можно перевести в циклогексанон окислением или дегидрированием.
Циклогексанон получают из циклогексанола окислением (окислительным дегидрированием)
![]()
![]()
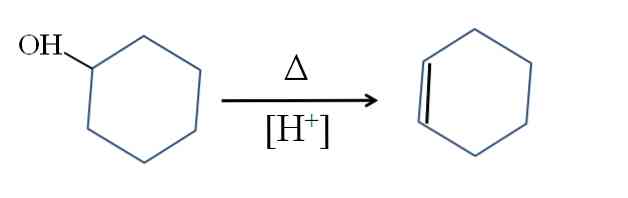
Процесс дегидрирования циклогексанола достаточно хорошо освоен в промышленности. Его проводят при 450 - 460 0 С над катализатором (оцинкованное железо). Кроме дегидрирования, при этом протекает побочная реакция дегидратации циклогексанола с образованием циклогексена
![]()
а также происходит частичное расщепление молекулы циклогексанола с выделением углерода, водорода и воды.
На этом способе снован первый из осуществленных в промышленности методов синтеза циклогексанона - из фенола с предварительном гидрированием его в циклогеканол:
![]()
3. Из анилина через циклогексиламин:
![]()
Ввиду меньшего числа стадий и потребности в дополнительных реагентах заслуживает предпочтение метод получения циклогексанона окислением циклогексана.
Физические и химические свойства
Циклогексанон (или кетогексаметилен или пимелинкетон) - это бесцветная жидкость, молекулярная масса 98,15; плотность 0,94; температура плавления - 45 0 С; температура кипения 156 0 С. Растворим в воде (2,4 31 ), этаноле, эфире.
Для циклогексанона (представителя кетонов) характерны реакции присоединения.
1. Реакции восстановления.
а. гидрирование в паровой фазе (использование молекулярного водорода)
![]()
б. восстановление в присутствии амальгамы цинка
![]()
2. Нуклеофильное присоединение
а. взаимодействие с аммиаком:
![]()
б. реакция с гидроксиламином (применяется для количественного определения кетонов):
![]()
в. реакция с гидразином:
![]()
![]()
![]()
3. Реакции с расширением цикла
а. реакция взаимодействия с диазометаном:
![]()
Применение: Циклогексанон используют для производства капрлактама - исходного вещества для получения синтетического волокна капрон:
![]()
При энергичном окислении циклогексанона образуется адипиновая кислота, которую используют для получения синтетического волокна нейлона.
Вывод: Циклогексанон - это циклический кетон. Весьма реакционноспосоден. Применим для производства волокон.
Читайте также: