Фелинг 1 как сделать
Добавил пользователь Евгений Кузнецов Обновлено: 04.10.2024
В этом разделе мы опишем некоторые простые опыты, с помощью которых можно определять различные вещества, играющие в клетках важную биологическую роль. Существуют и более сложные методы идентификации и разделения клеточных компонентов. Первое место среди них занимают хроматография и электрофорез; их мы рассмотрим в приложении (т. 3).
Желательно сначала освоить методику анализов, работая с чистыми образцами веществ, подлежащих определению. Овладев методикой и научившись различать соответствующие изменения окраски, можно затем приступить к исследованию различных тканей.
Опыт 3.1. Определение биомолекул в чистом виде
ВНИМАНИЕ! При всех описанных здесь анализах нагревание следует проводить на водяной бане при температуре кипения воды. Прямое нагревание пробирок на огне недопустимо.
Материалы и оборудование
Штатив для пробирок
Раствор иода в йодистом калии
Разбавленная серная кислота
Гидрокабронат натрия (питьевая сода)
5%-ный раствор гидроксида калия
1%-ный раствор сульфата меди
Раствор дихлорфенолиндофенола (ДХФИФ)
1%-ный раствор крахмала (желательно из кукурузной муки)
РЕДУЦИРУЮЩИЕ САХАРА. К редуцирующим сахарам относятся все моносахариды, например глюкоза и фруктоза, и некоторые дисахариды, например мальтоза. Среди наиболее распространенных сахаров единственный нередуцирующий сахар — это сахароза (дисахарид). Используйте для анализа 0,1—1%-ные растворы сахарозы.
Влить в пробирку 2 мл раствора редуцирующего сахара. Добавить равное количество раствора Бенедикта. Встряхнуть и осторожно довести до кипения, продолжая непрерывно встряхивать, чтобы жидкость не выбросило из пробирки
Синяя окраска раствора сменяется зеленой, а затем желтоватой; в конце выпадает кирпично-красный осадок
Раствор Бенедикта содержит сульфат меди. Редуцирующие сахара восстанавливают растворимый синий сульфат меди, содержащий ионы меди(II) [Сu 2+ ], до нерастворимого кирпично-красного осадка оксида меди(I). Оксид меди выпадает в осадок
ПРИМЕЧАНИЕ. Реакция полуколичественная, иначе говоря, она позволяет лишь грубо оценить количество редуцирующего сахара, присутствующего во взятой пробе. Окраска осадка переходит от зеленой к желтой, оранжевой и кирпично-красной с увеличением количества редуцирующего сахара. (Зеленый цвет — это результат смешения появившегося желтого осадка с синим раствором сульфата меди.)
Влить в пробирку 2 мл раствора редуцирующего сахара. Добавить 1 мл реактива Фелинга А и 1 мл реактива Фелинга В. Встряхивая, довести до кипения
Начальная синяя окраска смеси переходит в зеленую, затем в желтую, после чего выпадает кирпично-красный осадок
То же, что и для реакции Бенедикта
ПРИМЕЧАНИЕ. Реакция Фелинга не столь удобна, как реакция Бенедикта, потому что реактивы А и В приходится до анализа хранить отдельно. Чувствительность ее также ниже.
НЕРЕДУЦИРУЮЩИЕ САХАРА. Наиболее распространенный из нередуцирующих сахаров — это сахароза, относящаяся к дисахаридам. Если известно, что редуцирующие сахара в исследуемом растворе отсутствуют (т. е. если предыдущая реакция дала для этого раствора отрицательный результат), то появление кирпично-красного осадка в реакции, описанной ниже, свидетельствует о присутствии какого-то нередуцирующего сахара. Если же было доказано, что в исследуемом растворе содержатся редуцирующие сахара, то в описанной ниже реакции будет получен более обильный осадок, нежели в предыдущей реакции, при наличии в растворе также и какого-либо нередуцирующего сахара.
Влить в пробирку 2 мл раствора сахарозы. Добавить 1 мл разбавленной соляной кислоты. Кипятить в течение 1 мин. Осторожно нейтрализовать гидрокарбонатом натрия, проверяя лакмусовой бумажкой (осторожность требуется потому, что жидкость вскипает). Провести реакцию Бенедикта
Как в реакции Бенедикта
При кипячении с разбавленной соляной кислотой дисахарид гидролизуется до моносахаридных единиц. Сахароза расщепляется на глюкозу и фруктозу. Обе они представляют собой редуцирующие сахара и в реакции Бенедикта дают соответствующие результаты
КРАХМАЛ. Растворим в воде очень слабо, образует в ней коллоидные суспензии. Анализ можно проводить как с суспензией, так и с сухим крахмалом.
Влить в пробирку 2 мл 1 %-ного раствора крахмала. Добавить несколько капель раствора I2/KI
Второй вариант: нанести раствор на сухой крахмал
Под действием раствора I2/KI крахмал окрашивается в темно-синий цвет
Образуется полииодидный комплекс с крахмалом
ЦЕЛЛЮЛОЗА И ЛИГНИН. См. приложение 2 (окрашивание) в т. 3.
ЛИПИДЫ. К липидам относятся масла (например, кукурузное и оливковое), жиры и воска.
Проба с Суданом III
Судан III — красный краситель. Добавить 2 мл масла к 2 мл воды, налитой в пробирку. Добавить несколько капель Судана III и встряхнуть
Окрасившийся в красный цвет слой масла располагается поверх воды. Вода остается неокрашенной
Жировые глобулы окрашиваются в красный цвет и всплывают, потому что их плотность ниже плотности воды
Добавить 2 мл жира или масла в пробирку, содержащую 2 мл абсолютного спирта. Сильно встряхнуть для растворения липида. Добавить равное количество холодной воды
Образуется мутная белая суспензия
Липиды с водой не смешиваются. При добавлении воды к спиртовому раствору липида образуется эмульсия; мельчайшие липидные капельки, взвешенные в воде, отражают свет, вследствие чего эмульсия кажется белой и опалесцирует
Проба с жировым пятном
Нанести каплю исследуемого образца на бумагу. Выждать некоторое время, чтобы дать испариться воде, которая могла туда попасть. Можно слегка прогреть бумагу — это ускорит процесс
На бумаге останется прозрачное пятно
Для этих анализов очень подходит альбумин куриного яйца
Влить 2 мл раствора или суспензии белка в пробирку. Добавить 1 мл реактива Миллона и вскипятить.
ВНИМАНИЕ! Реактив Миллона ядовит — будьте осторожны!
Выпадает белый осадок, который при кипячении коагулирует и окрашивается в красный или оранжево-розовый цвет
Реактив Миллона — это раствор ртути(II) в азотной кислоте, содержащей примесь азотистой кислоты. Аминокислота тирозин содержит фенильную группу, реакция которой с реактивом Миллона приводит к образованию красного комплекса ртути(II). Это неспецифическая реакция, характерная для всех фенолов. Белок при нагревании обычно коагулирует, т. е. дает плотный осадок. Из всех белков, используемых для такого анализа, не содержит тирозина один только желатин
Влить в пробирку 2 мл раствора белка. Добавить равный объем 5%-ного гидроксида калия и перемешать. Добавить 2 капли 1%-ного раствора сульфата меди и перемешать. Нагревания не требуется
Медленно появляется розовато-фиолетовая или пурпурная окраска
Это реакция на соединения, содержащие пептидные связи. В присутствии разбавленного раствора сульфата меди в щелочной среде атомы азота пептидной цепи образуют окрашенный в пурпурный цвет комплекс с ионами меди(II) [Сu 2+ ]. Биурет (производное мочевины) тоже содержит группу —CONH— и поэтому дает такую реакцию
Витамин С (аскорбиновая кислота)
Данный метод можно при необходимости использовать для количественного определения. В этом случае указанные объемы следует отмерять очень точно. Подходящим источником витамина С может служить свежий апельсиновый или лимонный сок в смеси с дистиллированной водой (1:1). Можно использовать также имеющиеся в продаже таблетки витамина С.
Стандартом служит 0,1%-ный раствор аскорбиновой кислоты. Влить 1 мл ДХФИФ в пробирку. Набрать в шприц на 1 мл 0,1 %-ный раствор аскорбиновой кислоты. Добавить аскорбиновую кислоту к ДХФИФ по каплям, слегка помешивая иглой шприца. (Не встряхивать 1 .) Продолжить это до тех пор, пока синий раствор ДХФИФ не обесцветится. Отметить израсходованный объем аскорбиновой кислоты
Исчезновение синей окраски — раствор обесцвечивается
ДХФИФ — синий краситель — восстанавливается аскорбиновой кислотой (сильным восстановителем) до бесцветного соединения
1 Встряхивание раствора может привести к окислению аскорбиновой кислоты кислородом воздуха. Можно проверить самому, как отразится на результатах опыта встряхивание и кипячение.
3.15. Как можно определить концентрацию аскорбиновой кислоты в полученной пробе?
3.16. Вам даны три раствора сахара: в одном содержится глюкоза, в другом - смесь глюкозы и сахарозы, в третьем - сахароза.
а) Как вы определите, какой сахар содержится в каждом из этих растворов?
б) Кратко опишите дальнейшие процедуры, с помощью которых можно подтвердить правильность вашего ответа (допустим, что в вашем распоряжении имеется нужный прибор и что время позволяет провести такие определения).
3.17. Как можно приготовить 100 мл 10%-ного раствора глюкозы?
3.18. В вашем распоряжении имеются в качестве исходных растворов 10%-ный раствор глюкозы и 2%-ный раствор сахарозы. Как можно приготовить из них 100 мл смеси с конечной концентрацией 1% сахарозы и 1% глюкозы?
Опыт 3.2. Определение биомолекул в тканях
Биохимику часто приходится выявлять присутствие тех или иных биомолекул или определять их количество в живых тканях, т. е. вести качественный или количественный анализ. Иногда эти определения можно выполнять непосредственно на самой ткани, но нередко им должен предшествовать тот или иной процесс экстракции или очистки.
Полезно потренироваться на каких-либо обычных пищевых продуктах или на растительном материале, определяя в них те биомолекулы, о которых шла речь в опыте 3.1. Там, где это возможно, мы предлагаем процедуру экстрагирования, которая позволит использовать для анализа чистый бесцветный раствор. Усвоив смысл таких процедур, студент сможет при необходимости сам предложить аналогичные методики.
Материалы и оборудование
Все, что перечислено в опыте 3.1 (от начала и до раствора ДХФИФ)
Ступка с пестиком
Предметные и покровные стекла
Флороглюцин + концентрированная соляная кислота
Микроскопическое исследование тонких срезов ткани
Метод пригоден для знакомства с теми отложениями запасных веществ, которые можно видеть под микроскопом, например с крахмальными зернами в клубне картофеля.
Микроскопическое исследование срезов с соответствующим окрашиванием или какой-либо иной химической обработкой
Метод пригоден для выявления перечисленных ниже веществ.
Редуцирующие сахара. Поместить срез в несколько капель реактива Бенедикта и осторожно нагреть до кипения; при необходимости добавить воды, чтобы предотвратить высыхание.
Крахмал. Поместить в разбавленный раствор I2/КI.
Белок. Поместить срез в несколько капель реактива Миллона и осторожно нагреть до кипения; при необходимости добавить воды, чтобы предотвратить высыхание.
Масла и жиры. Окрасить исследуемый материал, например семена, Суданом III, после чего промыть водой и(или) 70%-ным спиртом. Приготовить срезы и заключить в соответствующую среду.
Целлюлоза, лигнин и т. п. См. табл. 5.5.
Исследование прозрачных водных растворов
Обесцветить ткань, если в этом есть необходимость. Присутствующие в ткани пигменты могут мешать цветным реакциям, но обычно эти пигменты легко удалить из ткани органическими растворителями, например 80%-ным этанолом или 80%-ным пропаноном (ацетоном) (беречь от соприкосновения с открытым огнем). Следует, однако, помнить, что эти растворители могут удалять из ткани липиды и растворимые сахара. Методика пригодна для извлечения хлорофилла из листьев.
Гомогенизация материала. Сахара и белки. Кусочки предназначенного для исследования материала растереть в кашицу с небольшим количеством воды при помощи ступки или миксера. Растертый материал процедить через несколько слоев тонкой кисеи или нейлона, предварительно смоченных водой, и либо отфильтровать, либо отцентрифугировать для удаления твердых частиц. Это может и не потребоваться, если суспензия окажется высокодисперсной и практически бесцветной. Прозрачный раствор анализируют как обычно, а если нужно, приготовляют из него соответствующие разведения. Твердый осадок, если он представляет интерес, также может быть подвергнут анализу.
Липиды. Растереть материал, перенести в пробирку и вскипятить. Липиды отделяются в виде капелек масла. Провести окрашивание Суданом III. Можно вместо этого приготовить эмульсию из тонко наструганного ядра ореха или других пищевых продуктов (которые могут быть и окрашенными) и провести эмульсионную пробу.
Описанная методика пригодна для выявления в различных материалах указанных ниже веществ.
Раствор Фелинга П [ В фарфоровый стакан насыпают 200 г тарт-рата калий-натрия KUUC ( cHOH) 2COONa - 4H2O и 150 г гидроксида натрия, наливают 500 - 600 мл дистиллированной воды и перемешивают стеклянной палочкой до полного растворения. [1]
Раствор Фелинга приготовляют, смешивая растворы I и II. Раствор I получают растворением 34 6 г пятиводного сульфата меди в 500 мл воды, содержащей несколько капель серной кислоты. Для приготовления раствора II 60 г гидрата окиси натрия и 173 г тетрагидрата виннокислого калия-натрия ( CiHUOeKNa - 4Н2О) растворяют в воде и разбавляют до 500 мл. [2]
Раствор фелинга готовится смешиванием равных частей растворов: 1) 6 928 г сернокислой меди в 100 мл воды и 2) 34 6 г сегне-товой соли и if) г едкого натра в 100 мл воды. Для сильно редуцирующих веществ раствор сернокислой меди берется в двойном количестве. Кроме того, для определения нужны бензол и чистейший пиридин. [3]
Раствор Фелинга кониферином не восстанавливается ни при нагревании, ни на холоду; но если раствор кониферина после прибавления 1 капли соляной кислоты нагреть, то полученная таким образом жидкость восстанавливает при кипячении раствор Фелинга. Водный раствор кониферина ( 0 5: 100) не осаждается ни раствором нейтрального, ни раствором основного уксуснокислого свинца. Если 1 г кониферина высушить при 100 до постоянного веса, то потеря в весе не должна превышать 0 0952 г. При сжигании 1 г кониферина не должно быть больше, чем 0 002 г остатка. [4]
Раствор Фелинга при кипячении с салицином также не восстанавливается. При сжигании 1 г салицина не должно оставаться больше 0 003 г остатка. [5]
Восстанавливает раствор Фелинга только после продолжительного стояния. Гпдролпзуется на составные части кислотами. [6]
С раствором Фелинга : зеленое, затем коричневое окрашивание и, наконец, осадок закиси меди. [7]
Мальтоза восстанавливает раствор Фелинга , для нее характерно явление мутаротации. [8]
Хлороформ восстанавливает раствор Фелинга , а четыреххлористый углерод не восстанавливает. [9]
Мальтоза восстанавливает раствор Фелинга . Разбавленные минеральные кислоты и а-глюкозидаза расщепляют мальтозу на две молекулы глюкозы. Мальтоза легко сбраживается дрожжами. [10]
Хлороформ восстанавливает раствор Фелинга , четыреххлористый углерод не восстанавливает. [11]
Фруктоза восстанавливает раствор Фелинга , способна к энзиматическому брожению подобно глюкозе. С фенилгидразоном дает озазон, идентичный озазонам глюкозы и маннозы. При кипячении с соляной кислотой превращается в оксиметилфурфурол и смесь гуминовых веществ. [12]
Мочевая кислота восстанавливает раствор Фелинга и раствор нитрата серебра ( в отличие от гуанина, кофеина, теофиллпна, теобромина, гидроксиэтил-теофиллнпа и гидроксипропплтеобромина и, кроме того, щелочной раствор пер-мангапата калия. Последнюю реакцию дают также гуанин, теофиллиц и гидро-кситеофиллин. [13]
Мочевая кислота восстанавливает раствор Фелинга , щелочной раствор перманганата калия и раствор нитрата серебра. Если на фильтровальную бумажку, смоченную раствором нитрата серебра, прилить каплю раствора мочевой кислоты, содержащего карбонат натрия, то появляется черное пятно вследствие образования металлического серебра. [14]
Это соединение восстанавливает растворы Фелинга и Толленса и реагирует как с гидроксиламином, так и с гидразином, давая пиперазин. [15]
фелингова жидкость, смесь равных объёмов 7%-ного раствора сульфата меди и 34,6%-ного раствора сегнетовой соли в 10%-ном растворе едкого натра. Применяется для качественного и количественного определения альдегидов жирного ряда и в особенности моносахаридов. Действие Ф. р. основано на восстановлении иона двухвалентной меди до одновалентной за счёт окисления альдегидных групп исследуемых соединений. При этом на холоде выпадает оранжево-жёлтый осадок гидрата закиси меди СuОН, а при нагревании – красный осадок закиси меди СuO. Предложен в 1850 нем. химиком Г. Фелингом.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Смотреть что такое "Фелинга реактив" в других словарях:
ФЕЛИНГА РЕАКТИВ — (фелингова жидкость), р р CuSO4 и тартрата калия натрия в 10% ном р ре NaOH; реактив на восстановители, гл. обр. альдегиды и моносахариды. Готовят непосредственно перед употреблением. Р цию проводят, добавляя к 10 мл Ф. р. ок. 0,5 мл или 0,25 0,5 … Химическая энциклопедия
Фелинг Герман — Фелинг (Fehiing) Герман (9.6.1812, Любек, √ 1.7.1885, Штутгарт), немецкий химик органик и технолог. В 1837 окончил Гейдельбергский университет и работал в лаборатории Ю. Либиха в Гисене. С 1839 профессор высшей технической школы в Штутгарте. Ф.… … Большая советская энциклопедия
Фелинг — (Fehiing) Герман (9.6.1812, Любек, – 1.7.1885, Штутгарт), немецкий химик органик и технолог. В 1837 окончил Гейдельбергский университет и работал в лаборатории Ю. Либиха в Гисене. С 1839 профессор высшей технической школы в Штутгарте. Ф.… … Большая советская энциклопедия
Фелингова жидкость — реактив, служащий для количественного определения виноградного сахара (декстрозы), мальтозы, инвертированного сахара, левулозы (левулёзы) и т. п. веществ и вошедший в химическую практику благодаря, главным образом, работам Фелинга. Фелингова… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
МОЧА — (урина, urina), жидкость, отде ляемая почками и выделяемая из организ ма наружу через систему мочевыводящих путей. СМ. удаляются из организма почти все азотистые продукты обмена веществ (за исключением небольших количеств, поступающих в пот и в… … Большая медицинская энциклопедия
ФЕЛИНГ (Fehling) Герман Христиан — (1812 85) немецкий химик органик и технолог. Основное направление исследований анализ и идентификация органических соединений. Впервые синтезировал ряд органических соединений, в т. ч. бензойную кислоту (1844). Предложил (1850) реактив для… … Большой Энциклопедический словарь
ФЕЛИНГ Герман Христиан — ФЕЛИНГ (Fehling) Герман Христиан (1812 85), немецкий химик органик и технолог. Основное направление исследований анализ и идентификация органических соединений. Впервые синтезировал ряд органических соединений, в т. ч. бензойную кислоту (см.… … Энциклопедический словарь
МЕДЬ — Cu (cuprum), химический элемент IB подгруппы (семейства монетных металлов Cu, Ag, Au) периодической системы элементов. Известна и широко используется с древних времен (медный век, бронзовый век). Медь наряду с серебром и золотом используется для… … Энциклопедия Кольера
KETOАЛЬДЕГИДЫ — дикарбонильные соед., содержащие в молекуле альдегидную и кетонную группы. В зависимости от числа атомов С между оксогруппами различают 1,2 К. (a К.), 1,3 К. (b К.), 1,4 К. (g K.), 1,5 К. (d К.), 1,6 К. (e К.) и т. д. По номенклатуре ИЮПАК, назв … Химическая энциклопедия
ОКСИБЕНЗАЛЬДЕГИДЫ — (гидроксибензальдегиды), соед. общей ф лы ОНСС 6 Н 4 n (ОН)n. Наиб практич. значение имеют моногидроксипроизводные ф лы I 2 О. ( салициловый альдегид),3 и 4 О. (мол. м. 122,13). 3 и 4 О. бесцв. кристаллы (см. табл.), раств. в этаноле, диэтиловом… … Химическая энциклопедия
Опыт № 69. Восстановление гидроксида меди (II) глюкозой в присутствии щелочи (реакция Троммера)
Раствор гидроксида натрия
Гидроксид меди (II)
Полученный в предыдущем опыте щелочной раствор сахарата меди нагревают над пламенем спиртовки. Появление желтого окрашивания (переходящего в красное при большем содержании щелочи или при более длительном нагревании) указывает на восстановление меди.
глюкоза глюконовая кислота
Опыт № 70. Взаимодействие глюкозы с реактивом Фелинга
Раствор Фелинга (I)
Раствор Фелинга (II)
В пробирку наливают 1 мл 1%-ого раствора глюкозы, ~ 0.5 мл раствора Фелинга I, ~ 0.5 мл раствора Фелинга II, слегка встряхивают и осторожно нагревают до кипения содержимое пробирки на небольшом пламени спиртовки. По мере нагревания интенсивно-синий цвет реактива Фелинга изменяется. Первоначально появляется желтый осадок гидрата закиси меди, который постепенно переходит в закись меди и выпадает на дно пробирки в виде ярко-красного осадка. Находившаяся в растворе глюкоза полностью окисляется до глюконовой кислоты за счет кислорода гидрата окиси меди. Схема реакции:
Эта реакция применяется для количественного определения сахаров в пищевых продуктах.
Опыт № 71. Восстановление аммиачного раствора гидроксида серебра (реакция серебряного зеркала)
Аммиачный раствор гидроксида серебра (реактив Толленса)
Раствор 1%-ный глюкозы
В пробирку, тщательно вымытую горячей щелочью и ополоснутую водой наливают ~1 мл раствора глюкозы (1%-ного) и приливают к нему ~1 мл свежеприготовленного аммиачного раствора гидроксида серебра [Ag(NH3)2]OH. Слегка встряхивают и осторожно нагревают содержимое пробирки на небольшом пламени спиртовки. По мере нагревания на стенках пробирки выделяется металлическое серебро, образуется серебряное зеркало (или, если растворы концентрированы, черный осадок коллоидного серебра).
Глюкоза при этом окисляется до глюконовой кислоты, а оксид серебра восстанавливается до металла:
Перманганатные методы основаны на способности карбонильных групп сахаров окисляться в жидкости Фелинга и восстанавливать окись меди до закиси. По количеству образовавшейся закиси меди определяют количество редуцирующих сахаров, используя при этом специальные таблицы, составленные для определенных условий опыта.
Фелингова жидкость образуется при взаимодействии щелочного раствора сегнетовой соли, т.е. калий-натриевой соли винной кислоты (Фелинг II), с раствором сернокислой меди (Фелинг I). При сливании этих растворов происходит реакция в две фазы: вначале образуется голубой осадок свежеосажденного гидрата окиси меди CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4; затем выделившийся гидрат реагирует с сегнетовой солью, жидкость приобретает темно-синий цвет от образовавшейся комплексной соли меди, хорошо растворимой в воде:
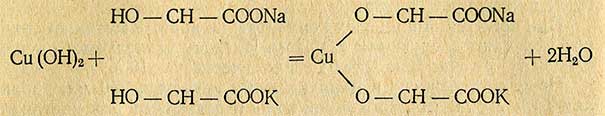
Комплексная соль - соединение нестойкое, поэтому в присутствии сахаров, содержащих альдегидную или кетонную группу, происходит освобождение (выделение) окиси меди и образование нерастворимого красного осадка закиси меди (Сu2O).
Сахароза не обладает свойствами восстанавливать щелочной раствор меди, что является основанием для раздельного определения сахаров в смеси. Для определения сахарозы исследуемые водные растворы предварительно обрабатывают соляной кислотой - проводят инверсию, в результате чего образуются равные количества глюкозы и фруктозы (инвертный сахар), восстанавливающие щелочные растворы меди.
Существует несколько модификаций перманганатного метода. Классическим методом считается метод Бертрана, в практике технохимического контроля широко применяют его модификацию - метод Макс-Мюллера.
Сахара в пищевых концентратах, не содержащих молоко, и в продукции овощесушильного производства определяют методом Бертрана. Для пищевых концентратов, содержащих молоко, применяют метод Бертрана в модификации. Методы отличаются по различной концентрации растворов Фелинга и по времени кипячения испытуемых растворов с жидкостью Фелинга.
Определение сахаров методом Бертрана
Определение редуцирующих сахаров. В коническую колбу последовательно вносят по 20 мл растворов Фелинга I и II, растворы смешивают, затем приливают 20 мл фильтрата, полученного из исследуемого вещества, как описано в предыдущем разделе. Содержимое колбы перемешивают и нагревают до кипения, кипятят в течение 3 мин, считая от появления первых пузырьков. После этого колбу снимают с огня, ставят в наклонном положении для лучшего оседания выпавшей закиси меди и горячую жидкость сливают с осадка закиси меди на стеклянный фильтр №4 или асбестовый фильтр, специально приготовленный в стеклянной трубке.
Раствор фильтруют в колбу Бунзена при небольшом разрежении, избегая по возможности попадания осадка на фильтр. После сливания всей жидкости на фильтр колбу и фильтр промывают несколько раз горячей дистиллированной водой до исчезновения щелочной реакции промывных вод.
Во избежание перехода закиси меди в окись при соприкосновении с воздухом осадок во время фильтрования должен находиться под водой. По окончании промывания осадка водой фильтрат из колбы Бунзена выливают, а колбу тщательно промывают вначале водопроводной водой, затем споласкивают дистиллированной водой. В коническую колбу к осадку закиси меди приливают небольшими порциями 20-30 мл раствора железоаммонийных квасцов или сернокислого железа, каждый раз сливая раствор на фильтр.
В присутствии сернокислого железа или железоаммонийных квасцов осадок закиси меди восстанавливает эквивалентное количество сернокислой окиси железа в сернокислую закись железа, количество которой определяется титрованием раствором марганцовокислого калия
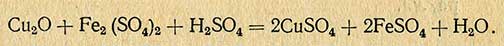
После растворения закиси меди колбу и фильтр промывают несколько раз дистиллированной водой, соединяя все промывные воды в колбе Бунзена. Затем содержимое колбы титруют перманганатом до неисчезающего слабо-розового окрашивания. Количество миллилитров перманганата, пошедшее на титрование, умножают на титр, выраженный по меди, и определяют число миллиграммов меди. Затем в табл. 2 (приложение) по полученному количеству меди находят соответствующее количество сахара и рассчитывают процентное содержание сахара (х) в исследуемом продукте по формуле
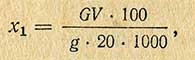
где G - количество сахара, найденное по таблице, мг; V - объем мерной колбы, мл; g - навеска исследуемого вещества, г; 20 - количество испытуемого раствора, мл.
Содержимое колбы нейтрализуют 20%-ным раствором едкого натра по метилоранжу, затем доводят дистиллированной водой до метки и перемешивают. В полученном растворе определяют содержание сахара по методике, описанной для определения редуцирующих сахаров.
Миллиграммы меди переводят в миллиграммы сахара по табл. 3 (приложение), а затем общее содержание сахара в процентах (х) рассчитывают по формуле
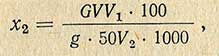
где G - количество сахара, найденное по табл. 3 (приложение), мг; V - объем мерной колбы, в которую помещена навеска, мл; V1 - объем мерной колбы, в которой проводилась инверсия, мл; g - навеска исследуемого продукта, г; 50 - количество раствора, взятого для инверсии, мл; V2 - количество раствора, взятого для определения сахара, мл.
На основании данных, по содержанию общего сахара в продукте (сахара после инверсии) и редуцирующих сахаров (сахара до инверсии) определяют содержание сахарозы по формуле
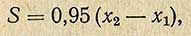
где S - содержание сахарозы, %; x1 - количество сахара до инверсии, %; x2 - количество сахара после инверсии, %; 0,95 - коэффициент пересчета инвертного сахара на сахарозу.
Конечный результат выражают как среднее арифметическое двух определений. Расхождения между двумя параллельными определениями не должны превышать ±0,3%.
Определение сахаров по методу Макс-Мюллера
При определении сахара в исследуемых растворах по методу Макс-Мюллера в коническую колбу берут по 25 мл растворов Фелинга I и II и смесь быстро нагревают до кипения, после чего в колбу быстро вносят 50 мл подготовленного для определения фильтрата и кипятят в течение 2 мин. Выпавшему осадку закиси меди дают отстояться и проводят все последующие операции, как в методе Бертрана.
Для перевода полученных миллиграммов меди в миллиграммы сахара пользуются табл. 4 (приложение). Содержание сахара в продукте (в %) рассчитывают по той же формуле, какую применяют в методе Бертрана.
Приготовление растворов для определения сахаров
По методу Бертрана готовят водные растворы Фелинга следующей концентрации:
Фелинг I - 40 г CuSO4-5Н2O в 1 л;
Фелинг II - 200 г сегнетовой соли (калий-натрий винно-кислый) и 150 г КОН в 1 л.
По методу Макс-Мюллера эти растворы готовят несколько другой концентрации:
Фелинг I - 69,28 г CuSO4-5Н2O в 1 л;
Фелинг II - 346 г сегнетовой соли и 100 г NaOH в 1 л.
Квасцы железоаммонийные (реактив х.ч). К 250 мл раствора железоаммонийных квасцов, насыщенного на холоду, прибавляют 25 мл концентрированной серной кислоты. После перемешивания раствор охлаждают, переносят в мерную колбу емкостью 1000 мл, охлаждают до 20° С, содержимое колбы доводят дистиллированной водой до метки. В растворе квасцов не должно содержаться закисного железа, наличие которого проверяют следующим образом. К 20 мл раствора квасцов добавляют 1-2 капли раствора перманганата и наблюдают за изменением цвета раствора. Если в растворе нет закисного железа, то он окрашивается в розовый цвет.
Вместо раствора железоаммонийных квасцов применяют также раствор сернокислого окисного железа, приготовленного из 50 г Fe2(SO4)3-9H2O и 200 г H2SO4 (относительной плотностью 1,84) в 1 л.
Марганцовокислый калий (перманганат) - приготовление см. главу 6.
Определение сахара в пищевых концентратах, содержащих молоко перманганатным методом
Содержание сахара в пищевых концентратах, содержащих молоко, определяют перманганатным или рефрактометрическим методами. Приготовление водных вытяжек из исследуемых продуктов приведено в специальном разделе.
Определение сахара до инверсии. 25 мл подготовленной водной вытяжки переносят в колбу емкостью 250 мл, приливают последовательно по 25 мл растворов Фелинга I и II. После перемешивания колбу с содержимым нагревают до кипения и кипятят в течение 6 мин. Выпавшему осадку закиси меди дают осесть и в дальнейшем проводят операции, как описано при определении сахара по Бертрану. Результат определения выражают в миллилитрах перманганата, пошедшего на титрование фильтрата после растворения закиси меди.
Определение сахара после инверсии. В коническую колбу емкостью 250 мл переносят 10 мл раствора, подготовленного для определения, и прибавляют 10 мл дистиллированной воды. Колбу закрывают пробкой с пропущенным через нее термометром, ртутный шарик которого должен быть погружен в жидкость.
После нейтрализации в колбу приливают последовательно по 25 мл растворов Фелинга I и II и продолжают анализ, как указано при определении сахара в молочных продуктах до инверсии. Количество миллилитров раствора перманганата, пошедшего на титрование 10 мл инвертированного фильтрата, выражают в миллиграммах меди.
Расчет ведут по следующей формуле:
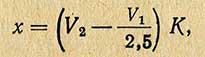
где х - количество меди, мг; V1 - количество раствора перманганата, пошедшее на титрование 10 мл фильтрата до инверсии, мл; V2 - количество раствора перманганата, пошедшее на титрование 10 мл фильтрата после инверсии, мл; К - титр раствора перманганата, выраженный в миллиграммах меди.
По количеству миллиграммов меди находят по табл. 5 (приложение) соответствующее количество миллиграммов сахарозы. Содержание сахарозы в процентах (S) в исследуемом продукте определяют по следующей формуле:
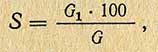
где G1 - количество сахарозы в 10 мл исследуемого раствора, г; G - количество исследуемого продукта, соответствующее 10 мл исследуемого раствора, г.
Расхождения между параллельными опытами допускаются в пределах ±0,5%.
Приготовление растворов
1. Раствор Фелинга I - 69,26 свежеперекристаллизованной сернокислой меди растворяют в 1 л дистиллированной воды.
2. Раствор Фелинга II - 365 г сегнетовой соли и 103 г едкого натра в 1 л дистиллированной воды.
3. Раствор железоаммонийных квасцов - приготовление см. в описании метода Бертрана.
Читайте также:

