Как сделать со2 сжиженный
Обновлено: 05.07.2024
Извлечение CO2 из воздуха является одним из лучших способов обратить вспять изменение климата, не прибегая к дорогостоящим технологиям, запутанным налоговым схемам или не позволяя миллиардам людей получать энергию, необходимую им для хорошей жизни.
Поскольку мы не в состоянии обуздать глобальные выбросы углерода вообще, нам остается использовать наши мозги, которые привели нас к этой проблеме.
Радикальное мышление
Будь то солнечная инженерия или засев облаков для уменьшения солнечной радиации, или лесовосстановление, или улавливание и связывание углерода от сжигания ископаемого топлива, или удобрение океана железом или установка огромных зеркал в космосе, люди думают, что сможем решить любой вопрос .
И по большей части, мы можем. Нам просто нужно сделать мудрый выбор, чтобы не ухудшить ситуацию.
Лучшая и самая прямая стратегия, которая имеет наименьшие негативные побочные эффекты, состоит в том, чтобы удалять углерод непосредственно из атмосферы и извлекать из него что-то полезное — например, топливо — что еще больше уменьшит нагрузку на окружающую среду.
Основанная в Канаде, система прямого улавливания воздуха Carbon Engineering непосредственно удаляет CO2 из атмосферы, очищает ее и производит готовую к трубопроводу сжатую жидкость CO2, используя только энергию и воду. Этот CO2 может быть объединен с водородом, не генерируемым ископаемым топливом, для производства углеводородных топлив со сверхнизкой углеродной интенсивностью, таких как бензин, дизельное топливо и реактивное топливо-A.
Трубопровод CO2 может также использоваться в промышленных целях, включая производство стали и бетона, покрытий и углеродных волокон, или для повышения нефтеотдачи.
Компания Carbon Engineering успешно разработала и продемонстрировала свои технологии на своей экспериментальной установке в Сквамише, Британская Колумбия, которая с 2015 года удаляет CO2 из атмосферы и преобразует его в топливо с 2017 года.

Пилотная установка прямого захвата воздуха Carbon Engineering в Сквомиш, Британская Колумбия
Эта технология поддерживается Биллом Гейтсом, Canadian Natural Resources Limited, Occidental Petroleum и Chevron.
Удаление CO2 по цене $ 100 / тонна
В настоящее время система прямого захвата воздуха Carbon Engineering может удалить тонну CO2 из воздуха примерно за $100. Отдельные системы должны будут улавливать около миллиона тонн CO2 в год, что потребует от нескольких десятков тысяч систем не отставать от глобальных выбросов и сократить атмосферный CO2 до нормального уровня к 2040 году.
Только в Соединенных Штатах есть чуть менее 70 000 заправочных станций, так что это не очень много, чтобы спасти планету.
На следующем этапе технология Carbon Engineering Air to Fuel производит синтетические, жидкие транспортные топлива, такие как бензин, дизельное топливо и реактивный двигатель-A. Процесс объединяет CO2, захваченный из атмосферы через их систему прямого захвата воздуха, с водородом для производства углеводородного топлива.
Добавление водорода для получения углеродного топлива
Если водород производится из воды с использованием ядерной или возобновляемой энергии, то топливо является углеродно-нейтральным. И эти виды топлива вполне совместимы с современной транспортной инфраструктурой, двигателями и самолетами.
Эти виды топлива в настоящее время могут быть произведены углеродной инженерией менее чем за $4/галлон, что делает их немного дороже, чем ископаемые виды топлива, но похожи на биотопливо. Низкоуглеродистые мандаты и стандарты топлива делают их очень конкурентоспособными с любым топливом.
И расходы будут продолжать снижаться.
Небольшие единицы, расположенные в любом месте
Но в отличие от биотоплива, топливо CE не занимает много места на суше или воде и не зависит от погоды или географического положения. Топливо также имеет высокий уровень цетанового числа, может смешиваться с ископаемым топливом в любой степени и не содержит других загрязняющих веществ, которые есть у ископаемого топлива, таких как сера, азот и твердые частицы.
Получение топлива из извлеченного CO2 — это не просто боковая черта этого подхода. Это также может устранить некоторые из необходимости транспортировки топлива по стране и миру для поддержки стратегических миссий, подобных задачам наших военных.
Жидкое топливо и вода составляют большую часть массы, транспортируемой в развернутые вооруженные силы. Пополнение запасов топлива и питьевой воды для войск в театре военных действий стоит жизней, около 4 жизней на каждые 100 конвоев. Чтобы резко сократить их, наши военные хотят развернуть небольшие ядерные реакторы, пополнение которых происходит один раз в несколько лет или больше.
Эти SMR могут также запускать системы извлечения CO2 из углеродной инженерии в топливные системы в местах, где возобновляемые источники энергии невозможны, например, в отдаленных районах и для большинства военных миссий.
Ядерный флот Соединенных Штатов хочет сделать именно это. И они могут использовать избыточную энергию от ядерных реакторов, которые уже существуют на их кораблях. Они могут даже отделить водород от воды, используя медно-хлорный процесс, термохимический процесс, для которого на одной стадии требуется тепло точно при температуре ядра ядерного реактора (530°C) на борту авианосца. В этом отношении CO2 также может быть извлечен из морской воды.
Увеличение содержания СО2 в атмосфере в результате использования углеводородов также подкисляет океаны в условиях кризиса, не связанного с глобальным потеплением.
Так что было бы неплохо удалить некоторые из них и переделать углеводороды, которые могут быть использованы для вытеснения нефтепродуктов, таких как бензин, который помог вызвать это в первую очередь.

В любом органическом топливе, будь то бензиновые углеводороды или углеводы из шоколадки, содержатся атомы углерода, которые в конце своего энергетического пути превращаются в углекислый газ. Ну а газ, в свою очередь, отправляется в атмосферу, где он может накапливаться и вызывать всякие нехорошие эффекты вроде глобального потепления.
Однако стоит заметить, что использование угарного газа в химических целях не есть что-то совсем новое. Ещё на заре ХХ века германские химики Франц Фишер и Ганс Тропш разработали способ, как из обычного угля получить жидкое топливо: сначала из каменного угля и воды получают синтез-газ – так называется смесь угарного газа и водорода, а затем с помощью катализатора из синтез-газа получают различные углеводороды.
Такие вещи невозможны без использования катализаторов, и, чтобы получить работающий катализатор, химикам порой приходится идти на самые разные хитрости. Дело в том, что, кроме определённого химического состава, для катализатора очень важна его внутренняя структура. Если говорить упрощённо, катализатор, нанесённый на ровную поверхность, может оказаться нерабочим, а вот если его нанести на пористую поверхность, и если у пор при этом будет определённый размер, то тогда он сможет заработать в полную силу.
Для того чтобы создать такой катализатор, химики взяли электропроводящий материал в качестве подложки и нанесли на него слой из полистирольных шариков диаметром около 200 нанометров. После чего пустоты, оставшиеся в пространстве между шариками, заполнили атомами серебра. (В качестве аналогии можно представить, что мы насыпали на пол слой из бильярдных шаров, а потом всё сверху залили ровным слоем расплавленного парафина.)

Подобный материал, как оказалось, хорошо превращает углекислый газ в синтез-газ, причём эффективность и селективность катализатора управляется за счёт размера сот: если на этапе синтеза катализатора взять полистирольные шарики покрупнее, то после реакции получится один состав продуктов, а если помельче – то другой. Подробно результаты исследований опубликованы в журнале Angewandte Chemie.
И вроде бы всё хорошо, и человечество должно бы праздновать победу над выбросами парниковых газов, а каждую трубу, чадящую в атмосферу продуктами сгорания, нужно оборудовать подобным серебряным катализатором, но всё-таки стоит сделать одно замечание. Один из важных законов, по которому живёт окружающий нас мир – закон сохранения: масса и энергия не возникают ниоткуда и не пропадают в никуда. Это справедливо и для атомов химических элементов, и для тепла, вырабатываемого при сжигании топлива, и для электрической энергии.
Откуда взять энергию для превращения одного газа в другой? Например, от ветряных или солнечных энергоустановок, которые производят энергию, но не выбрасывают в атмосферу продукты сгорания топлива – в результате это позволило бы уменьшить общее количество углекислого газа.
Понравилась статья? Напишите свое мнение в комментариях.
Подпишитесь на наш ФБ:

Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое углекислый газ
Оксид углерода (IV) представляет собой тяжёлый газ. Плотность углекислоты примерно в полтора раза больше чем у атмосферного воздуха. Несмотря на то, что этот газ уже при температуре минус 78,3 градуса Цельсия превращается в снегообразную массу, получить жидкую углекислоту при нормальном давлении не представляется возможным. Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму. Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
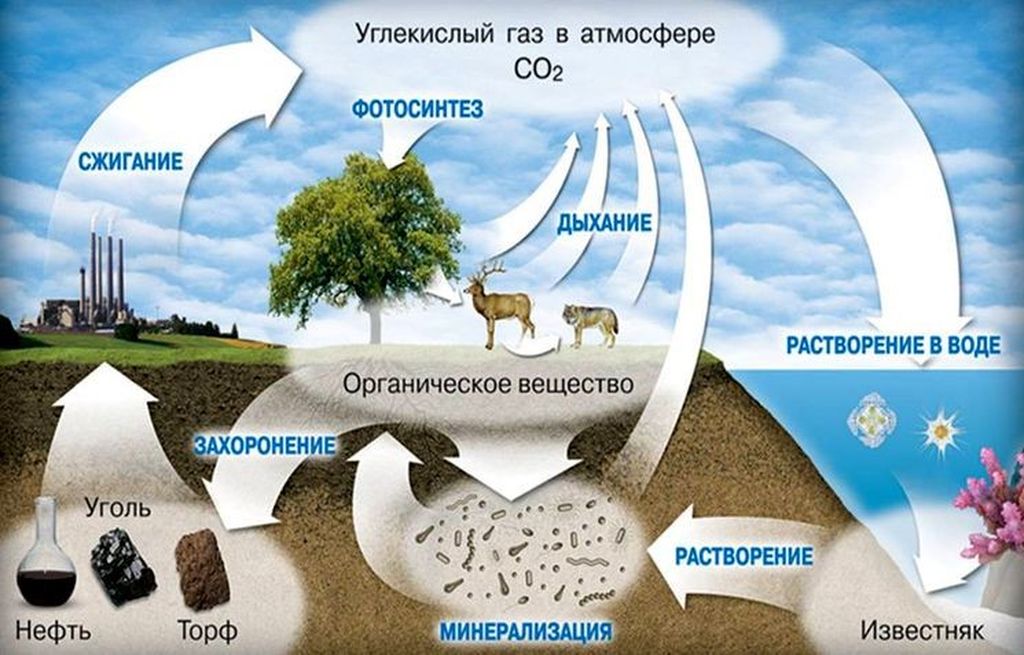
Углекислый газ не окисляется, но может поддерживать горение некоторых металлов. В среде углекислоты, при определённых условиях, могут возгораться такие активные элементы как магний, кальций и барий. Этот газ хорошо растворим в воде, а в воздухе его содержится большое количество благодаря дыханию живых организмов и растений, наличию вулканической активности на земле, а также в результате сгорания органических веществ.
В результате растворения СО2 в воде в большой концентрации образуется угольная кислота. Это вещество может вступать в реакцию с фенолом и магнийорганическими соединениями. Углекислый газ также реагирует с щелочами. В результате такой реакции образуются соли и эфиры угольной кислоты.
Свойства углекислого газа
Углекислый газ невозможно определить органами зрения или обоняния. Если концентрация СО2 невелика, то не будет ощущаться и вкуса, но при наличии большого количества этого газа в воздухе может ощущаться кисловатый привкус.
При большой концентрации углекислоты во вдыхаемом воздухе может наступить отравление. Признаками негативного воздействия СО2 на организм человека являются:
- Шум и гул в ушах.
- Обильный холодный пот.
- Потеря сознания.
Учитывая тот факт, что углекислый газ тяжелее воздуха, его концентрация в нижней части помещения будет более значительной. По этой причине, первую очередь симптомы отравления могут наблюдаться у животных и детей, а также у взрослых очень маленького роста. Большая концентрация СО2 может привести к гибели людей. При потере сознания человек может оказаться на полу, где количество кислорода будет недостаточным для поддержания нормального процесса дыхания.
Углекислый газ: получение в промышленности
Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Применение углекислого газа
Благодаря наличию определённых физических и химических свойств углекислый газ может использоваться в различных сферах. В химической промышленности углекислота используется для:
- Синтеза искусственных химических соединений.
- Для очистки животной и растительной ткани.
- Регулирования температуры реакций.
- Нейтрализации щёлочи.
В металлургии CO2 применяется с целью:
- Регулирования отвода воды в шахтах.
- Создания лазерного луча для резки металлов.
- Осаждения вредных газообразных веществ.
Кроме перечисленных областей углекислый газ активно используется при производстве бумаги. Оксид углерода применяется регулирования водородного показателя древесной массы, а также усиления мощности производственных машин.
В медицине углекислота применяется во время проведения сложных операций на внутренних органах. Наиболее ценным качеством этого газа, является использование его для реанимационных мероприятий, ведь благодаря возможности повысить его концентрацию можно эффективно стимулировать процесс дыхания пациента.
При сварке металлов углекислота применяется в качестве инертного облака, которое служит защитой расплавленного участка от попадания в него активного кислорода. В результате такой обработки сварочный шов получается идеально ровным и не подверженным окислению.
Благодаря способности охлаждаться при испарении, СО2 используется для тушения пожаров. Заправленные этим веществом огнетушители являются эффективным средством борьбы с возгораниями на объектах, где применение порошковых или пенных средств тушения невозможно.
В быту углекислота используется в качестве напорного газа в пневматическом оружии, а также для отпугивания комаров и борьбы с грызунами.
Углекислый газ: хранение и транспортировка
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом. Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
Содержание
Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа. [1]
Примечания
- ↑ А. Шиндер. Животное, не чувствующее боли. 2000-Аспекты-Проблемы № 26(420), 27 июня-3 июля 2008
См. также
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Жидкая углекислота" в других словарях:
УГЛЕКИСЛОТА — Ангидрид угольной кислоты ( Аcidum cаrbonicum аnhydricum ; Саrbonei dioxydum): СО 2 . Бесцветный газ без запаха. В 1,5 раза тяжелее воздуха. При давлении 60 атм может быть превращен в жидкость при обычной температуре. Жидкий угольный ангидрид по … Словарь медицинских препаратов
Углекислота — Диоксид углерода Другие названия углекислый газ, углекислота, сухой лед(твердый) Формула CO2 Молярная … Википедия
УГЛЕКИСЛОТА — (угольный ангидрид, двуокись углерода, углекислый газ, С02) была известна еще в 16 в. Парацельсу и ван Гель монту как составная часть воздуха и как продукт, образующийся при брожении, дыхании и т. д. У."бесцветна, имеет слабый запах и слегка … Большая медицинская энциклопедия
Углекислота* — углекислый газ, угольный ангидрид, СО 2 вещество газообразное при обыкновенных условиях температуры и давления и сравнительно легко переходящее в жидкое и твердое состояние. Так как углекислота довольно легко получается в очень чистом виде и для… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Углекислота — углекислый газ, угольный ангидрид, СО 2 вещество газообразное при обыкновенных условиях температуры и давления и сравнительно легко переходящее в жидкое и твердое состояние. Так как углекислота довольно легко получается в очень чистом виде и для… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Acidum carbonicum anhydricum — УГЛЕКИСЛОТА . Ангидрид угольной кислоты ( Аcidum cаrbonicum аnhydricum ; Саrbonei dioxydum): СО 2 . Бесцветный газ без запаха. В 1,5 раза тяжелее воздуха. При давлении 60 атм может быть превращен в жидкость при обычной температуре. Жидкий… … Словарь медицинских препаратов
Газы сжиженные и в критическом состоянии — Во времена Лавуазье (см. это имя) переход Г. в жидкое и твердое состояние казался весьма вероятным, так как при химических реакциях часто совершается подобная перемена физического состояния ( Oeuvres de Lavoisier , т. II 804). В начале XIX… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Оксид углерода(IV) — Оксид углерода (IV) … Википедия
Диоксид углерода — Другие названия углекислый газ, углекислота, сухой лед(твердый) Формула CO2 Молярная … Википедия
Доброго времени суток
приспичило мне дома ( на балконе) поварить полуавтоматом , а 40 литровый баллон в руках не поносишь,а заправлять 8 литровый дорого и долго.
посмотрев на ютубе кто как переливает . сделал такую приспособу. результат отличный. переливаю по звуку,потом проверяю вес.
по центру хотел поставить манометр, но особой нужды в этом не заметил. отверстие 7мм . собрал на резьбах
потом обварил


переливка углекислоты
это как? у меня приспособление ето же есть ввиде трубки и двух гаек, и баллон 10 литровый (6 кг) но что то пока не очень справляюсь с этой задачей.
Каждый убежден, что другие ошибаются, когда судят о нем, и что он не ошибается, когда судит о других.
переливка углекислоты
переливка углекислоты
переливка углекислоты
При переливе "донор" должен находиться кверху жопой.
Чтоб на выходе была жидкая фаза.
Я переливаю с помощью шланга ВД от старого углекислотного огнетушителя, из которого собственно и был сделан маленький баллон, путём удаления заборной трубки внутри.
переливка углекислоты
подозреваю, железяка так в патрон зашалась.
но - возможно- улучшает циркуляцию энэргетических полей, в особенности энэргии ци в нижней чакре.
переливка углекислоты
Каждый убежден, что другие ошибаются, когда судят о нем, и что он не ошибается, когда судит о других.
переливка углекислоты
что бы манометр поставить (тело для резьбы). переливаю по звуку, открываю сначала маленький -шипение перелива отчётливо слышно. как закончилось-всё закрыл.
Да, баллоны кладу на пол. приподнимая конец 40 л-го. На жёсткой сцепке мне показалось удобно тем ,что баллоны не раскатываются,вентиля крутить удобнее ,и нестрашно ,что трубка лопнет или ещё какой форсмажор
переливка углекислоты
Как верно уже заметили выше, баллон-донор, должен быть кверху ногами, чтобы жидкость перетекала. Кроме того, подсмотрел у заправщика, что когда баллон плохо заливается, он открывает вентиль, выпускает часть газа, чтобы баллон охладился. А со второго раза заливает уже будь здоров. Помню в 10л баллон вдули 7 с чем-то кг СО2, потом стравливали излишек.
Спору нет. Одно но. Приспособа очень жесткая. В отличие от шланга ВД, она не позволяет баллонам смещаться один относительно другого. Баллоны достаточно тяжелые и в нештатной ситуации (подуронили слегка баллон), такая приспособа может повредить редуктор. Ее нужно рассматривать как рычаг с опорами в редукторах, на концах которого находятся две массы, от 40л и от 10л баллонов.
Гибкий шланг все же лучше, шансов повредить что-то меньше.
Читайте также:

