Как сделать слабый электролит
Обновлено: 03.07.2024
Материал этого раздела частично вам знаком по ранее изученным школьным курсам химии и из предыдущего раздела. Кратко повторим, что вам известно, и познакомимся с новым материалом.
В предыдущем разделе мы обсуждали поведение в водных растворах некоторых солей и органических веществ, полностью распадающихся на ионы в водном растворе.
Имеется ряд простых, но несомненных доказательств того, что некоторые вещества в водных растворах распадаются на частицы. Так, водные растворы серной H2SO4, азотной HNO3, хлорной HClO4, хлороводородной (соляной) HCl, уксусной CH3COOH и других кислот имеют кислый вкус. В формулах кислот общей частицей является атом водорода, и можно предположить, что он (в виде иона) является причиной одинакового вкуса всех этих столь различных веществ.
Образующиеся при диссоциации в водном растворе ионы водорода придают раствору кислый вкус, поэтому такие вещества и названы кислотами. В природе только ионы водорода имеют кислый вкус. Они создают в водном растворе так называемую кислотную (кислую) среду.
Водные растворы гидроксидов лития (LiOH), натрия (NаОН), калия (КОН), бария (Ва(ОН)2), кальция (Са(ОН)2) и других металлов имеют одинаковый неприятный горько-мыльный вкус и вызывают на коже рук ощущение скольжения. По-видимому, за это свойство ответственны гидроксид-ионы ОН – , входящие в состав таких соединений.
Хлороводородная HCl, бромоводородная HBr и йодоводородная HI кислоты реагируют с цинком одинаково, несмотря на свой различный состав, т. к. в действительности с цинком реагирует не кислота:
Zn + 2НСl = ZnСl2 + Н2,
а ионы водорода:
Zn + 2H + = Zn 2+ + Н2,
и образуются газообразный водород и ионы цинка.
Смешивание некоторых растворов солей, например хлорида калия KCl и нитрата натрия NaNO3, не сопровождается заметным тепловым эффектом, хотя после выпаривания раствора образуется смесь кристаллов четырех веществ: исходных – хлорида калия и нитрата натрия – и новых – нитрата калия КNO3 и хлорида натрия NaCl. Можно предположить, что в растворе две исходные соли полностью распадаются на ионы, которые при его выпаривании образуют четыре кристаллических вещества:
Сопоставляя эти сведения с электропроводностью водных растворов кислот, гидроксидов и солей и с рядом других положений, С.А.Аррениус в 1887 г. выдвинул гипотезу электролитической диссоциации, согласно которой молекулы кислот, гидроксидов и солей при растворении их в воде диссоциируют на ионы.
Изучение продуктов электролиза позволяет приписать ионам положительные или отрицательные заряды. Очевидно, если кислота, например азотная НNO3, диссоциирует, предположим, на два иона и при электролизе водного раствора на катоде (отрицательно заряженный электрод) выделяется водород, то, следовательно, в растворе имеются положительно заряженные ионы водорода Н + . Тогда уравнение диссоциации следует записать так:

НNO3 = Н + + .
Сила однотипных кислородных кислот изменяется в противоположном направлении, например йодная кислота НIО4 слабее хлорной кислоты НСlО4.
Если элемент образует несколько кислородных кислот, то наибольшей силой обладает кислота, в которой кислотообразующий элемент имеет самую высокую валентность. Так, в ряду кислот НСlО (хлорноватистая) – НСlО2 (хлористая) – НСlО3 (хлорноватая) – НСlО4 (хлорная) последняя наиболее сильная.
Один объем воды растворяет около двух объемов хлора. Хлор (примерно половина его) взаимодействует с водой:
Cl2 + H2O = HCl + HСlO.
Хлороводородная кислота является сильной, в ее водном растворе практически нет молекул HCl. Правильнее уравнение реакции записать так:
Cl2 + H2O = H + + Cl – + HClO – 25 кДж/моль.
Образующийся раствор называют хлорной водой.
Хлорноватистая кислота – быстродействующий окислитель, поэтому ее применяют для отбеливания тканей.
2. Гидроксиды элементов главных подгрупп I и II групп периодической системы: LiОН, NaОН, КОН, Са(ОН)2 и др. При переходе вниз по подгруппе по мере усиления металлических свойств элемента сила гидроксидов возрастает. Растворимые гидроксиды главной подгруппы I группы элементов относят к щелочам.
Щелочами называют растворимые в воде основания. К ним относят также гидроксиды элементов главной подгруппы II группы (щелочно-земельные металлы) и гидроксид аммония (водный раствор аммиака). Иногда щелочами считают те гидроксиды, которые в водном растворе создают высокую концентрацию гидроксид-ионов. В устаревшей литературе вы можете встретить в числе щелочей карбонаты калия К2СО3 (поташ) и натрия Na2CO3 (сода), гидрокарбонат натрия NaHCO3 (питьевая сода), буру Na2B4O7, гидросульфиды натрия NaHS и калия KHS и др.
Гидроксид кальция Са(ОН)2 как сильный электролит диссоциирует в одну ступень:
3. Почти все соли. Соль, если это сильный электролит, диссоциирует в одну ступень, например хлорид железа:
В случае водных растворов к слабым электролитам ( 3+ ?
Осно'вные свойства гидроксидов одного и того же элемента усиливаются с уменьшением валентности элемента. Так, осно'вные свойства дигидроксида железа Fe(OH)2 выражены сильнее, чем у тригидроксида Fe(OH)3. Это утверждение равносильно тому, что кислотные свойства Fe(OH)3 проявляются сильнее, чем у Fe(OH)2.
4. Гидроксид аммония NH4OH.
При растворении газообразного аммиака NH3 в воде получается раствор, который очень слабо проводит электрический ток и имеет горько-мыльный вкус. Среда раствора осно'вная, или щелочная. Объясняется такое поведение аммиака следующим образом. При растворении аммиака в воде образуется гидрат аммиака NH3•Н2О, которому условно мы приписываем формулу несуществующего гидроксида аммония NH4OH, считая, что это соединение диссоциирует с образованием иона аммония и гидроксид-иона ОН – :
5. Некоторые соли: хлорид цинка ZnCl2, тиоцианат железа Fe(NСS)3, цианид ртути Hg(CN)2 и др. Эти соли диссоциируют ступенчато.
К электролитам средней силы некоторые относят фосфорную кислоту Н3РО4. Мы будем считать фосфорную кислоту слабым электролитом и записывать три ступени ее диссоциации. Серная кислота в концентрированных растворах ведет себя как электролит средней силы, а в очень концентрированных растворах – как слабый электролит. Мы далее будем считать серную кислоту сильным электролитом и записывать уравнение ее диссоциации в одну ступень.
В растворах слабых электролитов одновременно существуют как молекулы, так и ионы электролита. Между ними устанавливается состояние химического равновесия. Изотонический коэффициент растворов слабых электролитов находится в пределах от 1 до 2.
Пример 13.2. Рассчитайте изотонический коэффициент раствора слабого электролита ЛВ при степени диссоциации 20%.
Решение. Электролит распадается на два иона. Пусть с — концентрация электролита. При данной степени диссоциации концентрация каждого иона составит 0,2с, а концентрация оставшихся молекул с - 0,2с = 0,8с. Найдем суммарную концентрацию имеющихся в растворе частиц вещества:

Находим изотонический коэффициент, деля суммарную концентрацию частиц на концентрацию молекул, которая была бы при отсутствии диссоциации:


Рассмотрим условия смещения равновесия диссоциации слабого электролита на примере раствора слабой уксусной кислоты. Процесс запишем в традиционной форме диссоциации, что не влияет на рассуждения и выводы:
Равновесия ионизации слабых электролитов подчиняются закону действующих масс. При уменьшении концентрации электролита степень диссоциации (ионизации) увеличивается, так как равновесие смещается в сторону образования большего числа частиц, в данном случае являющихся ионами. Электролитическая диссоциация подобна газовой реакции, идущей с увеличением числа частиц. При уменьшении давления, а следовательно, и концентрации газа (с = p/(RT)) равновесие такой реакции смещается вправо.
При изменении температуры равновесие диссоциации слабого электролита смещается так же, как равновесие эндотермической химической реакции. Например, при нагревании равновесие смещается вправо, и степень диссоциации увеличивается.
Равновесие ионизации слабого электролита смещается при наличии в растворе сильного электролита, один из ионов которого одинаков с ионом слабого электролита.
Пример 13.3. Пусть порции уксусной кислоты растворены в воде и в растворах хлороводорода и ацетата натрия, как показано на рис. 13.3. В каком растворе степень диссоциации уксусной кислоты наибольшая при прочих равных условиях?
Решение. Сильные электролиты НС1 и CH3COONa дают большое число ионов
и СН3СОО“, одинаковых (одноименных) с ионами уксусной кислоты. Поэтому в растворах 2 и 3 равновесие диссоциации уксусной кислоты смещено влево по сравнению с раствором 1. В нем степень диссоциации наибольшая.

Рис. 133. Растворы уксусной кислоты в присутствии сильных электролитов
(к примеру 13.3)
Степень диссоциации слабого электролита зависит от концентрации. В этом ее недостаток в качестве характеристики свойств электролита. Величиной, не зависящей от концентрации, является константа диссоциации К;у Это разновидность константы равновесия, относящаяся к процессам диссоциации и ионизации. Константы диссоциации слабых электролитов находят в справочных таблицах. Рассмотрим диссоциацию одной из слабых кислот — фтороводородной. Концентрацию растворенного вещества обозначим с0. Это общая концентрация. Концентрация диссоциированного вещества — сд. Ионы образуются в одинаковой концентрации, равной сд.

Подставляя обозначения равновесных концентраций, написанные иод формулами в уравнении реакции, получим


Концентрация вещества, распавшегося на ионы, выражается через степень диссоциации: сд = а • с0 (уравнение (13.4)). Подставляя в предыдущее уравнение, получим
Уравнение (13.6) называют законом разведения Оствальда (разведение — величина, обратная концентрации). Оно связывает константу диссоциации, характеризующую свойства вещества как электролита, с концентрацией и степенью диссоциации. Для упрощения расчетов при степени диссоциации а 4 .
Решение. Из уравнения диссоциации слабой кислоты (см. выше) следует, что с(Н + ) = Сд. Применяем уравнение (13.7):

Слабые электролиты могут диссоциировать на ионы в несколько стадий, или ступенчато. Так диссоциируют, в частности, слабые кислоты.
После диссоциации первого иона Н + образуется анион кислой соли, который тоже диссоциирует, и т.д. На каждой следующей стадии степень диссоциации уменьшается, так как отрыв протонов идет сначала от молекул, а потом от анионов с увеличивающимся отрицательным зарядом. Константа диссоциации па каждой следующей стадии уменьшается приблизительно в 10 4 —10 5 раз:

Наибольшее число ионов водорода образуется на первой стадии диссоциации кислоты, а добавочное число Н + , появляющихся на последующих стадиях, практически можно не учитывать.
Пример 13.5. В каком растворе степень диссоциации Н2РС>4 (а2) больше при прочих равных условиях: а) в растворе фосфорной кислоты; б) в растворе дигидрофосфата калия?

Решение. Эти вещества по-разному диссоциируют на первой стадии, так как кислая соль является сильным электролитом, а ее анион диссоциирует как слабый электролит:
Вторая стадия диссоциации одна и та же:

В растворе фосфорной кислоты ионы водорода, образовавшиеся на первой стадии диссоциации, смещают влево равновесие на второй стадии. Поэтому (Х2 в растворе однозамещенной соли больше, чем в растворе фосфорной кислоты.
Мощные аккумуляторные батареи, используемые на транспорте и в промышленности, в качестве электрохимического реагента используют кислотные или щелочные растворы. Как правило, залитая в АКБ жидкость рассчитана на весь срок эксплуатации источника питании. Но зачастую со временем электролит деградирует (теряет свои свойства) – из-за загрязнения или в результате замерзания при отрицательных температурах. Помутневший раствор меняют, но необязательно покупать готовую жидкость – её можно приготовить в домашних условиях. Эта не слишком сложная операция позволит вам сэкономить часть денежных средств.

Состав электролита для аккумуляторов
В наиболее распространённых свинцово-кислотных батареях в качестве электролита используется водный раствор серной кислоты, достаточно концентрированный.
В щелочных батареях основным активным веществом является антипод кислоты – щёлочь, в состав электролита для щелочных аккумуляторов входят едкий калий и та же дистиллированная вода.
Поскольку преобладающими в автопроме являются кислотные аккумуляторы, рассмотрим состав электролита этого типа более подробно.
Серная кислота представляет собой прозрачную жидкость маслянистой концентрации, которая гораздо тяжелее воды. Она хорошо в ней растворяется и не имеет характерного запаха. Процесс смешивания серной кислоты с водой сопровождается выделением тепловой энергии, поэтому рекомендуется выполнять эту операцию с особой тщательностью и аккуратностью.
Допускается использование кислоты согласно двум госстандартам – ГОСТ 0142б2-78 и ГОСТ 0667-83. Они практически равноценны и предписывают использование моногидрата H2SO4 в концентрации до 94%, с совокупным содержанием примесей на уровне не более 0.0367%, включая 0.0001% марганца и столько же мышьяка, 0.013% железа, 0.0005% хлора. Плотность кислоты –1.83 г/см 3 .
Второй компонент – дистиллированная, то есть подвергшаяся глубокой очистке вода Использование речной, водопроводной, а тем более технической воды не допускается. Согласно ГОСТу 06709-72, возможно использование воды, полученной их конденсата паротурбинных силовых установок, при этом такая жидкость должна в обязательном порядке подвергаться лабораторным анализам на предмет контроля уровня добавок – того же железа (не более 0.0004%) и меди (максимум 0.005%).
Разобравшись, из чего состоит электролит кислотного аккумулятора, стоит упомянуть, как готовят дистиллированную воду в промышленных условиях, в аптеках, лабораториях. Для этих целей применяют приборы под названием электрические дистилляторы.
Существуют модели менее производительные (до 5 литров/час) и способные готовить до 10 литров жидкости. Промышленные дистилляторы оперируют сотнями литров/час.
В лабораториях дистиллят также подвергается анализу с целью контроля уровня сухих веществ, кальция, сульфатов, аммиака, хлоридов, солей аммония, тяжёлых металлов.
Проще всего приобретать дистиллированную воду в аптеках – полуторалитровая ёмкость обойдётся вам в 10–25 рублей.
Какой должна быть плотность электролита
В традиционных свинцово-кислотных АКБ используют электролит, смешанный в такой пропорции, чтобы его плотность составляла от 1.18 до 1.24 г/см 3 . Поскольку плотность воды около 1, а серной кислоты – 1.83 г/см 3 , проще всего готовить раствор поэтапно, особенно если отсутствует ареометр. Сначала жидкости смешивают в одинаковой пропорции, получая раствор ёмкостью около 1.4 г/см 3 , на втором этапе его уже разводят до нужной консистенции при температуре порядка 20 градусов выше нуля.
Использовать металлические ёмкости для приготовления электролита нельзя (за исключением свинцовых), желательно, чтобы это была фаянсовая, эбонитовая или пластиковая посуда, пластик нужен тоже специальный. Категорически воспрещено использовать стеклянную тару – во время нагрева она может лопнуть.
Измеряют такие свойства электролита аккумуляторов, как плотность, с помощью ареометров, предварительно откалиброванных на значения 1.10–1,45 г/см 3 при цене деления шкалы не более 0.005 г/см 3 . Основная проблема заключается в том, что при изменении температуры меняется и плотность.
А поскольку процедура разбавления воды серной кислотой сопровождается выделением большого количества тепла, для измерения плотности приходится учитывать эти температурные колебания. Для этого используются термометры с ценой деления в один градус, рассчитанные на диапазон 0–50 градусов. К этим измерительным приборам предъявляются такие же требования, как и к ареометрам – они не должны содержать металлических или деревянных частей.
В домашних условиях учитывать температурный фактор гораздо проще, дождавшись, пока после очередного этапа смешивания электролит не остынет до 20º С.
Впрочем, математические выкладки предельно просты: с увеличением температуры на 1 градус плотность жидкости увеличивается на 0.0007 г/см 3 . То есть, если электролит нагрелся до 30º С, его плотность выросла на 0.007 г/см 3 .
Напротив, понижение температуры на те же 10 градусов приведёт к уменьшению плотности на такую же величину.
Заливать готовый электролит в аккумулятор допустимо, если температура жидкости не превышает 25º С.
Техника безопасности
Поскольку при работе с электролитом мы имеем дело с агрессивными жидкостями, щелочами и кислотами, соблюдение соответствующих мер безопасности является обязательным. Поэтому перед началом приготовления электролита для аккумуляторной батареи следует запастись следующими средствами ИЗ:
- латексными перчатками;
- защитными очками;
- одеждой, которую не жалко, а также фартуком из материала, устойчивого к воздействию кислот и щелочей;
- средствами для нейтрализации агрессивных жидкостей при их попадании на открытую кожу (борный раствор, нашатырный спирт, содовый раствор).
Необходимое оборудование
А теперь перечислим, что нам потребуется для домашнего приготовления электролита:
- тара, устойчивая к воздействию кислоты;
- палочка из стекла для перемешивания жидкости;
- необходимый объём дистиллированной воды;
- аккумуляторная серная кислота, или щёлочь в жидком или сухом виде;
- ареометр и термометр, соответствующие указанным выше требованиям.
Как самостоятельно приготовить электролит для аккумулятора
Если средства индивидуальной безопасности, измерительные приборы и материалы приготовлены, можно приступать к смешиванию компонентов. Готовую жидкость рекомендуется сразу залить в АКБ, в крайнем случае – отнести в гараж. Разумеется, первый вариант предпочтительнее, поскольку хранение батареи без электролита приводит к деградации и разрушению активной массы электродов.
Рассмотрим, как приготовить электролит для кислотно-свинцовых аккумуляторов
Помещение, в котором вы будете работать, должно быть вентилируемым, температура не должна превышать 25° С. Аккумуляторы, используемые в легковом транспорте – это 55–60-амперные батареи, в которые помещается до 3.7 литра электролита (при желании эту цифру можно уточнить на сайте производителя). Чтобы перестраховаться, изготавливаем жидкости на 300–400 мл больше требуемого. До начала приготовления раствора необходимо определиться с его плотностью. Выше мы указали допустимый диапазон, а конкретное значение зависит от климата региона, в котором вы проживаете. Если это юг, то значение должно быть близким к минимальному порогу, с продвижением на север начальная плотность должна расти.
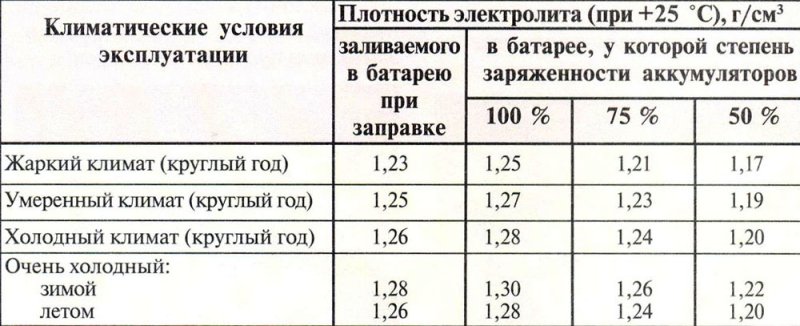
Так, для Крайнего Севера, где зимой возможны 50-градусные морозы, плотность должна соответствовать значению 1.27 г/см 3 , причём после заливки и зарядки батареи она поднимется до 1.29 г/см 3 . В средних широтах делаем электролит плотностью 1.28 г/см 3 .
Как и плотность, пропорции состава электролита для аккумуляторов будут зависеть от региона. Так, для юга, чтобы получить плотность 1.24 г/см 3 , нам потребуется на 1 литр дистиллированной воды 330 мл серной кислоты.
Алгоритм приготовления раствора для свинцовых аккумуляторов в домашних условиях:
- наливаем в подготовленную ёмкость необходимое количество дистиллированной воды;
- тонкой струёй начинаем добавлять кислоту, одновременно помешивая жидкость стеклянной палочкой;
- после окончания процесса производим замер плотности и оставляем раствор на 12 часов для окончательного перемешивания компонентов. Измеряем плотность повторно, если имеется расхождение с расчётной величиной, добавляем соответствующий компонент;
- готовый электролит заливаем в банки АКБ, которую предварительно желательно промыть. Снова замеряем плотность и при необходимости производим корректировку, доливая воду или кислоту.
Окончательный замер производится на полностью заряженном аккумуляторе.
Процесс приготовления электролита на щелочной основе
Щелочной электролит может продаваться в виде готового раствора или в гранулах. Последние засыпаются в дистиллированную воду, и жидкость стеклянной палочкой размешивается до полного растворения щёлочи. В какой пропорции брать компоненты, обычно указывается на этикетке аккумулятора, наклеенной на его боковой грани.

Ситуация с плотностью щелочного электролита аналогична кислотному: чем ниже температура эксплуатации автомобиля, тем выше должна быть долевая часть более тяжёлой щёлочи. Так, при температуре до 20 градусов ниже нуля практикуется использование раствора плотностью 1.21 г/см 3. . При его приготовлении необходимо добавить 20 г гранул на литр щёлочи.
Если предполагается использование АКБ при температурах до -40 градусов, плотность электролита нужно повысить до 1.28 г/см 3 .
Приведём распространённые рецепты приготовления щелочного электролита:
- для плотности в пределах 1.17–1.19 г/см 3 необходимо взять на одну часть щёлочи четыре части дистиллированной воды;
- плотность 1.19–1.21 г/см 3 достигается при пропорциях 1 часть щелочи к двум частям воды;
- плотность 1.27 г/см 3 , которая позволяет получить жидкость, не застывающую при очень низких температурах, достигается при смешивании воды и щёлочи в одинаковых пропорциях.
Чтобы правильно приготовить щелочной электролит, после смешивания его необходимо выдержать в течение 6–8 часов для полноценного перемешивания в закрытой крышкой ёмкости. Контакт с атмосферным воздухом нежелателен – он оказывает деградирующее воздействие на электролит. Незначительная часть щёлочи обычно не растворяется, выпадая в осадок. В аккумулятор следует заливать только прозрачную жидкость, без примесей, которые становятся причиной замыкания пластин и увеличения тока саморазряда.
Другие виды электролитов
Гелевые батареи и AGM аккумуляторы также используют электролит, но самостоятельно приготовить его или долить/поменять не получится. Так, в гелевых АКБ используется загущённый электролит, получить который в домашних условиях с необходимыми характеристиками вряд ли возможно. Восстановление плотности таких батарей производится только доливкой воды, которая после правильной зарядки (несколькими циклами с использованием малых токов) частично восстанавливает ёмкость батареи.
Мощные аккумуляторные батареи, используемые на транспорте и в промышленности, в качестве электрохимического реагента используют кислотные или щелочные растворы. Как правило, залитая в АКБ жидкость рассчитана на весь срок эксплуатации источника питании. Но зачастую со временем электролит деградирует (теряет свои свойства) – из-за загрязнения или в результате замерзания при отрицательных температурах. Помутневший раствор меняют, но необязательно покупать готовую жидкость – её можно приготовить в домашних условиях. Эта не слишком сложная операция позволит вам сэкономить часть денежных средств.

Состав электролита
Электролит является раствором активного вещества в дистиллированной воде. В зависимости от типа используемых аккумуляторных батарей активным веществом являются:
- серная кислота для свинцово-кислотных аккумуляторов;
- щелочи (едкий натрий или калий) для щелочных аккумуляторов.
В щелочных АКБ для выполнения особых требований в составе электролита может присутствовать добавка едкого лития. Также едкий литий является основным в литий-ионных и литий-полимерных аккумуляторах.
Электролит для аккумулятора своими руками, можно ли сделать
Электролит для аккумуляторов можно, как купить в специализированных магазинах, так и изготовить его собственными руками, обладая достаточными знаниями.

Перед тем как приступить к изготовлению электролита, нужно внимательно изучить инструкцию по его изготовлению и список того что для этого понадобится, а также научится правильно измерять его плотность.

Требования к компонентам
Нормальное протекание химических реакций предъявляет особые требования к веществам электролита. Основное требование – высокая степень чистоты материалов. Чем чище будут химические вещества для приготовления электролита, тем выше будет КПД аккумуляторов и их долговечность.
Согласно требованиям стандартов, аккумуляторная серная кислота должна содержать не менее 92 – 94% серной кислоты. Оставшиеся 6 – 8% занимает вода. Содержание солей металлов не более тысячных долей процента.
Внимание! Щелочь выпускается в сухом виде и к ней предъявляются подобные требования.
Если с перечисленными веществами вопросов обычно не возникает (ответственность за чистоту возлагается на предприятия, выпускающие материалы и торговые организации), то с водой дела обстоят несколько хуже. Многие автолюбители не делают различие между обычной и дистиллированной водой.
Вода из водопровода насыщенна растворами различных солей металлов и органических веществ. Простое кипячение в состоянии избавиться от незначительного количества солей жесткости, а остальные вещества остаются в неизменном виде. В водопроводной воде наиболее опасными для аккумуляторов являются соли железа, находящиеся там в больших концентрациях.
Активные вещества для электролита нужно разводить дистиллированной водой, которая отличается тем, что содержание солей в ней минимально. Такая вода по своим химическим и физическим параметрам практически соответствует идеальной.
Физические свойства сернокислотного электролита
Есть еще один физический фактор, который необходимо учитывать, особенно когда приготавливаются большие объемы раствора серной кислоты и дистиллированной воды. Это то обстоятельство, что при смешивании равных объемов серной кислоты и воды, после охлаждении такого раствора его объем будет меньше, чем сумма первоначальных объёмов. Что бы учесть этот фактор нужно обратится к четвертой таблице, в которой указаны величины уменьшения объёмов для растворов серной кислоты различной плотности.
Таблица 4 Сокращение объема раствора

Вязкость
Вязкость это свойство электролита, наиболее существенно влияющее на работоспособность свинцового аккумулятора. Электрохимические процессы, протекающие при работе аккумулятора, носят диффузионный характер. Скорость диффузии, в основном, зависит от вязкости электролита. Именно скоростью диффузии определяется поступление электролита к поверхности и в поры электродов при разряде, особенно при установке жестких (минутных, часовых) режимов разряда.
Чем вязкость выше, тем диффузия медленнее. При понижении температуры на 25С вязкость электролита возрастает в 2 раза, а при температуре в -50С она возрастает почти в 30 раз по сравнению с вязкостью при нормальной температуре. С увеличением вязкости падает ёмкость. Именно поэтому ра6отоспособность свинцовых аккумуляторов при низких температурах ухудшается. Это обстоятельство необходимо учитывать при установке герметичных аккумуляторов с гелевым (загущённым) электролитом.
Удельное сопротивление электролита
Сопротивление электролита, занимающего объем, ограниченный длиной 1 см и сечением в 1 см3, рассчитывается по формуле:
где r – удельное сопротивление Ом см;
S — поперечное сечение см2.
Сопротивление изменяется с изменением концентрации и температуры электролита.
Чтобы иметь минимальное внутреннее сопротивление АКБ, желательно применять электролит с наименьшим удельным сопротивлением.
Величины удельных сопротивлений приведены в таблице 5.
Таблица 5. Удельные сопротивления электролита

Удельное сопротивление электролита возрастает при снижении температуры, наиболее значительно при температуре 0С.
Температура замерзания электролита важна, постольку по мере разряда аккумулятора снижается его плотность и, соответственно, температура его замерзания. При замерзании объем электролита увеличивается, что приводит к разрушению сосуда и электродов аккумулятора. Наиболее низкую температуру замерзания имеет электролит плотностью 1,29 г/см3. Стартерные аккумуляторные батареи, эксплуатируемые в суровых условиях, имеют электролит плотностью 1,26-1,30 г/см3, который не замеряет при самых низких возможных температурах.
Для определения температур замерзания электролитов различной плотности следует пользоваться таблицей 6.
Таблица 6. Температура замерзания электролитов

Плотность электролита
Для заливки в аккумуляторы используются составы с точно определенной концентрацией входящих в состав веществ. Для облегчения контроля количественного состава введено понятие плотности. Это объясняется тем, что дистиллированная вода обладает плотностью, равной 1 гр/см3 и любые посторонние добавки увеличивают это значение. Серная кислота и щелочь, имеют гораздо более высокие значения удельного веса, поэтому, измеряя плотность раствора, можно легко определить состав электролита. Плотность измеряется при помощи простейшего устройства, а о том, как замерять плотность, читайте в этой статье.


Как выполнить проверку жидкости в батарее?
Чтобы восстановить обслуживаемый источник энергии в автомобиле, нужно правильно залить электролит в аккумулятор. Для этого сначала стоит выполнить проверку. С помощью специального прибора, ареометра. Это простое устройство проверяет жидкость на предмет плотности и позволяет сделать конкретные быстрые выводы о состоянии аккумулятора в вашем автомобиле.
Проверка выполняется достаточно просто. Вам нужно открутить одну из крышек аккумулятора с помощью большой крестовой отвертки, вставить рабочую часть ареометра в жидкость и подержать несколько секунд. С помощью специальной шкалы оборудование покажет уровень плотности, что и станет поводом для дальнейшей доливки нужного типа жидкости.
Количество исходных веществ
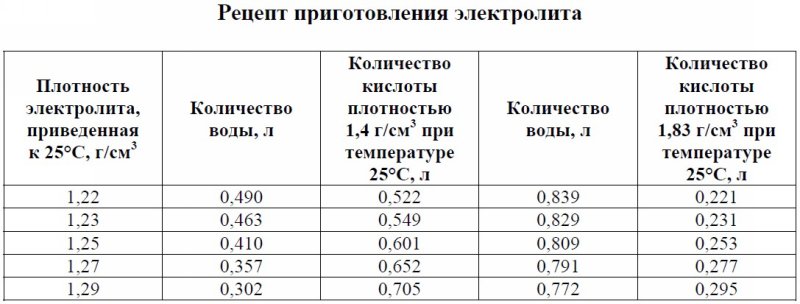
Чтобы приготовить электролит с заданным значением плотности, нужно взять строго определенное количество исходных веществ. В таблице ниже приведены данные по наиболее распространенным значениям плотности для разных типов электролита.
| Плотность, г/см3 | Количество воды, л | Количество кислоты, л | Количество щелочи, кг | Температура замерзания электролита, °С |
| 1,24 | 0,819 | 0,242 | -45 | |
| 1.25 | 0,809 | 0,253 | -50 | |
| 1.26 | 0,8 | 0,263 | -55 | |
| 1.27 | 0,791 | 0,274 | -60 | |
| 1.28 | 0,781 | 0,285 | -65 | |
| 1,15 – 1.21 | 3 | 1 | -19 … +35 | |
| 1.25 – 1.27 | 2 | 1 | -20 … -40 |
Для повышения допустимой температуры эксплуатации в регионах с жарким климатом или на предприятиях с высокой температурой окружающего воздуха, в щелочные аккумуляторы вводится добавка едкого лития в количестве 15-20 гр. на литр электролита.
Использование высокой концентрации
Можете подумать – почему самая высокая концентрация в 1,29г/см3, можно ли больше? Вообще сейчас можно найти концентрат электролита плотностью в 1,4г/см3, но его также нужно разбавить водой и только затем наливать в сухозаряженный аккумулятор.
Высокие концентрации очень негативно влияют на пластины аккумулятора в целом, то есть они их разъедают, пусть медленно, но верно! Поэтому если налить высокие концентрации ваш АКБ прослужит недолго.
Для средней полосы России нормальный показатель равняется в 1,27 г/см3.
Особенности технологии приготовления электролита
При самостоятельном приготовлении следует помнить следующее:
- плотность кислоты и щелочи намного выше плотности воды;
- реакции смешивания кислоты с водой и растворения щелочи происходят с выделением высокой температуры (до 80-90°С);
- кислоты и щелочи взаимодействуют с большинством металлов.
Из перечисленного следует, что посуда для приготовления электролита должна быть из материала, стойкого к действию агрессивных веществ и температуры. Наиболее соответствует этим требованиям посуда из стекла и керамики. Использование пластиковой посуды возможно при условии недопускания ее нагрева до высоких температур. Нельзя использовать эмалированную посуду, поскольку при наличии незаметных трещин в эмали будет происходить загрязнение электролита солями металлов. То же самое относится к изделиям из нержавеющей стали. Такие материалы не вступают в реакцию с водой, но производители не гарантируют ее нейтральность по отношению к агрессивным веществам.
Важно! Перед тем, как сделать электролит, заранее отмеряют необходимое количество компонентов.
Приготовление кислотного электролита
Высокая плотность кислоты и способность разогрева при смешивании с водой обусловили специфику приготовления раствора: кислоту нужно вливать в воду. Если поступить наоборот, то вода, оказавшись сверху, нагреется до температуры закипания и выплеснется наружу вместе с каплями кислоты.
Чтобы уменьшить нагрев, кислоту целесообразно разбавить в два этапа. На первом готовится раствор плотностью 1.40, а затем, после остывания, делают электролит необходимой концентрации. Раствор с плотностью 1.40 называют корректирующим. Он применяется для коррекции плотности электролита в рабочих аккумуляторах. После добавления кислоты в воду смесь аккуратно перемешивают стеклянной палочкой. Приготовленный электролит необходимо оставить на некоторое время (от половины до суток) для его равномерного смешивания и полного остывания.
Внимание! Срок хранения кислотного раствора неограничен.
Приготовление щелочного электролита
Необходимое количество щелочи высыпают в отмеренное количество воды и перемешивают до полного растворения. Также необходимо выдержать время, пока осадок не растворится полностью и температура не опустится до нормальной.
Раствор щелочи нужно хранить в герметично закрытой таре, не допуская попадания воздуха. Углекислый газ легко вступает в реакцию со щелочами с образованием карбонатов – солей угольной кислоты. В результате содержание активного вещества в растворе с течением времени падает.
Растворы кислоты и щелочи должны быть прозрачными или иметь легкий желтоватый оттенок. Наличие мутности отстоявшегося раствора говорит о низкой чистоте исходных компонентов и для использования в аккумуляторах непригодны.


Меры безопасности
Приготовление электролита представляет собой опасность из-за использования очень агрессивных веществ. Концентрированные растворы кислоты и щелочей способны вызвать труднозаживающие кислотные ожоги, а при попадании в глаза вызывают слепоту.
Перед работой следует приготовить нейтрализующий раствор для смывки случайно попавших на тело капель электролита:
- 1% раствор пищевой соды при работе с кислотой.
- Столовый уксус для обезвреживания щелочи. Уксус нужно наполовину разбавить водой.
Работать следует в резиновых перчатках и обязательно в защитных очках или маске. При попадании электролита на кожу нужно обильно промыть место попадания нейтрализующим раствором, а после промывки глаз немедленно обратиться к врачу.
Все работы производятся на открытом воздухе или хорошо вентилируемом помещении. Пары кислоты, выделяющиеся при приготовлении раствора (особенно в горячем состоянии) вызывают раздражение верхних дыхательных путей, выраженные сильным кашлем и отеком слизистых оболочек.
В качестве одежды в домашних условиях можно использовать ту, которую не сильно жалко, поскольку даже после промывки нейтрализующим раствором между волокнами ткани останется часть агрессивного вещества и вещи будут безнадежно испорчены.
электролиты они представляют собой вещества, которые образуют электропроводящий раствор при растворении в полярном растворителе, таком как вода. Растворенный электролит разделяется на катионы и анионы, которые диспергированы в указанном растворе. Если к раствору приложен электрический потенциал, катионы будут прилипать к электроду, который содержит большое количество электронов..
Напротив, анионы в растворе будут связываться с электрически дефектным электродом. Вещество, которое распадается на ионы, приобретает способность проводить электричество. Большинство солей, кислот и растворимых оснований представляют собой электролиты.

Некоторые газы, такие как хлористый водород, могут действовать как электролиты при определенных условиях температуры и давления. Натрий, калий, хлорид, кальций, магний и фосфат являются хорошими примерами электролитов.
- 1 Что такое сильные и слабые электролиты?
- 2 различия
- 3 Методы идентификации электролитов
- 4 Примеры сильных и слабых электролитов
- 4.1 Сильные электролиты
- 4.2 Слабые электролиты
Какие сильные и слабые электролиты?
сильные электролиты те, которые полностью ионизируются - то есть, они на 100% отделены - в то время как слабые электролиты они ионизируют только частично. Этот процент ионизации обычно составляет от 1 до 10%.
Чтобы лучше дифференцировать эти два типа электролитов, можно сказать, что в растворе сильного электролита основными компонентами (или разновидностями) являются образующиеся ионы, тогда как в растворе слабого электролита основным компонентом является само соединение. ионизировать.
Сильные электролиты делятся на три категории: сильные кислоты, сильные основания и соли; в то время как слабые электролиты делятся на слабые кислоты и слабые основания.
Все ионные соединения являются сильными электролитами, поскольку при растворении в воде они разделяются на ионы..
Даже самые нерастворимые ионные соединения (AgCl, PbSO4, CaCO3) являются сильными электролитами, потому что небольшое количество, которое растворяется в воде, происходит главным образом в форме ионов; то есть в полученном растворе отсутствует диссоциированная форма или количество соединения.
Эквивалентная проводимость электролитов уменьшается при более высоких температурах, но ведет себя по-разному в зависимости от их прочности.
Сильные электролиты имеют более низкое снижение своей проводимости при более высоких концентрациях, в то время как слабые электролиты имеют большую скорость снижения проводимости при более высоких концентрациях.
различия
Важно знать, как распознать формулу и определить ее классификацию (ионная или составная), поскольку это будет зависеть от стандартов безопасности при работе с химическими веществами..
Как указывалось ранее, электролиты могут быть определены как сильные или слабые в зависимости от их ионизационной способности, но иногда это может быть более очевидным, чем кажется.
Большинство кислот, оснований и растворимых солей, которые не представляют кислоты или слабые основания, считаются слабыми электролитами..
Фактически, следует предположить, что все соли являются сильными электролитами. Напротив, слабые кислоты и основания, помимо азотсодержащих соединений, считаются слабыми электролитами..
Методы выявления электролитов
Существуют методы, облегчающие идентификацию электролитов. Далее используется шестиступенчатый метод:
- Является ли ваш электролит одной из семи сильных кислот??
- Это в металлической форме (ОН)N? Тогда это сильная база.
- Это в металлической форме (X)N? Тогда это соль.
- Ваша формула начинается с H? Тогда это, вероятно, слабая кислота.
- Есть ли у него атом азота? Тогда это может быть слабой базой.
- Ничто из перечисленного не применимо? Тогда это не электролит.
Кроме того, если реакция, представленная электролитом, выглядит следующим образом: NaCl (s) → Na + (ac) + Cl - (ac), в которой реакция ограничена прямой реакцией (→), речь идет о сильном электролите. Если он ограничен косвенным (↔), это слабый электролит.
Как указано в предыдущем разделе, проводимость электролита изменяется в зависимости от его концентрации в растворе, но также это значение зависит от силы электролита..
При более высоких концентрациях сильные и промежуточные электролиты не будут уменьшаться в значительных интервалах, но слабые будут сильно уменьшаться до достижения значений, близких к нулю при более высоких концентрациях..
Существуют также промежуточные электролиты, которые могут диссоциировать в растворах с более высоким процентным содержанием (менее 100%, но более 10%), в дополнение к неэлектролитам, которые просто не диссоциируют (соединения углерода, такие как сахара, жиры и спирты)..
Читайте также:

