Как сделать скошенный агар
Добавил пользователь Евгений Кузнецов Обновлено: 05.10.2024
Методика пересева из колоний на скошенный агар и МПБ
а) Пересев из колоний на скошенный агар
Приоткрывают крышку чашки, прокаленной остуженной петлей снимают часть отдельной колонии, открывают пробирку со стерильным скошенным агаром, держа ее в левой руке в наклонном положении, так, чтобы можно было наблюдать поверхность среды. Переносят петлю с культурой в пробирку, не прикасаясь к стенкам, растирают по питательной среде, скользя по поверхности от одного края пробирки к другому, поднимая штрихи до верхушки среды – посев штрихом. Пробирку закрывают и, не выпуская из рук, подписывают название посеянного микроба и дату посева.
б) Пересев из колонии на мясо-пептонный бульон
Техника пересева на МПБ в основном такая же, как и при посеве на плотную среду. При посеве на МПБ петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенку сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый стерильной пастеровской или градуированной пипеткой, вливают в питательную среду.
Методические указания к практической работе
Выделение отдельных видов бактерий из исследуемого материала является одним из этапов любого бактериологического исследования.
Обычно для выделения чистой культуры затрачивают 3-4 дня, но в некоторых случаях это время удлиняется, например, для выделения туберкулезных бактерий нужно 4-6 недель.
Первый этап
Посев исследуемого материала. Прокаленной остуженной петлей берут материал из пробирки (задача №. ) и распределяют по поверхности среды петлей, нанося параллельные штрихи на расстоянии 0,4-0,6 см один от другого, от одного края чашки к другому, держа петлю плашмя, чтобы не поцарапать питательную среду. Чашки подписывают (название материала, фамилия, дата посева) со стороны дна и помещают в термостат дном кверху, чтобы капельки конденсата, образующиеся на крышке, не стекали на среду и не размывали посевы.
Второй этап
Изучение колоний и выделение чистых культур. Через сутки на чашках вырастают колонии, причем на первом штрихе рост сплошной, а на следующих – изолированными колониями. Колония – это скопление микробов одного вида, выросших из одной клетки. Так как материал представляет собой чаще всего смесь микробов, то вырастает несколько видов колоний. Карандашом маркируют разные колонии, очерчивая их кружком со стороны дна, и изучают их. Прежде всего, изучают колонии невооруженным глазом: макроскопические признаки. Чашку просматривают (не открывая ее) со стороны дна в проходящем свете, отмечают прозрачность колоний (прозрачная, если не задерживает свет; полупрозрачная, если частично задерживает свет; непрозрачная, если свет через колонию не проходит), измеряют (в мм) размер колоний. Затем изучают колонии со стороны крышки, отмечают форму (правильная круглая, неправильная, плоская, выпуклая), характер поверхности (гладкая, блестящая, тусклая, шероховатая, морщинистая, влажная, сухая, слизистая), цвет (бесцветная, окрашенная).
Техника посевов микроорганизмов на питательные среды

Для работы с микроорганизмами используют специальные бактериологические петли, иглы, шпатели, пипетки. Посевы всегда проводят около пламени горелки. Около работающего с чистой культурой нельзя делать резких движений, ходить, кашлять и т.п., так как движение воздуха увеличивает опасность попадания посторонних микроорганизмов в пробирку с культурой. Поэтому посевы и пересевы микроорганизмов рекомендуется проводить в боксе.
Рис. 19. Правила разливания питательной среды в чашки Петри
Посев в жидкую питательную среду. Посев производят петлей или градуированной пипеткой. Посевной материал бактериологической петлей осторожно вносят в пробирку и легко встряхивают в верхнем слое питательной среды или растирают по стенке, смывая его жидкой средой.
Стерильную пипетку фламбируют (обжигают) в пламени горелки, опускают в пробирку с культурой, отбирают определенное количество материала и переносят его в пробирку со свежей питательной средой, выпуская жидкость по стенке пробирки, или вносят пипетку вглубь среды и выдувают содержащийся в ней материал.
Посев штрихом в пробирку со скошенным агаром (рис.22). Пробирку с культурой и пробирку со скошенным питательным агаром берут в левую руку и держат в наклонном положении. В правую руку берут бактериологическую иглу и прокаливают ее в пламени спиртовки до покраснения, затем проносят сквозь пламя иглодержатель. Мизинцем правой руки вынимают пробки из обеих пробирок, обжигают края пробирок. Петлю вводят в пробирку с культурой, охлаждают ее о края пробирки и осторожно снимают небольшое количество микробной культуры. Петлю с посевным материалом быстро переносят в пробирку со стерильной средой и опускают почти до дна, где скапливается небольшое количество конденсационной влаги. Слегка касаясь агара, проводят зигзагообразную линию, при этом петлю не отрывают от поверхности питательной среды. После посева петлю вынимают из пробирки и обжигают вместе с остатками посевного материала.


Рис. 24. Посев на агар в чашки Петри шпателем Дригальского
Глубинный посев в чашку Петри. Определенное количество подготовленного к посеву исследуемого материала (1,0 или 0,1 см 3 ) вносят пипеткой в пустую чашку Петри. Из пробирки или колбы с расплавленной и остуженной до 45 °С питательной средой вынимают пробку, обжигают края в пламени горелки и, слегка приоткрыв крышку, выливают на дно чашки.
Пробирки и чашки с посевами помещают в термостат с температурой, оптимальной для конкретного микроорганизма. Как правило, мезофильные бактерии выращивают при температуре 37±1 °С, термофильные бактерии – при 40–55 °С, дрожжи и плесени – при 30±1 °С.
Культивирование и рост микроорганизмов
Выращивание микроорганизмов на питательных средах называется культивированием, а развившиеся в таких средах микроорганизмы – культурой. При культивировании происходит рост культуры – физиологический процесс, в результате которого увеличивается биомасса – масса клеточного вещества данного микроорганизма.
Чистой культурой микроорганизма называют культуру, которая представлена потомством одной клетки. Естественным путем получить чистую культуру почти невозможно, поэтому ее получают искусственно. Для выделения чистой культуры используют плотные питательные среды, на которых каждая клетка вырастает в виде изолированной колонии – популяции микроорганизмов одного вида.
Перед выделением чистой культуры из какого-либо пищевого продукта или природного субстрата (например: почвы, воды), в котором данный микроорганизм находится в небольших количествах, вначале получают накопительные культуры, проводя культивирование в элективных условиях.
Накопительные культуры состоят преимущественно из клеток микроорганизмов одного вида. Элективные (накопительные) условия – условия, способствующие развитию одной культуры и ограничивающие развитие сопутствующих микроорганизмов. Создать накопительные условия можно путем использования накопительных сред. Примером элективных условий может быть повышенная температура (для выделения термоустойчивых форм бактерий), повышенная кислотность, повышенная концентрация соли и т.д.
Инкубация – культивирование микроорганизмов при определенной температуре.
Хранят чистые культуры обычно на плотных питательных средах в пробирках. При этом постоянно необходимо делать пересевы на свежую питательную среду.
К другим способам хранения чистых культур относятся сохранение их на накопительной среде под слоем вазелинового масла и хранение в лиофилизованном состоянии (сушка под вакуумом замороженных клеток микроорганизмов).
В пищевой промышленности применяют чистые культуры дрожжей, молочнокислых, уксуснокислых, пропионовокислых бактерий, обладающих ценными свойствами для производства. В последнее время находят успешное применение многокомпонентные чистые культуры, состоящие из двух и более видов микроорганизмов.
Работа по получению и поддержанию чистых культур промышленных микроорганизмов осуществляется в научно-исследовательских лабораториях. Там они выделяются из различных субстратов, изучаются, и наиболее продуктивные, пригодные для производства, хранятся в коллекции музея чистых культур, откуда рассылаются отраслевыми научно-исследовательскими институтами на предприятия. В заводской лаборатории микробиолог подготавливает культуру для производственного цикла, проверяет ее биологическую чистоту, активность.
Способ культивирования зависит от конечной цели культивирования (целью является либо накопление биомассы, либо получение определенного продукта жизнедеятельности – метаболита).
Поверхностное культивирование заключается в выращивании аэробных микроорганизмов на поверхности жидких и сыпучих питательных сред. При этом микроорганизмы получают кислород непосредственно из воздуха. При поверхностном культивировании на жидких средах микроорганизмы растут в виде пленок. Осуществляется поверхностное культивирование в специальных ваннах – кюветах.
Глубинное культивирование проводится на жидких питательных средах, в которых микроорганизмы развиваются во всем объеме питательной среды. Сочетание питательной среды и растущих в ней микроорганизмов называют культуральной жидкостью. Осуществляется глубинное культивирование в специальных аппаратах – ферментаторах, снабженных мешалками и системой подвода стерильного воздуха для обеспечения роста аэробных микроорганизмов. Аэрирование – продувание стерильного воздуха через культуральную жидкость.
При периодическом культивировании весь объем питательной среды засевают чистой культурой, которую выращивают в оптимальных условиях определенный период времени до накопления нужного количества целевого продукта. Следует отметить, что, так как культивирование ведется на невозобновляемой питательной среде (в стационарных условиях), то клетки все время находятся в меняющихся условиях. Таким образом, периодическую систему можно рассматривать как замкнутую систему.
При непрерывном культивировании культура находится в специальном аппарате, куда постоянно притекает питательная среда и откуда с такой же скоростью отводится культуральная жидкость. Для микроорганизма создаются неизменные условия среды, поэтому непрерывную систему можно рассматривать как открытую систему.
Поверхностное культивирование может быть только периодическим, в то время как глубинное культивирование может осуществляться и периодическим, и непрерывным способом.
При периодическом способе культивирования популяция микроорганизмов проходит 7 стадий (фаз) роста (рис. 25).
1 2 3 4 5 6 7
Рис. 25 Кривая роста статической культуры:
N – концентрация жизнеспособных клеток;
τ – продолжительность культивирования
1. Лагфаза. В этот период культура адаптируется к новой среде обитания. Активизируются ферментные системы, возрастает количество нуклеиновых кислот, клетка готовится к интенсивному синтезу белков и других соединений. Клетки не размножаются (скорость размножения равна нулю). Концентрация живых клеток постоянна и равна количеству внесенных клеток. Продолжительность этой фазы зависит от физиологических особенностей микроорганизма и от состава питательной среды.
2. Фаза ускорения роста. Эта фаза характеризуется началом деления клеток, увеличением общей массы и постоянным увеличением скорости роста культуры. Эта фаза обычно непродолжительна.
3. Экспоненциальная (логарифмическая) фаза роста. В этот период микроорганизмы размножаются с постоянной максимальной скоростью. При этом логарифм числа клеток линейно зависит от времени. К концу этой фазы среда истощается вследствие катаболических и анаболических процессов, в среде накапливаются продукты жизнедеятельности микроорганизмов. Возникает и пространственная ограниченность, так как клетки мешают друг другу.
4. Фаза замедления роста. В этот период снижается скорость роста, небольшая часть клеток гибнет. Скорость роста выше скорости отмирания.
5. Стационарная фаза. Количество живых клеток достигает максимума. Скорость роста равна скорости отмирания клеток, поэтому концентрация жизнеспособных клеток остается постоянной.
6. Фаза ускорения отмирания. Количество отмерших клеток (скорость отмирания) становится больше количества образовавшихся клеток.
7. Фаза отмирания. Масса живых клеток значительно уменьшается, так как в среде нет питательных веществ, а запасные вещества клетки исчерпываются.
При непрерывном способе культивирования культура поддерживается в какой-то фазе роста.
Если цель культивирования – получение биомассы продуцента, процесс целесообразно вести в режиме логарифмической фазы, когда микроорганизм способен обеспечить максимальную скорость роста популяции.
Для поддержания культуры в логарифмической фазе культивирование микробной популяции проводят в условиях хемостата или турбидостата.
Рост в хемостате. Хемостат состоит из сосуда, в который вводят с постоянной скоростью питательный раствор. По мере поступления питательного раствора из него вытекает суспензия микроорганизмов с той же скоростью. При культивировании в условиях хемостата поддерживается постоянная концентрация одного из компонентов среды (например, углерода). Благодаря этому в условиях хемостата поддерживается постоянная скорость роста культуры. Культура микроорганизма находится в условиях динамического равновесия.
Рост в турбидостате. Работа турбидостата основана на поддержании постоянной концентрации живых клеток. В сосуде для культивирования все питательные вещества содержатся в избытке, а скорость роста бактерий приближается к максимальной.
Если же целью культивирования является получение метаболита (например, этилового спирта), выход которого в среду обитания не соответствует логарифмической фазе роста, применяется способ непрерывного выращивания в двух или нескольких последовательно соединенных аппаратах, что позволяет как бы расчленить процесс на несколько стадий.
1)Препараты для микроскопического исследования готовят на чистых предметных стеклах, обезжиривая их поверхность мылом с последующим его удалением сухой негигроскопичной ватой. Наносят на обезжиренную поверхность стекла каплю воды (на хорошо обезжиренном стекле капля растекается).
2) Бактериальную петлю стерилизуют прокаливанием докрасна в пламени горелки. Стерильную петлю используют для взятия микробной массы, держа ее в правой руке, как карандаш. Пробирку или колбу с питательной средой берут в левую руку так, чтобы поверхность с ростом культуры была обращена вверх, вынимают пробку из сосуда мизинцем правой руки, прижимая ее к ладони. Края сосуда обжигают в пламени горелки, вводят в него прокаленную петлю, прикасаясь ею к внутренней поверхности сосуда или к питательной среде, свободной от роста микроорганизмов, с целью охлаждения петли. Захватывают небольшое количество микробной массы, равномерно эмульгируя ее в капле воды в виде кружка или овала диаметром около 1 см. Снова обжигают края сосуда и закрывают его. Петлю стерилизуют.
3) Высушенный мазок в целях умерщвления микробных клеток и прикрепления их к стеклу фиксируют. Обычно применяют физический метод - фиксацию мазка над пламенем горелки или спиртовки троекратно (по 1 сек) мазком вверх. Ни в коем случае стекло не следует перегревать и не подвергать фиксации влажный мазок. Это приводит к деформации и резкому уменьшению размеров и без того мелкого объекта исследования. Химический метод фиксации более щадящий. Используют этанол (10—15 мин), ацетон (5 мин), смесь Никифорова (смесь равных объемов этанола и эфира—10— 15 мин), метанол (3 мин), пары осмиевой кислоты, формалин (несколько секунд).
29. Споры и капсулы у бактерий: образование, значение, методы изучения
Капсула. Капсула бактерий – это утолщенный наружний слой клеточной
стенки. Капсулы могут быть построены из полисахаридов ( пневмококк) или белков
(возбудитель сибирской язвы ). Большинство бактерий , особенно патогенных,
образуют капсулу только в организме человека или животных. Однако , существует
род истинно капсульных бактерий (Klebsiella), представители которого образуют
капсулу и при культивировании на искусственно питательных средах. Некоторые
бактерии могут иметь микрокапсулу, например, эшерихии, или неявно выраженную
способность к капсулообразованию – так называемую « нежную « капсулу, напимер
золотистые стафилококки, менингококки.
Функции капсулы:
- место локализации капсульных антигенов, определяющих вирулентность, антигенную специфичность и иммуногенность бактерий;
- защита клеток от механических повреждений, высыхания, токсических веществ, заражения фагами, действия защитных факторов макроорганизма;
- способность прикрепления клеток к субстрату.
Выявление капсулы по методу Гинса:
1. На предметное стекло наносят каплю туши, а рядом – каплю исследуемого материала. Обе капли тщательно перемешивают и с помощью шлифованного стекла готовят мазок.
2. Мазок высушивают на воздухе и фиксируют на пламени горелки.
3. Мазок окрашивают фуксином в разведении 1:3 или сафранином. При этом бактерии окрашиваются в красный цвет, капсулы остаются неокрашенными и выделяются на темном фоне препарата.
Окраска капсулы по Романовскому-Гимзе происходит по следующей технологии:
1.На предметное стекло наносится мазок разведенной чистой культуры.
2.Стекло устанавливается мазком вниз в чашку Петри на стеклянные подставки.
3.В чашку Петри добавляют 20 капель краски Романовского-Гимзе.
4. Через 15-20 минут предметное стекло промывают и высушивают.
В результате бактерии окрашиваются в темно-синий цвет, а капсулы приобретают розовую окраску.
Споры бактерий. Споры бактерий представляют собой бактериальные клетки
в состоянии анабиоза и образуются при неблагоприятных условиях внешней среды.
Располагаться могут внутри клетки терминально , субтерминально или центрально.
В процессе спорообразования клетка почти полностью теряет воду,
смарщивается, клеточная стенка уплотняется, появляется новое вещество дипиколинат
кальция которое образует комплексы с биополимерами клетки, устойчивые к
действию температуры и ультрафиолетовых лучей. В окружающей среде споры
бактерий могут сохраняться годами, но при попадании в благоприятные условия спора
впитывает влагу, комплексы распадаются, дипиколинат разрушается и спора
превращается в вегетативную клетку.
Таким образом, спору следует рассматривать не как способ размножения
клетки(как это часто имеет место у грибов ), а только как способ существования
бактериальной клетки в неблагоприятных условиях. При этом надо запомнить – 1
Спорообразование характерно в основном для Гр(+) бактерий. У Гр(-)
эквивалентом спорообразования является переход в так называемое некультивируемое
состояние. В такой форме они могут длительно сохраняться в окружающей среде.
Окраска спор по методу Ожешки:
1. На нефиксированный мазок наносят 0,5% раствор хлористоводородной кислоты и подогревают на пламени горелки в течение 2-3 минут.
2. Кислоту сливают, препарат промывают водой, просушивают и фиксируют над пламенем горелки.
3. Окрашивают препарат по Цилю-Нильсену. Споры бактерий при этом приобретают красный цвет, а вегетативные формы – синий.
30. Инфекция, инфекционная болезни, носительство – написать определения. Особенности инфекционных болезней
Инфекция - Это реакции, которыми макроорганизм отвечает на внедрение микроорганизма. Они могут быть разнообразны и многочисленны. На одном полюсе реакции, которые не имеют клинических проявлений, образ жизни человека не меняется – внешних проявлений нет. А на другом полюсе – реакции, которые в
считанные часы, дни приводят к гибели человека, настолько они не совместимы.
Инфекционная болезнь (И.Б.) – клиническое проявление инфекции.
Особенности инфекционных болезней:
1) имеют своего возбудителя- это микробные агенты;
2) передается от больного к здоровому;
3) оставляют после себя более или менее выраженную
невосприимчивость к повторному заболеванию;
4) имеют общие клинические симптомы;
5) имеют строгое циклическое течение.
Носительство — одна из форм инфекционного (инвазионного) процесса, при которой паразитирование возбудителей заразных болезней в организме человека и животного протекает без клинических проявлений и сопровождается выделением возбудителя в окружающую среду.
31. Реакции с мечеными сыворотками ИФА по обнаружению антител.
Одними из широко используемых в настоящее время реакций иммунитета
являются реакции ИФА, в которых участвуют диагностические сыворотки, антитела
которых несут на себе ферментные метки.
Среди вариантов постановки ИФА чаще применяют твердофазный метод.
Известный компонент реакции (АГ или АТ) адсорбирован на полимерном носителе (лунке планшета). Как любая реакция иммунитета ИФА может быть использован для
обнаружения АТ – диагностическая реакция
В этом случае в лунках иммунологического планшета сорбирован известный АГ (к которому ищут АТ). На него наслаивается исследуемая сыворотка в разведениях. Если она содержит соответствующие АТ, то образуется комплекс АГ-АТ. Для его визуализации в лунку добавляется антиглобулиновая сыворотка (АГС), меченная ферментом. Образуется комплекс АГ-АТ-АГС, меченная ферментом. На заключительном этапе добавляется субстрат для фермента, которым помечена АГС. Антиглобулиновая сыворотка получается
путем иммунизации животных (чаще кроликов) γ-глобулинами человека. Реакция
фермент – субстрат проявляется изменением окраски.
Колония – это видимое невооруженным глазом изолированное скопление бактерий,являющееся потомством одной клетки на поверхности твердой питательной среды. Т.о., колония – это чистая культура бактерий.
Характеристика:
- Общую характеристику роста – однородный или неоднородный;
- Изучение выросших колоний – для этого отбирают по 1 колонии каждого типа,
обводят их со стороны дна чашки карандашом по стеклу, нумеруют и описывают по схеме:
1. Макроскопически (невооруженным глазом):
А) В проходящем свете
Для этого чашку Петри поднимают дном к себе так, чтобы свет проходил через толщу питательной среды. В проходящем свете описывают:
- Форму (правильная или неправильная);
- Величину (точечная – до 1 мм, мелкая – 1-2 мм, средняя 2-4 мм, крупная 4-6
- Прозрачность (прозрачная, полупрозрачная или непрозрачная).
Б) В отраженном свете
Чашку открывают для того, чтобы свет отражался от поверхности колоний. В
отраженном свете описывают:
- Высоту (плоская, плоско-выпуклая или выпуклая);
- Поверхность (гладкая, блестящая или матовая, шероховатая);
- Цвет (цвета среды – неокрашенная или пигментированная – окрашенная в
тот или иной цвет).
2. Микроскопически (при малом увеличении, сухой объектив)
Чашку помещают на столик микроскопа вверх дном. Микроскопически описывают:
- Края (ровные или неровные);
- Структуру (гомогенная - однородная, негомогенная - неоднородная,
№9
33. Органеллы движения у бактерий и методы их изучения. Пили бактерии и их функции
На поверхности ряда бактерий располагаются жгутики. В их состав
входит белок флагеллин, который по своей структуре относится к сократимым белкам
типа миозина.Поэтому жгутики обеспечивают подвижность бактерий. Количество и
расположение жгутиков у разных бактерий неодинаково Монотрихи – имеют на
одном из полюсов клетки только один жгутик, лофотрихи – пучок жгутиков ,у
амфитрихихов жгутики расположены на обеих полюсах клетки, а у перетрихов – про
Наличие жгутиков можно обнаружить при помощи внесения бактерий уколом в столбик полужидкого агара – подвижные растут по всей толще среды, неподвижные – по уколу.
Пили (ворсинки). Прямые нитевидные образования, обнаруженные у сальмонелл, эшерихий, протея, называют ворсинками, а также бахромками, фимбриями, ресничками, пилями (рис. 8). Пили тоньше жгутиков бактерий и короче их; состоят из особого белка пилина, мономеры которого, как и у жгутиков, расположены по спирали. Пили различаются по диаметру и длине; толщина пилёй может быть от 4—10 до 35 нм. Количество пил ей на одну бактериальную клетку может достигать нескольких сотен. Пили обеспечивают способность бактерий к прилипанию (адгезия) друг к другу или к субстрату, например к эпителиальным клеткам слизистой оболочки кишечника. Некоторые пили, например F-ворсинки, выполняют половые функции у бактерий. Они обеспечивают передачу наследственного материала (ДНК) из одной бактериальной клетки в другую, образуя мостик между двумя клетками. Эти ворсинки шире и длиннее остальных и на конце имеют шаровидное утолщение.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Агар-агар поборники здорового питания, с приходом моды на ЗОЖ, стали применять всё чаще и чаще. При этом, для большинства агар-агар по-прежнему – продукт редкий и неизвестный. Мы поговорили с экспертом – Гузелью Магдиевой, шеф-кондитером и выпускницей факультета биотехнологии Казанского Государственного Технологического университета и выяснили, что такое агар-агар, где его можно использовать и какая разница между ним и желатином в кулинарии.


Что такое агар-агар

Хлопья агар-агара
Агар-агар – смесь двух компонентов: углевода агарозы и смеси более мелких молекул, называемых агаропектином. Он образует поддерживающую структуру в клеточных стенках некоторых видов водорослей и выделяется при кипячении. Эти водоросли известны как агарофиты и принадлежат к типу Rhodophyta (красные водоросли).

Брикет из замороженого агар-агара, как готовят в Японии
С химической точки зрения агар-агар – это натуральный полимер, состоящий из галактозы, моносахаридного сахара.

Клюквенный мусс с агар-агаром, рецепт см. здесь
Откуда произошло название
В классификаторе пищевых добавок его относят к загустителям и называют E 406.

Сыроедческий чизкейк с зёрнами граната, для которого наполнитель приготовлен на агар-агаре, рецепт см. здесь
Когда впервые агар-агар обнаружили и стали использовать
Возможно, ага-агар был открыт в 1658 г. владельцем киотской гостиницы. Согласно легенде, японец обнаружил, что суп, приготовленный из морских водорослей и простоявший зимней ночью при заморозках, стал гелеобразным.
Впервые агар-агар подвергся химическому анализу в 1859 году французским химиком Ансельмом Пайеном, который выделил вещество из морских водорослей.

Пирожное Апельсиновая свечка на агар-агаре, рецепт см. здесь
Сейчас кто и где производит агар-агар
До Второй Мировой войны производство вещества было сосредоточено в Японии. После войны многие страны создали свою отечественную агаровую промышленность, чтобы продолжить микробиологические исследования. С тех пор производство агара колеблется из-за экономической нестабильности, а иногда и чрезмерного использования популяций морских водорослей.
Больше десятилетия тому назад в России были свои заводы по переработке водорослей: во Владивостоке, во Владимире и в Ольгинском районе Приморского края. Там производили продукт из собственного сырья – из нескольких разновидностей красных и бурых водорослей. В частности, некоторые из них произрастают в Чёрном, Белом, Охотском, Японском, Балтийском морях. Сейчас работают небольшие частные предприятия. Добычу водорослей ограничили – разрешается промысел в пределах тысячи тонн. Причём меньше половины идёт на внутренний рынок, всё остальное сырьё экспортируется.
Россия входит в топ-5 лидеров по потреблению агар-агара. Ежегодно потребителями покупается 1-1,3 тыс. тонн продукта. Из них примерно 1000 тонн приходят из-за границы. Основные поставщики – это Китай, Чили, Марокко, Италия и Испания.

Паштет из свеклы с горчицей и апельсином с агар-агаром, рецепт см. здесь
Какой агар-агар бывает
По качеству агар-агар бывает 3 сортов:
высший – от светло-кремового до тёмно-кремового, допускается слегка сероватый оттенок;
первый/второй – порошок от бежевого до светло-коричневого.
На агар-агар распространяется ГОСТ 16280-2002. Независимо от сорта агар-агар пищевой производится в виде крупки, гранул, порошка, пластинок, чешуек и плёнок. Вещество должно быть без постороннего запаха, без постороннего привкуса и наличия посторонних примесей. Также для всех сортов одинаковы температура плавления (не ниже 80 °С) и температура гелеобразования (не ниже 42 °С).
Разница есть в прочности геля. Конечно же агар-агар высшего сорта более стойкий – по сравнению с 1 сортом на 40%, а со 2 сортом –более, чем в 2 раза.
Ещё агар-агар бывает разной силы – от 600 до 1200 единиц. Чем выше сила геля, тем эффективней желирование, тем меньше агар-агара необходимо добавлять. 1 г агар-агара сила геля 900 равен 6 г желатина, а 1 г агар-агара сила геля 1200 равен 8 г желатина.

Заливное из сельдерея, моркови и спаржи на агар-агаре, рецепт см. здесь
Что нужно знать про сочетание агар-агара и кислой среды
Прежде чем развести агар-агар, учтите, что сила вещества зависит от рH продукта: его потребуется больше для более кислой среды. Aгар-агар используется в объеме 0,9% от массы конечного продукта и 1,3% для кислой среды, если используется клюквенный сок, сок лайма или ананасовый сок.

Заливное из форели и судака на агар-агаре, рецепт см. здесь
Как разводить агар-агар
Самое важное, что нужно знать при работе с агар-агаром: вещество необходимо сначала растворить в воде, а затем довести до кипения. Агар-агар застынет, когда масса остынет. Не нужно добавлять хлопья или порошок агар-агара в еду!
Перед использованием агар-агар необходимо замочить в холодной жидкости (вода, молоко, чай, сок овощной или фруктовый, бульон) примерно 15 мин., а затем, постоянно помешивая, прогреть 5 мин. для активации и полного растворения.
Чётко следуйте инструкциям на упаковке и выбранному рецепту, чтобы определить, какое количество агар-агара использовать. Вот основное правило, которое можно адаптировать под себя: используйте 1 ст. л. хлопьев агара на 200 мл жидкости и 1 ч. л. порошка агара-агара на 200 мл жидкости.

Коктейль-желе Клюква и водка с агар-агаром, рецепт см. здесь
Чем заменить агар-агар
Агар-агар можно заменить кукурузным крахмалом. Его используют в качестве загустителя в супах, карри, десертах и даже мороженом. Для замены хлопьев агар-агара используйте соотношение 2:1. Итак, 1 ст. л. хлопьев агар-агара равна эффекту 2 ст. л. кукурузного крахмала.
Если вы используете порошок, который мельче, чем хлопья, применяйте соотношение 1:1. Только не добавляйте крахмал непосредственно в блюдо, сначала разведите его холодной водой, чтобы не было комков. Для этого 0,5 ст. л. кукурузного крахмала разведите в 1 ст. л. воды.
Агар-агар также можно заменить аррорутом – безглютеновой крахмальной мукой из корневища маранта, тропического растения. Это тоже хороший загуститель, особенно в супах и прочих жидкостях. У этой муки есть огромный плюс при замене: аррорут не оставляет после себя затяжного послевкусия в густых и наваристых блюдах, а также сохраняет свою консистенцию и текстуру в замороженном виде, в отличие от кукурузного крахмала.
Как и кукурузный крахмал, тапиоковый крахмал, также известный как тапиоковая мука, используется в качестве загустителя и альтернативы агар-агару. Мука из тапиоки – крахмал, извлекаемый из корня маниоки. Не содержит глютена и отлично подходит для загущения супов, соусов и начинок.

Зефир из черной смородины на агар-агаре, рецепт см. здесь
Что лучше: агар-агар или желатин
Агар-агар можно использовать в качестве вегетарианской или веганской замены в любом рецепте, который требует желатина в качестве загустителя. Это соусы, десерты на основе желе, заварные кремы, пудинги, зефир и др.
Плюсы агар-агара
Есть и минусы
- Желе из агар-агара может разрушится при помешивании или тряске в процессе застывания. Агар имеет матовый цвет и, растворяясь в воде формирует желе, которое имеет более хрупкую и слоистую текстуру, нежели желе из желатина.
- Тает агар при 80-90 °С. Желе из агара не выдерживает заморозки и становится рассыпчатым.

Облепиховый мармелад на агар-агаре, рецепт см. здесь
Ага-агар: польза для здоровья и агаровая диета
Агар-агар не содержит калорий, углеводов, сахара, жира. В нём нет крахмала, сои, кукурузы, глютена, дрожжей, пшеницы, молока, яиц и консервантов.
Агар-агар поглощает глюкозу в желудке, быстро проходит через пищеварительную систему и не даёт организму удерживать и накапливать излишки жира. Его водопоглощающие свойства также способствуют удалению шлаков. Агар-агар поглощает желчь и тем самым заставляет организм растворять больше холестерина.
Агар-агар примерно на 80% состоит из пищевых волокон. Его свойства набирать объём лежат в основе модных азиатских диет, например, диеты кантен. Смысл диеты: после приёма внутрь агар-агар увеличивается в три раза и впитывает воду, в результате человек чувствуют себя сытыми. Эта диета также получила некоторое освещение в прессе США. Диета по мнению западных диетологов показывает себя многообещающей в лечении ожирения.
Агар-агар при японской диете может быть вреден, если его не запивать достаточным количеством воды. Он способен набухнуть и заблокировать пищевод или кишечник! У некоторых людей агар-агар может повышать уровень холестерина.
Не занимайтесь самолечением и проконсультируйтесь с врачом-диетологом перед началом японской диеты кантен!

Торт Птичье молоко простой на агар-агаре, рецепт см. здесь
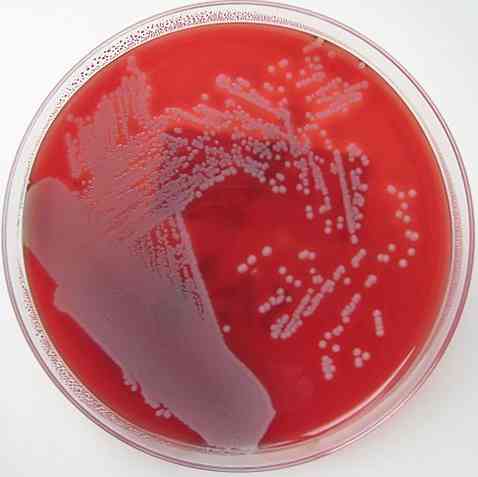
кровяной агар это обогащенная твердая среда, дифференциальная, но не селективная. Он используется для восстановления и роста большого разнообразия микроорганизмов из клинических образцов или субкультур..
Классический кровяной агар должен быть включен для посева большинства клинических образцов, полученных в лаборатории; за исключением образцов кала, где это бесполезно, если только они не подготовлены с определенными модификациями.
Эта культуральная среда в основном состоит из обогащенного базового агара и 5% крови. Основа агара может варьироваться в зависимости от потребностей, но в основном будет состоять из пептонов, аминокислот, витаминов, мясного экстракта, хлорида натрия, агара и других..
Что касается крови, обычно требуется контакт с биотерием для получения крови от животных, таких как овцы, кролики или лошади. Однако это не всегда возможно, и иногда используется человеческая кровь.
Среда с кровяным агаром может быть приготовлена в лаборатории или приобретена для компаний, которые ей посвящены. Приготовление этой среды является одним из самых деликатных, любая небрежность при ее приготовлении приведет к загрязнению партии.
Вот почему должны быть приняты все возможные меры предосторожности, и, в конце концов, должен быть проведен контроль качества инкубирования при 37 ° С на 1 чашку на каждые 100 приготовленных.
- 1 фундамент
- 2 использования
- 2.1 Выбор группы крови
- 2.2 Выбор типа базового агара
- 2.3 Использование кровяного агара в соответствии с базовой средой, использованной для его приготовления
- 3.1 Взвешивать и растворять
- 3.2 Стерилизовать
- 3.3 Агрегация крови
- 3.4 Разлить в чашки Петри
фундамент
![]()
Уже упоминалось, что кровяной агар обладает характеристикой обогащенной, дифференцированной и неселективной среды. Основание каждого из этих свойств объясняется ниже.
Кровяной агар является обогащенной средой, поскольку он содержит в качестве основной добавки 5-10% крови на основе агара. Оба соединения содержат много питательных веществ, и это свойство позволяет большинству пригодных для культивирования бактерий расти в нем..
Этот рост происходит без ограничений; по этой причине это неселективно. Однако, если в эту среду добавляются соединения, которые предотвращают рост некоторых микроорганизмов и способствуют росту других, он становится селективным. Это тот случай, если определенные типы антибиотиков или противогрибковых добавляются.
Точно так же кровяной агар является дифференциальной средой, поскольку он позволяет различать 3 типа бактерий: бета-гемолитические, альфа-гемолитические и гамма-гемолитические..
Бета-гемолитики - это те, которые обладают способностью лизировать или полностью разрушать эритроциты, образуя прозрачный ореол вокруг колоний, таким образом вызывая β или β гемолиз - гемолиз, а микроорганизмы называются β-гемолитическими..
Примерами ß-гемолитических бактерий являются Streptococcus pyogenes и Streptococcus agalactiae.
Альфа-гемолитики - это те, которые выполняют частичный гемолиз, где гемоглобин окисляется до метгемоглобина, создавая зеленоватую окраску вокруг колоний. Это явление известно как гемолиз α или α-гемолиз, а бактерии классифицируются как α-гемолитические..
Примером α-гемолитических бактерий являются Streptococcus pneumoniae и стрептококк группы viridans.
Наконец, существуют бактерии, называемые гамма-гемолитическими или негемолитическими. Они растут на агаре, не вызывая изменений на нем, эффект, известный как γ-гемолиз, а микроорганизмы являются γ-гемолитическими..
Пример γ-гемолитических бактерий: некоторые штаммы Streptococcus группы D (Streptococcus bovis и Enterococcus faecalis).
приложений
Культуральная среда с агаром крови является одной из наиболее часто используемых в лаборатории микробиологии..
Среди микроорганизмов, способных расти на агаризованной среде крови: строгие, факультативные, микроаэрофильные, анаэробные, грамположительные или грамотрицательные аэробные бактерии, быстрорастущие или медленнорастущие бактерии..
Некоторые бактерии, которые требуют или мешают с точки зрения питания, а также грибки и дрожжи, также растут. Аналогично, это полезно для субкультуры или реактивации штаммов, которые очень слабо метаболически.
Однако выбор типа крови и основного агара будет варьироваться в зависимости от вероятного микроорганизма, который подозревается в выздоровлении, и от использования бляшки (культура или антибиограмма)..
Выбор группы крови
Кровь может быть ягнёнком, кроликом, лошадью или человеком.
Наиболее рекомендуемой является кровь ягненка, за некоторыми исключениями. Например, для выделения видов Haemophilus, где рекомендуемой кровью является лошадь или кролик, поскольку в крови ягненка содержатся ферменты, которые ингибируют фактор V.
Наименее рекомендуемым является человек, однако он наиболее часто используется, возможно, потому, что его легче всего получить..
Кровь должна быть дефибринирована, получена без каких-либо добавок и от здоровых животных. Для использования человеческой крови необходимо учитывать несколько факторов:
Если кровь поступает от людей, перенесших бактериальные инфекции, у них будут специфические антитела. В этих условиях рост некоторых бактерий, вероятно, будет подавлен.
Если он получен из банка крови, он содержит цитрат, и возможно, что некоторые бактерии не развиваются в его присутствии. С другой стороны, если кровь поступает от пациентов, принимающих антибиотики, рост чувствительных бактерий может быть замедлен.
И если кровь от диабетика, избыток глюкозы мешает правильному развитию паттернов гемолиза..
Выбор типа базового агара
Базовый агар, используемый для приготовления кровяного агара, может быть очень широким. Среди них: питательный агар, агар для инфузии мозга, соевый агар с триптиказой, агар Müeller Hinton, агар Thayer Martin, агар Columbia, агар Brucella, агар Campylobacter и т. Д..
Использование кровяного агара в соответствии с базовой средой, используемой для его приготовления
Питательный агар
Эта база используется реже всего, потому что на ней будут расти в основном нетребовательные бактерии, такие как кишечные палочки, Pseudomonas sp, S. aureus, Bacillus sp., среди других. Не рекомендуется выделять стрептококк.
Инфузионный агар для сердца (BHI)
Он является одним из наиболее используемых в качестве основы кровяного агара, поскольку в нем содержатся необходимые питательные вещества для роста большинства бактерий, в том числе Streptococcus sp и другие требовательные бактерии. Хотя не следует соблюдать закономерности гемолиза.
Кровь ягненка обычно используется с этой основой.
Также могут быть приготовлены варианты с кровяным агаром, где добавляются другие соединения для выделения определенных микроорганизмов. Например, инфузионный агар мозга с добавлением кроличьей крови, цистина и глюкозы служит для выделения Francisella tularensis.
Принимая во внимание, что с цистином теллурит полезен для выделения Corynebacterium diphteriae. Вы можете использовать кровь человека или ягненка.
В первом случае бета-гемолиз будет выглядеть как узкое гало, а во втором гало будет гораздо шире.
Аналогично, эта основа вместе с бацитрацином, кукурузным крахмалом, лошадиной кровью и другими добавками для обогащения (IsoVitaleX), используется для выделения рода Haemophilus sp из дыхательных проб.
Кроме того, если вы добавляете комбинацию антибиотиков хлорамфеникол - гентамицин или пенициллин - стрептомицин с лошадиной кровью, это идеально подходит для выделения требовательных патогенных грибов, даже с более высоким выходом, чем глюкозный агар Сабура. Это особенно полезно в изоляции Histoplasma capsulatum.
Триптивная соя
Эта база является наиболее рекомендуемой для лучшего наблюдения за характером гемолиза и выполнения диагностических тестов, таких как таксоны оптохина и бацитрацина. Это классический кровяной агар, который обычно используется.
С помощью этой базы вы также можете приготовить специальный кровяной агар для Corynebacterium diphteriae, с теллур цистином и кровь ягненка.
Аналогично, комбинация этого агара с кровью ягненка плюс канамицин-ванкомицин идеальна для роста анаэробов, особенно Bacteroides sp.
Агар Мюллер Хинтон
Эта основа с добавлением крови используется для выполнения антибиограммы требовательных микроорганизмов, таких как Streptococcus sp.
Это также полезно для выделения таких бактерий, как Legionella pneumophila.
Агар Тайер Мартин
Эта среда идеально подходит в качестве основы для кровяного агара, когда подозревается род Neisseria, особенно Neisseria meningitidis, в качестве N. gonorrhoeae не растет на кровяном агаре.
Он также служит для проведения тестов на чувствительность к Neisseria meningitidis.
Агар Колумбия
Эта база отлично подходит для посева образцов желудочной биопсии в поисках Helicobacter pylori.
Среду готовят путем добавления 7% крови ягненка, дефибринированной антибиотиками (ванкомицин, триметоприм, амфотерицин В и цефсулодин), чтобы ограничить рост других типов бактерий, которые могут присутствовать.
Эта же основа с добавлением крови человека или ягненка, налидиксовой кислоты и колистина полезна для выделения Gardnerella vaginalis. Он также идеально подходит для оценки чувствительности к антимикробным препаратам к антибиотикам того же микроорганизма..
Кроме того, он используется для приготовления кровяного агара для выращивания анаэробов, добавления аминогликозидов и ванкомицина.
Эта база позволяет нам правильно наблюдать закономерности гемолиза.
Бруцелла Агар
Эта среда, используемая в качестве основы кровяного агара вместе с добавлением витамина К, идеально подходит для выращивания анаэробных бактерий. В этом случае рекомендуется использовать кровь ягненка.
Кампилобактер агар
Агар Кампилобактер, дополненный 5% овечьей крови и 5 антибиотиками (цефалотин, амфотерицин В, триметоприм, полимиксин В и ванкомицин), является средой, используемой для выделения Campylobacter jejuni в образцах стула.
подготовка
Каждый коммерческий дом несет на обратной стороне упаковки инструкции по приготовлению литра питательной среды. Соответствующие расчеты могут быть сделаны для приготовления желаемого количества, в соответствии с выбранным базовым агаром.
Взвесьте и растворите
Базовый агар поставляется обезвоженным (порошок), поэтому его необходимо растворить в дистиллированной воде, доведенной до pH 7,3.
Количество, указанное выбранным базовым агаром, взвешивают и растворяют в соответствующем количестве воды в фиоле, затем нагревают до умеренного нагрева и перемешивают вращательными движениями до тех пор, пока весь порошок не растворится..
стерилизовать
После растворения стерилизовать в автоклаве при 121 ° С в течение 20 минут..
Агрегат крови
Покидая автоклав, дайте фиоле остыть, пока температура не будет колебаться между 40 и 50 ° C; температура, которую поддерживает человеческая кожа, и в то же время агар еще не затвердел.
Для этого к фиолле прикасаются рукой, и если тепло терпимо, это идеальная температура для добавления соответствующего количества дефибринированной крови (50 мл на литр агара). Аккуратно перемешать до гомогенизации.
Прохождение скопления крови имеет решающее значение, потому что, если это происходит, когда среда очень горячая, красные кровяные клетки будут разрушаться, и среда не будет служить для наблюдения гемолиза..
Если его добавить слишком холодным, образуются комочки, и поверхность среды не будет гладкой, чтобы сделать флейту правильно.
Разлить в чашки Петри
Подавать в стерильных чашках Петри сразу после гомогенизации крови. Приблизительно 20 мл наливают в каждую чашку Петри. Эта процедура выполняется в вытяжном шкафу или рядом с горелкой..
При подаче кровяного агара в чашки Петри на поверхности тарелки не должно оставаться пузырьков воздуха. Если это происходит, пламя горелки Бунзена быстро проходит над пластиной, чтобы устранить их..
Пластинам дают затвердеть и хранят в холодильнике (2-8 ° С) в перевернутом виде до использования. Перед использованием кровяного агара пластины следует закалить (дать им принять комнатную температуру) для посева.
Читайте также: