Как сделать схему металлической связи
Добавил пользователь Владимир З. Обновлено: 04.10.2024
В этом уроке мы рассмотрим образование химической связи между атомами. Почему для некоторых атомов свойственно многообразие соединений, а другие входят в состав не большого количества соединений. Каким образом, соединяются атомы между собою? Чтобы ответить на этот вопрос, необходимо освежить в памяти понятия электроотрицательность (ЭО), валентность и степень окисления (СО).
План урока:
Словно компоненты конструктора, атомы соединяются между собой. И как бы, Вы не старались, но с единичным блоком можно соединить, только один блок. Деталь на 4 ячейки, может удержать не больше четырёх. Этот принцип сохраняется и в химии. За количество свободных ячеек отвечает валентность атомов элементов.
Результатом взаимодействия атомов является получение веществ. Виды химической связи атомов зависят от природы составляющих элементов.
Веществ насчитывается миллионы. Это могут быть простые вещества: металлы железо Fe, золото Au, ртуть Hg; неметаллы сера S, фосфор Р, азот N2. Так и сложные вещества: H2S, Ca3(PO4)2, (C6H10O5)n, молекулы белков и т.д.Комбинация элементов, входящих в состав веществ, определяет какие типы связей будут существовать между ними.
Ковалентная связь
Неметаллы из числа всех элементов находятся в меньшинстве. Но имея некоторые особенности в строении и способности иметь переменную валентность, число соединений, построенных этими элементами внушительное.
Чтобы иметь представление, по которому атомы соединяются, начнём с молекулы водорода Н2.
Давайте дадим волю фантазии, представим то, что нельзя увидеть. Допустим, что мы взяли в руки две одинаковые детали, имеющие такой вид:
Существует одна только комбинация их соединения, и между ними будет одно общее звено. Переместимся с нашего воображения к молекулам. Представим, что перед нами, два атома водорода и наша задача их соединить в молекулу. Покрутите мысленно детали, чтобы они объединились, необходимо их поставить друг на друга, связав их в определённом месте. Точки рядом означают, сколько электронов, располагающихся на наружном слое.
Атомы водорода, как детали, соединились одной связью, поэтому валентность в данном случае каждого из них будет равна I. Но степень окисления будет равна 0, так как вещество образовано элементом с одинаковым значением электроотрицательности.
Рассмотрим, как образуется молекула самого распространённого газа на нашей планете – азота N2.
Азот, имеет 3 неспаренных электрона. Это как взять две детали вида и соединить их.
Таким образом, азот трёхвалентен, а степень
окисления по-прежнему остаётся равна 0. За счёт общей электронной пары азот завершает внешний слой 2s 2 2p 6 .
Ковалентная связь в молекуле, состоящей из одного типа атомов, а именно неметаллов, носит название неполярная.
Во время построения молекулы, количество электронов стремится к завершению. Рассмотрим как образуется молекула О2. Каждому атому не хватает 2 электронов и они эту недостачу компенсируют общей электронной парой.
Также обращаем внимание, что степень окисления 0, ибо атомы равноправные партнёры, и их валентность равна II.
Ковалентная химическая связь образованная разными неметаллами называется полярная.
Возьмём два неметаллических элемента Водород и Хлор. Укажем электронные формулы внешнего слоя.
Проанализировав значения, Э(Н) + Cl − .
Такой вид образования соединений происходит по обменному механизму. Это значит, чтобы получить завершённую конфигурацию более электроотрицательные принимают электроны, менее – отдают, но при этом существует общая электронная пара.
Неметаллы образуют не только бинарные соединения, а возможно в состав будет входить три и более элемента. К примеру, молекула угольной кислоты H2СO3 состоит с 3 элементов. Как они между собой соединяться. Электроотрицательность возрастает в ряду ЭО (Н) + 2С +4 О −2 3. Это означает, что кислород будет притягивать на себя электроны углерода и водорода. Схематически это можно записать в следующем виде.
Чтобы построить структурную формулу, в центре записываем углерод. У него неспаренных 4 электрона. Поскольку атомов кислорода в количестве 3, каждый из них может принять 2 электрона. То путём не хитрых вычислений, видим что 4 электрона придёт от С и по одному от каждого Н. проверяем наш расчёт, учитывая нейтральность молекулы, считаем положительные и отрицательные заряды.
Н2 + С +4 О3 −2 (+1 ∙ 2) + (+4 ∙ 1) + (-2 ∙ 3) = 0
Существует ещё один механизм ковалентной связи, под названием донорно-акцепторный.
Чтобы понять этот принцип, опишем образование молекулы, имеющей не совсем приятный резкий, удушающий запах, аммиак NH3.
Ионная связь
Ионная химическая связь является пограничной ковалентной полярной. Отличаются тем, что для веществ, в которых локализуется ковалентная связь, характерно существование совместной электронной пары, тогда как для ионной связи свойственна полная отдача электронов. Следствием отдачи является образование заряженных частиц – ионов.
Определить тип связи помогут вычисления. Если разность значений электроотрицательностей больше 1,7, то для вещества характерна ионная связь. Если значение меньше 1,7, то свойственная полярная связь. Рассмотрим два вещества NaCl и СаС2. Оба они образованы металлом (Na и Са) и неметаллом (Clи С). Однако в одном случае связь будет ионная, во втором – ковалентная полярная.
Постулат физики гласит, что противоположности притягиваются. Т.е. положительные ионы притягивают отрицательные и наоборот.
Допустим, что необходимо получить вещество с атомов калия и фтора. Каждый атом стремится заполучить конфигурацию благородного газа. Достигнуть этого возможно двумя способами отдав или приняв электроны, образуя при этом ионы с желаемой конфигурацией.
Атому калия гораздо проще отдать 1 электрон, чем забрать у фтора 7. Принимая 1 электрон, F имеет завершённый уровень.
Аналогично калий, который с лёгкостью отдал свой электрон, его катион принял электронную формулу аргона.
Кальций двухвалентный металл, то для взаимодействия необходимо два атома фтора, поскольку он способен принять только один электрон. Схема образования ионной связи имеет вид.
Данный вид связи локализуется во всех солях, между металлом и кислотным остатком. В выше приведённом примере для угольной кислоты, кислотным остатком будет СО3 2− , если вместо водорода поставить атомы натрия, то схема образования связи имеет вид.
Следует отметить, что ионная связь будет существовать между Naи О, а между С и О ковалентная полярная.
Металлическая связь
Металлы существуют в разных цветах: чёрные (железо), красные (медь), жёлтые (золото), серые (серебро), плавятся при разных температурах. Однако их всех объединяет наличие блеска, твёрдости, электропроводимости.
Металлическая связь имеет черты сходства с ковалентной неполярной. Металлы бедны электронами на внешнем уровне, поэтому при образовании связи, они не способны притягивать на себя их, для них свойственна отдача. Так как атомный радиус в металлах большой, это даёт возможность легко оторваться электронам, образовав катионы.
Электроны постоянно перемещаются от атома к иону и наоборот. Сами катионы можно сравнить с айсбергами, окружёнными отрицательными частицами.
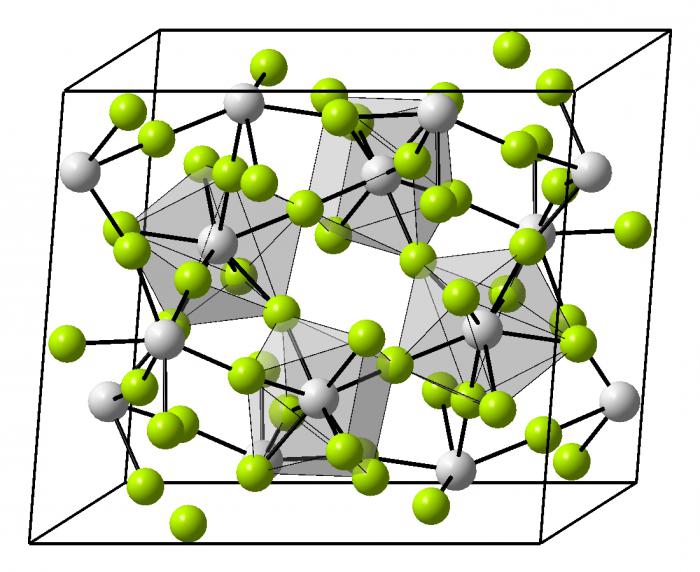
Схема металлической связи
Водородная связь
Элементы-неметаллы II периода (N, O, F) обладают высоким значением электроотрицательности. Это влияет на способность образования водородной связи между поляризованным Н + одной молекулы и анионом N 3- , O -2 , F - . Водородная связь способна объединить две разные молекулы. К примеру, если взять две молекулы воды, то они соединяются между собой за счёт атомов Н и О.
Водородная химическая связь изображена …… пунктиром. Соединяясь между собою молекулы, играют и находят важную роль в живых организмах. С помощью водородной связи строится вторичная структура молекулы ДНК.
Типы кристаллических решёток
Представьте перед собой геометрическую фигуру – куб, в вершинах будут находиться частицы, условно соединённые между собою.
Существует прямая зависимость между строением атома и типом кристаллической решётки.
Обратите внимание, что соединения с ковалентной неполярной связью образованные частицами-молекулами, которые запакованы в молекулярную кристаллическую решётку. Чаще всего это будут соединения по температурному режиму низкокипящие и летучие. Это известные вам вещества как кислород О2, хлор Cl2, бром Br2.
Ковалентная полярная химическая связь также характерна для молекулярных соединений. Сюда входят как органические: сахароза, спирты, метан так и неорганические соединения: кислоты, аммиак, оксиды неметаллов. Существование их бывает как в жидком (Н2О), твёрдом (сера) так и газообразном виде (СО2).
В узлах атомной кристаллической решётки находятся отдельные атомы, между которыми существует ковалентная неполярная связь. Атомная кристаллическая решётка свойственна алмазу. На данный момент это самое твёрдое вещество. Данный тип связи характерен для вещества, покрывающего значительную часть нашей планеты, это –SiO2 (песок) и карборунд SiC, имеющий похожие свойства с алмазом.
Ионная связь между атомами образует кристаллическую решётку, в узлах которой будут находиться катионы и анионы. Это строение объединяет между собой целый класс неорганических соединений солей, состоящих с катионов металлов и анионов кислотного остатка. Характерными особенностями этих веществ будут высокие температуры, при которых они плавятся и кипят.
Металлическая связь имеет металлическую кристаллическую решётку. В её строении можно провести параллель с ионной решёткой. В узлах будут размещаться атомы и ионы, а между ними электронный газ, состоящий из мигрирующих электронов от атома к электрону.
Обобщая данные сведения, можем сделать вывод, зная состав и строение, можем прогнозировать свойства и наоборот.
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.

Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала:этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
\u0430\u0442\u043e\u043c\u044b \u00a0 \u00a0 \u00a0 \u00a0 \u00a0 \u00a0 \u0438\u043e\u043d\u044b
\u043c\u0435\u0442\u0430\u043b\u043b\u0430 \u00a0 \u00a0 \u00a0 \u00a0 \u00a0\u043c\u0435\u0442\u0430\u043b\u043b\u0430
(e=\u044d\u043b\u0435\u043a\u0442\u0440\u043e\u043d, n=\u043a\u043e\u043b\u0438\u0447\u0435\u0441\u0442\u0432\u043e \u044d\u043b\u0435\u043a\u0442\u0440\u043e\u043d\u043e\u0432, \u043a\u043e\u0442\u043e\u0440\u043e\u0435 \u043e\u0442\u0434\u0430\u0435\u0442 \u043c\u0435\u0442\u0430\u043b\u043b)
\u0432 \u0441\u043a\u043e\u0431\u043a\u0430\u0445 \u0437\u0430\u0440\u044f\u0434\u044b\u00a0">]" data-testid="answer_box_list">

Me (0) - n*e = Me (n+)
атомы ионы
металла металла
(e=электрон, n=количество электронов, которое отдает металл)
в скобках заряды
Новые вопросы в Химия
масса раствора равна 250 г. массовая доля раствора 10 %. масса воды равна 150 мл. найдите массовую долю растворенного вещества
решите задачу по термохимическому уравнению реакции 4al+3O2=2Al2O3 +3350,4 кдж вычислите, какое количество теплоты выделится при взаимодействии с алюм … инием 3,2г кислорода
определите массу и количество железа, прореагировавшего с хлором ,если образовалось 16,25 грамм хлорида железа 3
пробирка - 3 шт.; 1 шт. штатив для пробирок заменив фенолфталеин метилоранжем и лакмусом. Что вы наблю- бавьте 1-2 капли фенолфталеина. Опыт повторить … несколько раз, 1. Налейте в пробирку 2 мл раствора гидроксида натрия и до- даете? Объясните изменение окраски индикаторов. 2. Налейте в пробирку 2-3 мл раствора соляной кислоты и до- раз, заменив метилоранж фенолфталеином и лакмусом. Что вы на- бавьте одну или две капли метилоранжа. Повторите опыт несколько блюдаете? Объясните изменение окраски индикаторов. 3. Налейте в пробирку 2-3 мл раствора поваренной соли и до- бавьте одну или две капли одного из индикаторов. Повторите опыт, заменив индикаторы. Что вы наблюдаете? Объясните изменение окраски индикаторов. Заполните таблицу: Название индикаторавет индикатора в различных средах в кислой в нейтральной в щелочной
Из оксида меди(II) нужно получить 160 г меди.Сколько воды нужно подвергнуть электролизу, чтобы получить запасенное количество водорода?
Все известные на сегодняшний день химические элементы, расположенные в таблице Менделеева, подразделяются условно на две большие группы: металлы и неметаллы. Для того чтобы они стали не просто элементами, а соединениями, химическими веществами, могли вступать во взаимодействие друг с другом, они должны существовать в виде простых и сложных веществ.
Именно для этого одни электроны стараются принять, а другие - отдать. Восполняя друг друга таким образом, элементы и образуют различные химические молекулы. Но что позволяет им удерживаться вместе? Почему существуют вещества такой прочности, разрушить которую неподвластно даже самым серьезным инструментам? А другие, наоборот, разрушаются от малейшего воздействия. Все это объясняется образованием различных типов химической связи между атомами в молекулах, формированием кристаллической решетки определенного строения.
Виды химических связей в соединениях
Всего можно выделить 4 основных типа химических связей.
- Ковалентная неполярная. Образуется между двумя одинаковыми неметаллами за счет обобществления электронов, формирования общих электронных пар. В образовании ее принимают участие валентные неспаренные частицы. Примеры: галогены, кислород, водород, азот, сера, фосфор.
- Ковалентная полярная. Образуется между двумя разными неметаллами либо между очень слабым по свойствам металлом и слабым по электроотрицательности неметаллом. В основе также общие электронные пары и перетягивание их к себе тем атомом, сродство к электрону которого выше. Примеры: NH3, SiC, P2O5 и прочие.
- Водородная связь. Самая нестойкая и слабая, формируется между сильно электроотрицательным атомом одной молекулы и положительным другой. Чаще всего это происходит при растворении веществ в воде (спирта, аммиака и так далее). Благодаря такой связи могут существовать макромолекулы белков, нуклеиновых кислот, сложных углеводов и так далее.
- Ионная связь. Формируется за счет сил электростатического притяжения разнозаряженных ионов металлов и неметаллов. Чем сильнее различие по данному показателю, тем ярче выражен именно ионный характер взаимодействия. Примеры соединений: бинарные соли, сложные соединения - основания, соли.
- Металлическая связь, механизм образования которой, а также свойства, будут рассмотрены дальше. Формируется в металлах, их сплавах различного рода.
Существует такое понятие, как единство химической связи. В нем как раз и говорится о том, что нельзя каждую химическую связь рассматривать эталонно. Они все лишь условно обозначенные единицы. Ведь в основе всех взаимодействий лежит единый принцип - электронностатическое взаимодействие. Поэтому ионная, металлическая, ковалентная связь и водородная имеют единую химическую природу и являются лишь граничными случаями друг друга.
Металлы и их физические свойства
Металлы находятся в подавляющем большинстве среди всех химических элементов. Это объясняется их особыми свойствами. Значительная часть из них была получена человеком ядерными реакциями в лабораторных условиях, они являются радиоактивными с небольшим периодом полураспада.
Однако большинство - это природные элементы, которые формируют целые горные породы и руды, входят в состав большинства важных соединений. Именно из них люди научились отливать сплавы и изготавливать массу прекрасных и важных изделий. Это такие, как медь, железо, алюминий, серебро, золото, хром, марганец, никель, цинк, свинец и многие другие.
Для всех металлов можно выделить общие физические свойства, которые объясняет схема образования металлической связи. Какие же это свойства?
- Ковкость и пластичность. Известно, что многие металлы можно прокатать даже до состояния фольги (золото, алюминий). Из других получают проволоку, металлические гибкие листы, изделия, способные деформироваться при физическом воздействии, но тут же восстанавливать форму после прекращения его. Именно эти качества металлов и называют ковкостью и пластичностью. Причина этой особенности - металлический тип связи. Ионы и электроны в кристалле скользят относительно друг друга без разрыва, что и позволяет сохранять целостность всей структуры.
- Металлический блеск. Это также объясняет металлическая связь, механизм образования, характеристики ее и особенности. Так, не все частицы способны поглощать или отражать световые волны одинаковой длины. Атомы большинства металлов отражают коротковолновые лучи и приобретают практически одинаковую окраску серебристого, белого, бледно-голубоватого оттенка. Исключениями являются медь и золото, их окраска рыже-красная и желтая соответственно. Они способны отражать более длинноволновое излучение.
- Тепло- и электропроводность. Данные свойства также объясняются строением кристаллической решетки и тем, что в ее образовании реализуется металлический тип связи. За счет "электронного газа", движущегося внутри кристалла, электрический ток и тепло мгновенно и равномерно распределяются между всеми атомами и ионами и проводятся через металл.
- Твердое агрегатное состояние при обычных условиях. Здесь исключением является лишь ртуть. Все остальные металлы - это обязательно прочные, твердые соединения, равно как и их сплавы. Это также результат того, что в металлах присутствует металлическая связь. Механизм образования такого типа связывания частиц полностью подтверждает свойства.
Это основные физические характеристики для металлов, которые объясняет и определяет именно схема образования металлической связи. Актуален такой способ соединения атомов именно для элементов металлов, их сплавов. То есть для них в твердом и жидком состоянии.

Металлический тип химической связи
В чем же ее особенность? Все дело в том, что такая связь формируется не за счет разнозаряженных ионов и их электростатического притяжения и не за счет разности в электроотрицательности и наличия свободных электронных пар. То есть ионная, металлическая, ковалентная связь имеют несколько разную природу и отличительные черты связываемых частиц.
Всем металлам присущи такие характеристики, как:
- малое количество электронов на внешнем энергетическом уровне (кроме некоторых исключений, у которых их может быть 6,7 и 8);
- большой атомный радиус;
- низкая энергия ионизации.
Все это способствует легкому отделению внешних неспаренных электронов от ядра. При этом свободных орбиталей у атома остается очень много. Схема образования металлической связи как раз и будет показывать перекрывание многочисленных орбитальных ячеек разных атомов между собой, которые в результате и формируют общее внутрикристаллическое пространство. В него подаются электроны от каждого атома, которые начинают свободно блуждать по разным частям решетки. Периодически каждый из них присоединяется к иону в узле кристалла и превращает его в атом, затем снова отсоединяется, формируя ион.
Таким образом, металлическая связь - это связь между атомами, ионами и свободными электронами в общем кристалле металла. Электронное облако, свободно перемещающееся внутри структуры, называют "электронным газом". Именно им объясняется большинство физических свойств металлов и их сплавов.
Как конкретно реализует себя металлическая химическая связь? Примеры можно привести разные. Попробуем рассмотреть на кусочке лития. Даже если взять его размером с горошину, атомов там будут тысячи. Вот и представим себе, что каждый из этих тысяч атомов отдает свой валентный единственный электрон в общее кристаллическое пространство. При этом, зная электронное строения данного элемента, можно увидеть количество пустующих орбиталей. У лития их будет 3 (р-орбитали второго энергетического уровня). По три у каждого атома из десятков тысяч - это и есть общее пространство внутри кристалла, в котором "электронный газ" свободно перемещается.

Вещество с металлической связью всегда прочное. Ведь электронный газ не позволяет кристаллу рушиться, а лишь смещает слои и тут же восстанавливает. Оно блестит, обладает определенной плотностью (чаще всего высокой), плавкостью, ковкостью и пластичностью.
Где еще реализуется металлическая связь? Примеры веществ:
- металлы в виде простых структур;
- все сплавы металлов друг с другом;
- все металлы и их сплавы в жидком и твердом состоянии.
Конкретных примеров можно привести просто неимоверное количество, ведь металлов в периодической системе более 80!
Металлическая связь: механизм образования
Если рассматривать его в общем виде, то основные моменты мы уже обозначили выше. Наличие свободных атомных орбиталей и электронов, легко отрывающихся от ядра вследствие малой энергии ионизации, - вот главные условия для формирования данного типа связи. Таким образом, получается, что она реализуется между следующими частицами:
- атомами в узлах кристаллической решетки;
- свободными электронами, которые были у металла валентными;
- ионами в узлах кристаллической решетки.
В итоге - металлическая связь. Механизм образования в общем виде выражается следующей записью: Ме 0 - e - ↔ Ме n+ . Из схемы очевидно, какие частицы присутствуют в кристалле металла.
Сами кристаллы могут иметь разную форму. Это зависит от конкретного вещества, с которым мы имеем дело.
Типы кристаллов металлов
Данная структура металла или его сплава характеризуется очень плотной упаковкой частиц. Ее обеспечивают ионы в узлах кристалла. Сами по себе решетки могут быть разных геометрических форм в пространстве.
- Объемноцентрическая кубическая решетка - щелочные металлы.
- Гексагональная компактная структура - все щелочноземельные, кроме бария.
- Гранецентрическая кубическая - алюминий, медь, цинк, многие переходные металлы.
- Ромбоэдрическая структура - у ртути.
- Тетрагональная - индий.
Чем тяжелее металл и чем ниже он располагается в периодической системе, тем сложнее его упаковка и пространственная организация кристалла. При этом металлическая химическая связь, примеры которой можно привести для каждого существующего металла, является определяющей при построении кристалла. Сплавы имеют очень разнообразные организации в пространстве, некоторые из них до сих пор еще не до конца изучены.

Характеристики связи: ненаправленность
Ковалентная и металлическая связь имеют одну очень ярко выраженную отличительную черту. В отличие от первой, металлическая связь не является направленной. Что это значит? То есть электронное облако внутри кристалла движется совершенно свободно в его пределах в разных направлениях, каждый из электронов способен присоединяться к абсолютно любому иону в узлах структуры. То есть взаимодействие осуществляется по разным направлениям. Отсюда и говорят о том, что металлическая связь - ненаправленная.
Механизм ковалентной связи подразумевает образование общих электронных пар, то есть облаков перекрывания атомов. Причем происходит оно строго по определенной линии, соединяющей их центры. Поэтому говорят о направленности такой связи.
Насыщаемость
Данная характеристика отражает способность атомов к ограниченному или неограниченному взаимодействию с другими. Так, ковалентная и металлическая связь по этому показателю опять же являются противоположностями.
Первая является насыщаемой. Атомы, принимающие участие в ее образовании, имеют строго определенное количество валентных внешних электронов, принимающих непосредственное участие в образовании соединения. Больше, чем есть, у него электронов не будет. Поэтому и количество формируемых связей ограничено валентностью. Отсюда насыщаемость связи. Благодаря данной характеристике большинство соединений имеет постоянный химический состав.
Металлическая и водородная связи, напротив, ненасыщаемые. Это объясняется наличием многочисленных свободных электронов и орбиталей внутри кристалла. Также роль играют ионы в узлах кристаллической решетки, каждый из которых может стать атомом и снова ионом в любой момент времени.

Еще одна характеристика металлической связи - делокализация внутреннего электронного облака. Она проявляется в способности небольшого количества общих электронов связывать между собой множество атомных ядер металлов. То есть плотность как бы делокализуется, распределяется равномерно между всеми звеньями кристалла.
Примеры образования связи в металлах
Рассмотрим несколько конкретных вариантов, которые иллюстрируют, как образуется металлическая связь. Примеры веществ следующие:
Образование металлической связи между атомами цинка: Zn 0 - 2e - ↔ Zn 2+ . Атом цинка имеет четыре энергетических уровня. Свободных орбиталей, исходя из электронного строения, у него 15 - 3 на р-орбитали, 5 на 4 d и 7 на 4f. Электронное строение следующее: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 0 4d 0 4f 0 , всего в атоме 30 электронов. То есть две свободные валентные отрицательные частицы способны перемещаться в пределах 15 просторных и никем не занятых орбиталей. И так у каждого атома. В итоге - огромное общее пространство, состоящее из пустующих орбиталей, и небольшое количество электронов, связывающих всю структуру воедино.
Металлическая связь между атомами алюминия: AL 0 - e - ↔ AL 3+ . Тринадцать электронов атома алюминия располагаются на трех энергетических уровнях, которых им явно хватает с избытком. Электронное строение: 1s 2 2s 2 2p 6 3s 2 3p 1 3d 0 . Свободных орбиталей - 7 штук. Очевидно, что электронное облако будет небольшим по сравнению с общим внутренним свободным пространством в кристалле.

Металлическая связь хрома. Данный элемент особый по своему электронному строению. Ведь для стабилизации системы происходит провал электрона с 4s на 3d орбиталь: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 4p 0 4d 0 4f 0 . Всего 24 электрона, из которых валентных получается шесть. Именно они уходят в общее электронное пространство на образование химической связи. Свободных орбиталей 15, то есть все равно намного больше, чем требуется для заполнения. Поэтому хром - также типичный пример металла с соответствующей связью в молекуле.
Одним из самых активных металлов, реагирующих даже с обычной водой с возгоранием, является калий. Чем объясняются такие свойства? Опять же во многом - металлическим типом связи. Электронов у этого элемента всего 19, но вот располагаются они аж на 4 энергетических уровнях. То есть на 30 орбиталях разных подуровней. Электронное строение: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 0 4p 0 4d 0 4f 0 . Всего два валентных электрона, с очень низкой энергией ионизации. Свободно отрываются и уходят в общее электронное пространство. Орбиталей для перемещения на один атом 22 штуки, то есть очень обширное свободное пространство для "электронного газа".
Сходство и различие с другими видами связей
В целом данный вопрос уже рассматривался выше. Можно только обобщить и сделать вывод. Главными отличительными от всех других типов связи чертами именно металлических кристаллов являются:
- несколько видов частиц, принимающих участие в процессе связывания (атомы, ионы или атом-ионы, электроны);
- различное пространственное геометрическое строение кристаллов.
С водородной и ионной связью металлическую объединяет ненасыщаемость и ненаправленность. С ковалентной полярной - сильное электростатическое притяжение между частицами. Отдельно с ионной - тип частиц в узлах кристаллической решетки (ионы). С ковалентной неполярной - атомы в узлах кристалла.
Типы связей в металлах разного агрегатного состояния
Как мы уже отмечали выше, металлическая химическая связь, примеры которой приведены в статье, образуется в двух агрегатных состояниях металлов и их сплавов: твердом и жидком.
Возникает вопрос: какой тип связи в парах металлов? Ответ: ковалентная полярная и неполярная. Как и во всех соединениях, находящихся в виде газа. То есть при длительном нагревании металла и перевода его из твердого состояния в жидкое связи не рвутся и кристаллическая структура сохраняется. Однако когда речь заходит о переводе жидкости в парообразное состояние, кристалл разрушается и металлическая связь преобразуется в ковалентную.
Читайте также:

