Как сделать полипептид
Обновлено: 04.07.2024
Обмен веществ — важнейшее свойство живых организмов. Совокупность реакций обмена веществ, протекающих в организме, называется метаболизмом. Метаболизм состоит из реакций ассимиляции (пластического обмена, анаболизма) и реакций диссимиляции (энергетического обмена, катаболизма). Ассимиляция — совокупность реакций биосинтеза, протекающих в клетке, диссимиляция — совокупность реакций распада и окисления высокомолекулярных веществ, идущих с выделением энергии. Эти группы реакций взаимосвязаны: реакции биосинтеза невозможны без энергии, которая выделяется в реакциях энергетического обмена, реакции диссимиляции не идут без ферментов, образующихся в реакциях пластического обмена.
По типу обмена веществ организмы подразделяются на две группы: автотрофы и гетеротрофы. Автотрофы — организмы, способные синтезировать органические вещества из неорганических и использующие для этого синтеза или солнечную энергию, или энергию, выделяющуюся при окислении неорганических веществ. Гетеротрофы — организмы, использующие для своей жизнедеятельности органические вещества, синтезированные другими организмами. В качестве источника углерода автотрофы используют неорганические вещества (СО2), а гетеротрофы — экзогенные органические. Источники энергии: у автотрофов — энергия солнечного света (фотоавтотрофы) или энергия, выделяющаяся при окислении неорганических соединений (хемоавтотрофы), у гетеротрофов — энергия окисления органических веществ (хемогетеротрофы).
Большинство живых организмов относится или к фотоавтотрофам (растения), или к хемогетеротрофам (грибы, животные). Если организмы, в зависимости от условий, ведут себя как авто- либо как гетеротрофы, то их называют миксотрофами (эвглена зеленая).
Биосинтез белков
Биосинтез белков является важнейшим процессом анаболизма. Все признаки, свойства и функции клеток и организмов определяются в конечном итоге белками. Белки недолговечны, время их существования ограничено. В каждой клетке постоянно синтезируются тысячи различных белковых молекул. В начале 50-х гг. ХХ в. Ф. Крик сформулировал центральную догму молекулярной биологии: ДНК → РНК → белок. Согласно этой догме способность клетки синтезировать определенные белки закреплена наследственно, информация о последовательности аминокислот в белковой молекуле закодирована в виде последовательности нуклеотидов ДНК. Участок ДНК, несущий информацию о первичной структуре конкретного белка, называется геном. Гены не только хранят информацию о последовательности аминокислот в полипептидной цепочке, но и кодируют некоторые виды РНК: рРНК, входящие в состав рибосом, и тРНК, отвечающие за транспорт аминокислот. В процессе биосинтеза белка выделяют два основных этапа: транскрипция — синтез РНК на матрице ДНК (гена) — и трансляция — синтез полипептидной цепи.
Генетический код и его свойства
Генетический код — система записи информации о последовательности аминокислот в полипептиде последовательностью нуклеотидов ДНК или РНК. В настоящее время эта система записи считается расшифрованной.
Свойства генетического кода:
- триплетность: каждая аминокислота кодируется сочетанием из трех нуклеотидов (триплетом, кодоном);
- однозначность (специфичность): триплет соответствует только одной аминокислоте;
- вырожденность (избыточность): аминокислоты могут кодироваться несколькими (до шести) кодонами;
- универсальность: система кодирования аминокислот одинакова у всех организмов Земли;
- неперекрываемость: последовательность нуклеотидов имеет рамку считывания по 3 нуклеотида, один и тот же нуклеотид не может быть в составе двух триплетов;
- из 64 кодовых триплетов 61 — кодирующие, кодируют аминокислоты, а 3 — бессмысленные (в РНК — УАА, УГА, УАГ), не кодируют аминокислоты. Они называются кодонами-терминаторами, поскольку блокируют синтез полипептида во время трансляции. Кроме того, есть кодон-инициатор (в РНК — АУГ), с которого трансляция начинается.
Таблица генетического кода
| Первое основание | Второе основание | Третье основание | |||
|---|---|---|---|---|---|
| У(А) | Ц(Г) | А(Т) | Г(Ц) | ||
| У(А) | Фен Фен Лей Лей | Сер Сер Сер Сер | Тир Тир — — | Цис Цис — Три | У(А) Ц(Г) А(Т) Г(Ц) |
| Ц(Г) | Лей Лей Лей Лей | Про Про Про Про | Гис Гис Глн Глн | Арг Арг Арг Арг | У(А) Ц(Г) А(Т) Г(Ц) |
| А(Т) | Иле Иле Иле Мет | Тре Тре Тре Тре | Асн Асн Лиз Лиз | Сер Сер Арг Арг | У(А) Ц(Г) А(Т) Г(Ц) |
| Г(Ц) | Вал Вал Вал Вал | Ала Ала Ала Ала | Асп Асп Глу Глу | Гли Гли Гли Гли | У(А) Ц(Г) А(Т) Г(Ц) |
* Первый нуклеотид в триплете — один из четырех левого вертикального ряда, второй — один из верхнего горизонтального ряда, третий — из правого вертикального.
Реакции матричного синтеза
Это особая категория химических реакций, происходящих в клетках живых организмов. Во время этих реакций происходит синтез полимерных молекул по плану, заложенному в структуре других полимерных молекул-матриц. На одной матрице может быть синтезировано неограниченное количество молекул-копий. К этой категории реакций относятся репликация, транскрипция, трансляция и обратная транскрипция.
| Название реакции матричного синтеза | Характеристика процесса | Основные компоненты |
|---|---|---|
| Репликация | Синтез ДНК на матрице ДНК | Дезоксирибонуклеозидтрифосфаты, ферменты |
| Транскрипция | Синтез РНК на матрице ДНК | Участок ДНК, рибонуклеозидтрифосфаты, ферменты |
| Трансляция | Синтез полипептида на матрице РНК | Рибосомы, иРНК, аминокислоты, тРНК, АТФ, ГТФ, ферменты |
| Обратная транскрипция | Синтез ДНК на матрице РНК | Дезоксирибонуклеозидтрифосфаты, ферменты |
Строение гена эукариот
Ген — участок молекулы ДНК, кодирующий первичную последовательность аминокислот в полипептиде или последовательность нуклеотидов в молекулах транспортных и рибосомных РНК. ДНК одной хромосомы может содержать несколько тысяч генов, которые располагаются в линейном порядке. Место гена в определенном участке хромосомы называется локусом. Особенностями строения гена эукариот являются: 1) наличие достаточно большого количества регуляторных блоков, 2) мозаичность (чередование кодирующих участков с некодирующими). Экзоны (Э) — участки гена, несущие информацию о строении полипептида. Интроны (И) — участки гена, не несущие информацию о строении полипептида. Число экзонов и интронов различных генов разное; экзоны чередуются с интронами, общая длина последних может превышать длину экзонов в два и более раз. Перед первым экзоном и после последнего экзона находятся нуклеотидные последовательности, называемые соответственно лидерной (ЛП) и трейлерной последовательностью (ТП). Лидерная и трейлерная последовательности, экзоны и интроны образуют единицу транскрипции. Промотор (П) — участок гена, к которому присоединяется фермент РНК-полимераза, представляет собой особое сочетание нуклеотидов. Перед единицей транскрипции, после нее, иногда в интронах находятся регуляторные элементы (РЭ), к которым относятся энхансеры и сайленсеры. Энхансеры ускоряют транскрипцию, сайленсеры тормозят ее.

Транскрипция у эукариот
Транскрипция — синтез РНК на матрице ДНК. Осуществляется ферментом РНК-полимеразой.
РНК-полимераза может присоединиться только к промотору, который находится на 3'-конце матричной цепи ДНК, и двигаться только от 3'- к 5'-концу этой матричной цепи ДНК. Синтез РНК происходит на одной из двух цепочек ДНК в соответствии с принципами комплементарности и антипараллельности. Строительным материалом и источником энергии для транскрипции являются рибонуклеозидтрифосфаты (АТФ, УТФ, ГТФ, ЦТФ).

Транскрипция и процессинг происходят в клеточном ядре. Зрелая иРНК приобретает определенную пространственную конформацию, окружается белками и в таком виде через ядерные поры транспортируется к рибосомам; иРНК эукариот, как правило, моноцистронны (кодируют только одну полипептидную цепь).
Трансляция
Трансляция — синтез полипептидной цепи на матрице иРНК.
Органоиды, обеспечивающие трансляцию, — рибосомы. У эукариот рибосомы находятся в некоторых органоидах — митохондриях и пластидах (70S-рибосомы), в свободном виде в цитоплазме (80S-рибосомы) и на мембранах эндоплазматической сети (80S-рибосомы). Таким образом, синтез белковых молекул может происходить в цитоплазме, на шероховатой эндоплазматической сети, в митохондриях и пластидах. В цитоплазме синтезируются белки для собственных нужд клетки; белки, синтезируемые на ЭПС, транспортируются по ее каналам в комплекс Гольджи и выводятся из клетки. В рибосоме выделяют малую и большую субъединицы. Малая субъединица рибосомы отвечает за генетические, декодирующие функции; большая — за биохимические, ферментативные.
В малой субъединице рибосомы расположен функциональный центр (ФЦР) с двумя участками — пептидильным (Р-участок) и аминоацильным (А-участок). В ФЦР может находиться шесть нуклеотидов иРНК, три — в пептидильном и три — в аминоацильном участках.
Для транспорта аминокислот к рибосомам используются транспортные РНК, тРНК (лекция №4). Длина тРНК от 75 до 95 нуклеотидных остатков. Они имеют третичную структуру, по форме напоминающую лист клевера. В тРНК различают антикодоновую петлю и акцепторный участок. В антикодоновой петле РНК имеется антикодон, комплементарный кодовому триплету определенной аминокислоты, а акцепторный участок на 3'-конце способен с помощью фермента аминоацил-тРНК-синтетазы присоединять именно эту аминокислоту (с затратой АТФ). Таким образом, у каждой аминокислоты есть свои тРНК и свои ферменты, присоединяющие аминокислоту к тРНК.
1 — антикодон;
2 — участок, связывающий аминокислоту.
Транспорт аминокислот к рибосомам:
1 — фермент; 2 — тРНК; 3 — аминокислота.
Двадцать видов аминокислот кодируются 61 кодоном, теоретически может быть 61 вид тРНК с соответствующими антикодонами. Но кодируемых аминокислот всего 20 видов, значит, у одной аминокислоты может быть несколько тРНК. Установлено существование нескольких тРНК, способных связываться с одним и тем же кодоном (последний нуклеотид в антикодоне тРНК не всегда важен), поэтому в клетке обнаружено всего около 40 различных тРНК.
Синтез белка начинается с того момента, когда к 5'-концу иРНК присоединяется малая субъединица рибосомы, в Р-участок которой заходит метиониновая тРНК (транспортирующая аминокислоту метионин). Следует отметить, что любая полипептидная цепь на N-конце сначала имеет метионин, который в дальнейшем чаще всего отщепляется. Синтез полипептида идет от N-конца к С-концу, то есть пептидная связь образуется между карбоксильной группой первой и аминогруппой второй аминокислот.
Затем происходит присоединение большой субъединицы рибосомы, и в А-участок поступает вторая тРНК, чей антикодон комплементарно спаривается с кодоном иРНК, находящимся в А-участке.
Пептидилтрансферазный центр большой субъединицы катализирует образование пептидной связи между метионином и второй аминокислотой. Отдельного фермента, катализирующего образование пептидных связей, не существует. Энергия для образования пептидной связи поставляется за счет гидролиза ГТФ.
Как только образовалась пептидная связь, метиониновая тРНК отсоединяется от метионина, а рибосома передвигается на следующий кодовый триплет иРНК, который оказывается в А-участке рибосомы, а метиониновая тРНК выталкивается в цитоплазму. На один цикл расходуется 2 молекулы ГТФ. В А-участок заходит третья тРНК, и образуется пептидная связь между второй и третьей аминокислотами.

Трансляция идет до тех пор, пока в А-участок не попадает кодон-терминатор (УАА, УАГ или УГА), с которым связывается особый белковый фактор освобождения. Полипептидная цепь отделяется от тРНК и покидает рибосому. Происходит диссоциация, разъединение субъединиц рибосомы.
Скорость передвижения рибосомы по иРНК — 5–6 триплетов в секунду, на синтез белковой молекулы, состоящей из сотен аминокислотных остатков, клетке требуется несколько минут. Первым белком, синтезированным искусственно, был инсулин, состоящий из 51 аминокислотного остатка. Потребовалось провести 5000 операций, в работе в течение трех лет принимали участие 10 человек.
Транскрипция и трансляция у прокариот
- В результате транскрипции образуется полицистронная иРНК, кодирующая несколько белков, совместно обеспечивающих определенную группу реакций.
- иРНК имеет несколько центров инициации трансляции, терминации трансляции и НТО.
- Не происходят КЭПирование, полиаденилирование и сплайсинг иРНК.
- Трансляция начинается еще до завершения транскрипции; эти процессы не разделены во времени и пространстве, как это имеет место у эукариот.

1 — ДНК; 2 — РНК-полимераза; 3 — Нуклеозидтрифосфаты ГТФ, ЦТФ, АТФ, УТФ.
Каждая клетка содержит тысячи белков. Свойства белков зависят от их первичной структуры , т. е. порядка соединения аминокислотных остатков в молекулах.
Информация о первичной структуре всех белков организма закодирована последовательностью нуклеотидов, образующих молекулы ДНК. В молекулах ДНК выделяют гены . Каждый ген соответствует одному белку.
Ген — это единица наследственности, представляющая собой участок ДНК, в котором закодирована первичная структура молекул одного белка.

Биосинтез происходит в клетках с огромной скоростью. В организме высших животных в одну минуту образуется до \(60\) тыс. пептидных связей.
Транскрипция — это процесс переписывания наследственной информации с молекулы ДНК на информационную (матричную) РНК.

Информационная (матричная) РНК одноцепочечная, она собирается на одной из нитей ДНК по правилу комплементарности.
Образуется молекула иРНК, которая является копией второй цепочки ДНК, только в ней тимин заменён на урацил. Закодированная в ДНК информация о первичной структуре белка таким образом переписывается на иРНК.
Молекула ДНК содержит большое количество генов. В начале каждого гена располагается промотор — особая последовательность нуклеотидов ДНК, которую определяет РНК-полимераза, и с этого места начинает сборку молекулы иРНК.
В клетках прокариот иРНК образуется в цитоплазме, поэтому образовавшиеся молекулы могут сразу принимать участие в синтезе белков на рибосомах.
В клетках эукариот транскрипция происходит в ядре, поэтому иРНК сначала через поры в ядерной мембране выходит в цитоплазму.
Для сборки белковой молекулы в цитоплазме клетки должны присутствовать все необходимые аминокислоты. Они образуются при расщеплении белков, поступающих с пищей, или синтезируются в самом организме.
Аминокислоты доставляются к рибосомам транспортными РНК (тРНК). Аминокислота попадает в рибосому только в комплексе с сответствующей тРНК.
К кодону, расположенному в активном центре рибосомы, присоединяется тРНК с комплементарным антикодоном. Соединённая с ней аминокислота образует пептидную связь к растущей полипептидной цепочкой. Затем рибосома перемещается на следующий кодон иРНК. В рибосоме оказывается тРНК с антикодоном, комплементарным следующему триплету в иРНК, и к образующейся молекуле белка присоединяется следующая аминокислота.

Рибосома постепенно сдвигается по иРНК, задерживаясь на следующих триплетах. Так поэтапно собирается молекула белка.
Синтез полипептидной цепи заканчивается, когда в активном центре рибосомы оказывается стоп-кодон (УАА, УАГ или УГА). Молекула белка отсоединяется от рибосомы, выходит в ЭПС или цитоплазму и усложняется, образуя характерную вторичную, третичную и четвертичную структуры.
На одной иРНК одновременно находятся несколько рибосом и происходит синтез нескольких молекул белка. Рибосомы, которые связаны с одной иРНК и синтезируют один и тот же белок, образуют полисому .
Когда синтез данного белка окончен, рибосома может найти другую иРНК и начать синтезировать другой белок.

последовательность нуклеотидов матричной цепи ДНК: ААГ ГЦТ ТАГ.
При транскрипции на этой цепи по принципу комплементарности образуется участок иРНК с нуклеотидами УУЦ ЦГА АУЦ, на котором в результате трансляции образуется цепочка из аминокислот: фенилаланин — аргинин — серин.
Если в одном из триплетов произойдёт замена нуклеотидов или они поменяются местами, то может случиться так, что триплет станет кодировать какую-нибудь другую аминокислоту. Значит, произойдут изменения и в строении белка, закодированного данным геном, что может оказать влияние на процессы обмена веществ и изменить признаки организма.
В живой материи аминокислоты находятся как в свободной форме, так и связанном друг с другом виде. Связывание происходит между СООН- группой одной аминокислоты и NH.,-группой другой аминокислоты, а образованную связь называют пептидной. Формально образование пептидной связи можно представить схемой (рис. 3.19).

Рис. 3.19. Образование дипептида
Эксклюзивность методики заключается еще и в удалении примесей. В любом химическом синтезе есть вещества, не вступившие в реакцию, какие-либо побочные продукты. Традиционный способ предусматривает отделение продукта реакции от примесей после проведения каждой стадии. В случае с белками, когда нужно синтезировать сотни пептидных связей, такой способ нельзя назвать прогрессивным. По идее Меррифилда, С-кон- цевая аминокислота закрепляется на твердом носителе до полного окончания синтеза всего полипептида и помещается в специальный реактор (колонку). Следующая аминокислота вводится в избыточном количестве, чтобы взаимодействие произошло максимально полно. Когда пептидная связь образована, в колонку подается подходящий растворитель и смывает побочные продукты. Затем присоединяют третью аминокислоту и т.д.
В живой природе пептидная связь образуется благодаря сложному ферментативному механизму, суть которого излагается в гл. 13.
Пептиды классифицируют по числу аминокислотных остатков в их составе (табл. 3.5).
Число аминокислотных остатков
Крайняя слева аминокислота содержит свободную NH2-rpvnny, поэтому ее называют N-концевой, а крайняя справа аминокислота сохранила свою СООН-группу, поэтому такую аминокислоту называют С-коицевой (рис. 3.20). При этом N-концевая аминокислота считается первой, следующая за ней — второй, и т.д., а С-концевая аминокислота — последняя.

Рис. 3.20. Схема строения пептида (рамками выделены пептидные связи)
Название пептида образуют из названия аминокислот, входящих в его состав. При этом возможны три варианта.
В первом случае аминокислоты обозначают сокращенными названиями, но N-концевую аминокислоту — дополнительным символом Н, а С-конце- вую — дополнительным символом ОН. Например, тетрапептид, представленный на рис. 3.21, будет называться Н-Мет-Фен-Тре-Арг-ОН.
Во втором случае в названии подчеркивают, что все аминокислоты, за исключением последней, находятся в форме ацилов. Поэтому в названи-

Рис. 3.21. Пример тетрапептида
Способы его названия: а) Н-Мет-Фен-Тре-Арг-ОН; 6) метионил-фенилиланил-
треонил-аргинин; в) MFTR
ях этих аминокислот окончания заменяются на суффикс -ил> а название С-коицевой аминокислоты остается без изменений. Аспарагиновая и глутаминовая кислоты и их амиды имеют одинаковые корни. Чтобы отличать ацильные названия этих соединений, принято остатки Асп и Глу обозначать соответственно аспарагил и глутамил, а остатки Асн и Глн — асиараги- нил и глутаминил.
Для названия длинных аминокислотных последовательностей применяют третий способ: используют однобуквенные обозначения аминокислот. Таким образом, метионил-фенилиланил-треонил-аргинин будет назван как MFTR (рис. 3.21, в).
В названии пептида указывают все особенности его построения. Например, глутатион — это трипептид, образованный глутаминовой кислотой, Цис и Гли. Но глутаминовая кислота образует пептидную связь своей у-карбок- сильной группой, наиболее удаленной от NH2-rpynnbi. Это подчеркивают в названии — у-глутамилцистеилглицин (рис. 3.22).

Рис. 3.22. Строение глутатиона
Многие пептиды выполняют определенные функции в организме. Причем биологические свойства пептидов обусловлены набором аминокислот, входящих в их состав. Например, глутатион — это биологически активный пептид. Благодаря своей активной SH-группе в остатке Цис он участвует в окислительно-восстановительных реакциях типа гидрирования-дегидрирования, поддерживая внутреннее равновесие организма в ответ на различные антропогенные нагрузки окружающей среды.
Существуют и другие примеры пептидов, играющих важную роль в обмене веществ в клетке. Например, карнозин (р-аланилгистидин), участвующий в сокращении мышц (рис. 3.23).
Известный заменитель сахара аспартам (нутрасвит, сладекс) — дипептид. Он образован из аспарагиновой кислоты и метилового эфира фенилаланина (рис. 3.24) и слаще сахара в 160—200 раз.
Нанопептидами являются гормоны задней доли гипофиза окситоцин и вазопрессин (см. рис. 4.2).

Рис. 3.23. Дипсптид карнозин Рис. 3.24. Структура аспартама
От наличия функциональных групп в структуре пептида зависят его физико-химические свойства: степень ионизации, растворимость и др., которые используются в различных методах выделения и идентификации пептидов. Например, изоэлектрическую точку (pi) пептидов приблизительно можно рассчитать как среднее арифметическое констант диссоциации (рК) концевых аминокислот и боковых ионизированных радикалов:
Обмен веществ — важнейшее свойство живых организмов. Совокупность реакций обмена веществ, протекающих в организме, называется метаболизмом. Метаболизм состоит из реакций ассимиляции (пластического обмена, анаболизма) и реакций диссимиляции (энергетического обмена, катаболизма). Ассимиляция — совокупность реакций биосинтеза, протекающих в клетке, диссимиляция — совокупность реакций распада и окисления высокомолекулярных веществ, идущих с выделением энергии. Эти группы реакций взаимосвязаны: реакции биосинтеза невозможны без энергии, которая выделяется в реакциях энергетического обмена, реакции диссимиляции не идут без ферментов, образующихся в реакциях пластического обмена.
По типу обмена веществ организмы подразделяются на две группы: автотрофы и гетеротрофы. Автотрофы — организмы, способные синтезировать органические вещества из неорганических и использующие для этого синтеза или солнечную энергию, или энергию, выделяющуюся при окислении неорганических веществ. Гетеротрофы — организмы, использующие для своей жизнедеятельности органические вещества, синтезированные другими организмами. В качестве источника углерода автотрофы используют неорганические вещества (СО2), а гетеротрофы — экзогенные органические. Источники энергии: у автотрофов — энергия солнечного света (фотоавтотрофы) или энергия, выделяющаяся при окислении неорганических соединений (хемоавтотрофы), у гетеротрофов — энергия окисления органических веществ (хемогетеротрофы).
Большинство живых организмов относится или к фотоавтотрофам (растения), или к хемогетеротрофам (грибы, животные). Если организмы, в зависимости от условий, ведут себя как авто- либо как гетеротрофы, то их называют миксотрофами (эвглена зеленая).
Биосинтез белков
Биосинтез белков является важнейшим процессом анаболизма. Все признаки, свойства и функции клеток и организмов определяются в конечном итоге белками. Белки недолговечны, время их существования ограничено. В каждой клетке постоянно синтезируются тысячи различных белковых молекул. В начале 50-х гг. ХХ в. Ф. Крик сформулировал центральную догму молекулярной биологии: ДНК → РНК → белок. Согласно этой догме способность клетки синтезировать определенные белки закреплена наследственно, информация о последовательности аминокислот в белковой молекуле закодирована в виде последовательности нуклеотидов ДНК. Участок ДНК, несущий информацию о первичной структуре конкретного белка, называется геном. Гены не только хранят информацию о последовательности аминокислот в полипептидной цепочке, но и кодируют некоторые виды РНК: рРНК, входящие в состав рибосом, и тРНК, отвечающие за транспорт аминокислот. В процессе биосинтеза белка выделяют два основных этапа: транскрипция — синтез РНК на матрице ДНК (гена) — и трансляция — синтез полипептидной цепи.
Генетический код и его свойства
Генетический код — система записи информации о последовательности аминокислот в полипептиде последовательностью нуклеотидов ДНК или РНК. В настоящее время эта система записи считается расшифрованной.
Свойства генетического кода:
- триплетность: каждая аминокислота кодируется сочетанием из трех нуклеотидов (триплетом, кодоном);
- однозначность (специфичность): триплет соответствует только одной аминокислоте;
- вырожденность (избыточность): аминокислоты могут кодироваться несколькими (до шести) кодонами;
- универсальность: система кодирования аминокислот одинакова у всех организмов Земли;
- неперекрываемость: последовательность нуклеотидов имеет рамку считывания по 3 нуклеотида, один и тот же нуклеотид не может быть в составе двух триплетов;
- из 64 кодовых триплетов 61 — кодирующие, кодируют аминокислоты, а 3 — бессмысленные (в РНК — УАА, УГА, УАГ), не кодируют аминокислоты. Они называются кодонами-терминаторами, поскольку блокируют синтез полипептида во время трансляции. Кроме того, есть кодон-инициатор (в РНК — АУГ), с которого трансляция начинается.
Таблица генетического кода
| Первое основание | Второе основание | Третье основание | |||
|---|---|---|---|---|---|
| У(А) | Ц(Г) | А(Т) | Г(Ц) | ||
| У(А) | Фен Фен Лей Лей | Сер Сер Сер Сер | Тир Тир — — | Цис Цис — Три | У(А) Ц(Г) А(Т) Г(Ц) |
| Ц(Г) | Лей Лей Лей Лей | Про Про Про Про | Гис Гис Глн Глн | Арг Арг Арг Арг | У(А) Ц(Г) А(Т) Г(Ц) |
| А(Т) | Иле Иле Иле Мет | Тре Тре Тре Тре | Асн Асн Лиз Лиз | Сер Сер Арг Арг | У(А) Ц(Г) А(Т) Г(Ц) |
| Г(Ц) | Вал Вал Вал Вал | Ала Ала Ала Ала | Асп Асп Глу Глу | Гли Гли Гли Гли | У(А) Ц(Г) А(Т) Г(Ц) |
* Первый нуклеотид в триплете — один из четырех левого вертикального ряда, второй — один из верхнего горизонтального ряда, третий — из правого вертикального.
Реакции матричного синтеза
Это особая категория химических реакций, происходящих в клетках живых организмов. Во время этих реакций происходит синтез полимерных молекул по плану, заложенному в структуре других полимерных молекул-матриц. На одной матрице может быть синтезировано неограниченное количество молекул-копий. К этой категории реакций относятся репликация, транскрипция, трансляция и обратная транскрипция.
| Название реакции матричного синтеза | Характеристика процесса | Основные компоненты |
|---|---|---|
| Репликация | Синтез ДНК на матрице ДНК | Дезоксирибонуклеозидтрифосфаты, ферменты |
| Транскрипция | Синтез РНК на матрице ДНК | Участок ДНК, рибонуклеозидтрифосфаты, ферменты |
| Трансляция | Синтез полипептида на матрице РНК | Рибосомы, иРНК, аминокислоты, тРНК, АТФ, ГТФ, ферменты |
| Обратная транскрипция | Синтез ДНК на матрице РНК | Дезоксирибонуклеозидтрифосфаты, ферменты |
Строение гена эукариот
Ген — участок молекулы ДНК, кодирующий первичную последовательность аминокислот в полипептиде или последовательность нуклеотидов в молекулах транспортных и рибосомных РНК. ДНК одной хромосомы может содержать несколько тысяч генов, которые располагаются в линейном порядке. Место гена в определенном участке хромосомы называется локусом. Особенностями строения гена эукариот являются: 1) наличие достаточно большого количества регуляторных блоков, 2) мозаичность (чередование кодирующих участков с некодирующими). Экзоны (Э) — участки гена, несущие информацию о строении полипептида. Интроны (И) — участки гена, не несущие информацию о строении полипептида. Число экзонов и интронов различных генов разное; экзоны чередуются с интронами, общая длина последних может превышать длину экзонов в два и более раз. Перед первым экзоном и после последнего экзона находятся нуклеотидные последовательности, называемые соответственно лидерной (ЛП) и трейлерной последовательностью (ТП). Лидерная и трейлерная последовательности, экзоны и интроны образуют единицу транскрипции. Промотор (П) — участок гена, к которому присоединяется фермент РНК-полимераза, представляет собой особое сочетание нуклеотидов. Перед единицей транскрипции, после нее, иногда в интронах находятся регуляторные элементы (РЭ), к которым относятся энхансеры и сайленсеры. Энхансеры ускоряют транскрипцию, сайленсеры тормозят ее.

Транскрипция у эукариот
Транскрипция — синтез РНК на матрице ДНК. Осуществляется ферментом РНК-полимеразой.
РНК-полимераза может присоединиться только к промотору, который находится на 3'-конце матричной цепи ДНК, и двигаться только от 3'- к 5'-концу этой матричной цепи ДНК. Синтез РНК происходит на одной из двух цепочек ДНК в соответствии с принципами комплементарности и антипараллельности. Строительным материалом и источником энергии для транскрипции являются рибонуклеозидтрифосфаты (АТФ, УТФ, ГТФ, ЦТФ).

Транскрипция и процессинг происходят в клеточном ядре. Зрелая иРНК приобретает определенную пространственную конформацию, окружается белками и в таком виде через ядерные поры транспортируется к рибосомам; иРНК эукариот, как правило, моноцистронны (кодируют только одну полипептидную цепь).
Трансляция
Трансляция — синтез полипептидной цепи на матрице иРНК.
Органоиды, обеспечивающие трансляцию, — рибосомы. У эукариот рибосомы находятся в некоторых органоидах — митохондриях и пластидах (70S-рибосомы), в свободном виде в цитоплазме (80S-рибосомы) и на мембранах эндоплазматической сети (80S-рибосомы). Таким образом, синтез белковых молекул может происходить в цитоплазме, на шероховатой эндоплазматической сети, в митохондриях и пластидах. В цитоплазме синтезируются белки для собственных нужд клетки; белки, синтезируемые на ЭПС, транспортируются по ее каналам в комплекс Гольджи и выводятся из клетки. В рибосоме выделяют малую и большую субъединицы. Малая субъединица рибосомы отвечает за генетические, декодирующие функции; большая — за биохимические, ферментативные.
В малой субъединице рибосомы расположен функциональный центр (ФЦР) с двумя участками — пептидильным (Р-участок) и аминоацильным (А-участок). В ФЦР может находиться шесть нуклеотидов иРНК, три — в пептидильном и три — в аминоацильном участках.
Для транспорта аминокислот к рибосомам используются транспортные РНК, тРНК (лекция №4). Длина тРНК от 75 до 95 нуклеотидных остатков. Они имеют третичную структуру, по форме напоминающую лист клевера. В тРНК различают антикодоновую петлю и акцепторный участок. В антикодоновой петле РНК имеется антикодон, комплементарный кодовому триплету определенной аминокислоты, а акцепторный участок на 3'-конце способен с помощью фермента аминоацил-тРНК-синтетазы присоединять именно эту аминокислоту (с затратой АТФ). Таким образом, у каждой аминокислоты есть свои тРНК и свои ферменты, присоединяющие аминокислоту к тРНК.
1 — антикодон;
2 — участок, связывающий аминокислоту.
Транспорт аминокислот к рибосомам:
1 — фермент; 2 — тРНК; 3 — аминокислота.
Двадцать видов аминокислот кодируются 61 кодоном, теоретически может быть 61 вид тРНК с соответствующими антикодонами. Но кодируемых аминокислот всего 20 видов, значит, у одной аминокислоты может быть несколько тРНК. Установлено существование нескольких тРНК, способных связываться с одним и тем же кодоном (последний нуклеотид в антикодоне тРНК не всегда важен), поэтому в клетке обнаружено всего около 40 различных тРНК.
Синтез белка начинается с того момента, когда к 5'-концу иРНК присоединяется малая субъединица рибосомы, в Р-участок которой заходит метиониновая тРНК (транспортирующая аминокислоту метионин). Следует отметить, что любая полипептидная цепь на N-конце сначала имеет метионин, который в дальнейшем чаще всего отщепляется. Синтез полипептида идет от N-конца к С-концу, то есть пептидная связь образуется между карбоксильной группой первой и аминогруппой второй аминокислот.
Затем происходит присоединение большой субъединицы рибосомы, и в А-участок поступает вторая тРНК, чей антикодон комплементарно спаривается с кодоном иРНК, находящимся в А-участке.
Пептидилтрансферазный центр большой субъединицы катализирует образование пептидной связи между метионином и второй аминокислотой. Отдельного фермента, катализирующего образование пептидных связей, не существует. Энергия для образования пептидной связи поставляется за счет гидролиза ГТФ.
Как только образовалась пептидная связь, метиониновая тРНК отсоединяется от метионина, а рибосома передвигается на следующий кодовый триплет иРНК, который оказывается в А-участке рибосомы, а метиониновая тРНК выталкивается в цитоплазму. На один цикл расходуется 2 молекулы ГТФ. В А-участок заходит третья тРНК, и образуется пептидная связь между второй и третьей аминокислотами.

Трансляция идет до тех пор, пока в А-участок не попадает кодон-терминатор (УАА, УАГ или УГА), с которым связывается особый белковый фактор освобождения. Полипептидная цепь отделяется от тРНК и покидает рибосому. Происходит диссоциация, разъединение субъединиц рибосомы.
Скорость передвижения рибосомы по иРНК — 5–6 триплетов в секунду, на синтез белковой молекулы, состоящей из сотен аминокислотных остатков, клетке требуется несколько минут. Первым белком, синтезированным искусственно, был инсулин, состоящий из 51 аминокислотного остатка. Потребовалось провести 5000 операций, в работе в течение трех лет принимали участие 10 человек.
Транскрипция и трансляция у прокариот
- В результате транскрипции образуется полицистронная иРНК, кодирующая несколько белков, совместно обеспечивающих определенную группу реакций.
- иРНК имеет несколько центров инициации трансляции, терминации трансляции и НТО.
- Не происходят КЭПирование, полиаденилирование и сплайсинг иРНК.
- Трансляция начинается еще до завершения транскрипции; эти процессы не разделены во времени и пространстве, как это имеет место у эукариот.

1 — ДНК; 2 — РНК-полимераза; 3 — Нуклеозидтрифосфаты ГТФ, ЦТФ, АТФ, УТФ.
Именно пептидная связь является основой построения всех белковых молекул, из которых, в конечном счете, образуется вся живая материя. Особенности строения пептидной связи, ее структура оказали огромное влияние на саму возможность существования жизни на нашей планете. О том, что такое пептидная связь, как она образуется и какими свойствами обладает, читайте дальше.
Определение
Пептидная связь это связь, возникающая между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-COOH). Две соединенные одна с другой кислоты образуют дипептид, три – трипепетид и так далее. Длинные цепи подобного рода зовутся полипептидами и белками.
Также академическое определение пептидной связи звучит так: пептидная связь – это вид химической связи, возникающей вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.
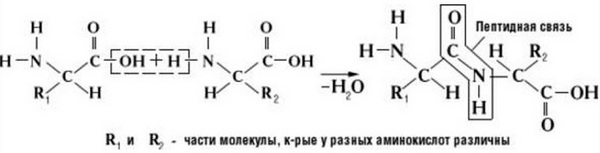
Образование
Как образуется пептидная связь? Образование пептидной связи происходит внутри клеток на рибосомах при активном участии ферментов с затратой энергии. Аминокислоты при этом, будучи мономерами, играют роль таких себе строительных блоков белков. Для синтеза белка живыми организмами используется 20 видов различных аминокислот.
Что же касается самого процесса образования пептидной связи между аминокислотами, то она образуется при оттягивании электронной плотности с атома водорода аминогруппы одной аминокислоты и атомом кислорода карбоксильной группы другой аминокислоты.
Вот так процесс образования пептидной связи в молекуле выглядит схематически.
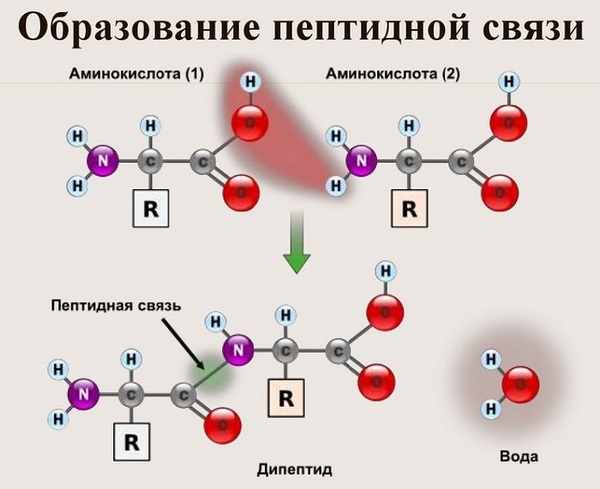
Как следствие разрываются соединения между N и H в аминогруппе и между C и OH в карбоксильной группе. Соединение протона и гидроксильной группы в результате образует воду, а два аминокислотных остатка – дипептид.
Свойства
Пептидная связь, которая имеет место при первичной структуре белков, не является полностью одинарной. Длина ее равна 0,132 нм. Это среднее значение между истинной двойной и одинарной связями.
Важными свойствами пептидной связи являются копланарность и трансположение, далее подробно их поясним.
Копланарность означает, что все атомы, входящие в пептидную группу находятся на одной плоскости, а атомы H и О располагаются по разные стороны от пептидной связи. Но стоит заметить, что радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Трансположение означает, что кислород и водород пептидной связи находятся в транс-ориентации. Также в транс-ориентации ориентированы аминокислотные R-группы во всех белковых и пептидных молекулах естественного происхождения.
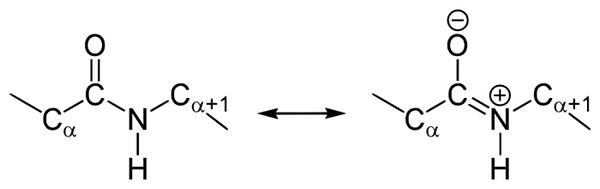
Строение
В чем особенности строения пептидной связи? В амидной группе –CO-NH- углеродный атом существует в форме sp 2 -гибридизации. К примеру, электронная пара атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом. Тогда электронная плотность пептидной группы сместится к кислороду. В результате подобного сопряжения выровняются длины связей внутри радикала.
Структура подобной пептидной связи и формула отражена на картинке.
Методы определения связей
Наилучшим методом для определения пептидных связей является биуретовая реакция. Такое название она имеет потому, что впервые эта реакция была использована для получения биурета, который хотя и не является аминокислотой, но обладает при этом двумя пептидными связями.
Сам механизм определения сводится к тому, что аминокислоты, способные образовать как минимум две пептидные связи в щелочной среде при добавлении сульфата меди образуют медьсодержащее комплексное соединение фиолетового цвета.
Читайте также:

