Как сделать пасть гены
Добавил пользователь Дмитрий К. Обновлено: 04.10.2024
Все началось в 1987 г., когда в бактериальной ДНК были обнаружены странные нуклеотидные повторы, разделенные небольшими участками уникальных последовательностей. Спустя десять лет было показано, что эти повторенные последовательности, названные CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), являются системой адаптивного иммунитета бактерий – способом защиты против чужеродной ДНК, в частности, против бактериальных вирусов (бактериофагов).
Узнавание мишени происходит по знаменитому принципу комплементарности, по которому образуются пары нуклеотидов в двуспиральной структуре ДНК. Этот принцип работает во всех живых организмах на нашей планете, включая клетки человека. Поэтому главное в механизме CRISPR/Cas – его простота и универсальность.
Знаковое событие случилось в 2012 г., когда была опубликована совместная работа француженки Э. Шарпентье и американки Д. Дудна, где было показано, что бактериальная система CRISPR/Cas может быть использована для внесения разрывов в последовательность любой ДНК, что свидетельствовало об ее огромном потенциале для редактирования геномов (Jinek et al., 2012). Ведь, зная нуклеотидную последовательность, можно внести разрыв в точно выбранное место любой ДНК.
Ремонтируем ДНК направленно
В теории все это выглядит прекрасно, но вот в чем вопрос: в организме взрослого человека имеются десятки триллионов клеток, и в каждой из них содержится мутантный ген. Как эти подходы применить на практике? Как лечить реального пациента?
На самом деле в большинстве случаев нет нужды исправлять мутацию в каждой клетке организма. Например, серповидноклеточная анемия вызвана мутациями в гене, кодирующем субъединицу гемоглобина, что приводит к дисфункции только клеток крови – эритроцитов. А наследственные нейродегенеративные заболевания, например боковой амиотрофический склероз, связаны с гибелью нейронов определенных типов. Таким образом, мишенями для терапии многих генетических заболеваний могут быть клетки лишь определенных органов или тканей, где специфично синтезируются/не синтезируются продукты мутантных генов.
Относительно простой и эффективный способ получения стволовых клеток из клеток кожи в результате репрограммирования был изобретен в 2006 г. японскими исследователями К. Такахаси и С. Яманака (Takahashi & Yamanaka, 2006). Таким образом, появился метод вернуть практически любую клетку организма (крови, кожи, жировой ткани и т. д.) в состояние стволовой.
Возможность использования ИПСК для клеточной терапии наследственных заболеваний была впервые продемонстрирована на модели серповидноклеточной анемии (Hanna et al., 2007). В геном лабораторных мышей были встроены мутантные гены человека, приводящие к развитию этой болезни.
Из клеток кожи этих животных были получены индуцированные плюрипотентные стволовые клетки, в которых мутация была исправлена с помощью гомологичной рекомбинации. Путем направленной дифференцировки из этих клеток были получены стволовые предшественницы клеток крови, которые трансплантировали в организм животных. Последние не только прижились, но и превратились в здоровые эритроциты. Лечение оказалось успешным.
С тех пор cписок наследственных болезней, для которых успешно был опробован этот подход, пополнился десятками наименований и продолжает расти.
Активно развиваются и невирусные способы доставки, например, упаковка готовых молекулярных комплексов РНК-белок в липосомы (липидные пузырьки) или полимерные частицы. Это более безопасно, а также обеспечивает более строгий контроль над дозой.
Это все здорово, но…
Но, к примеру, в случае гемофилии B жизнеспособность клеток после исправления мутации не повышается. Тем не менее уже 3—7 % клеток печени, продуцирующих нормальный фактор свертывания крови, достаточно для устойчивого терапевтического эффекта (Ohmori et al., 2017).
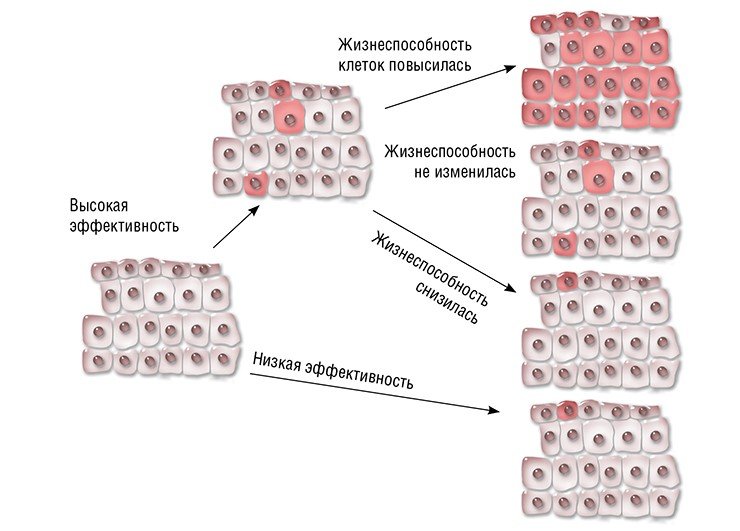
Что же касается исправления мутаций в онкогенах, то жизнеспособность и скорость пролиферации таких клеток будет снижаться относительно раковых, поэтому эффективность подобной терапии вызывает сомнения.
Тем не менее пример гемофилии B показывает, что если заболевание связано с отсутствием какого-то фермента или гормона, то небольшого числа клеток, его продуцирующих, может хватить, по крайней мере, для перевода болезни в более мягкую форму, а в некоторых случаях и для полного восстановления утраченных функций.
Система CRISPR/Cas9 открывает перед человечеством большие перспективы, но нужно понимать, что это не волшебная палочка для решения всех проблем, а инструмент, такой, как, например, молоток. И нужно учиться применять этот инструмент для каждой конкретной задачи.
Главный шаг, который уже был сделан в этой области, – это выход за пределы лабораторий. Уже существует ряд компаний, занимающихся внедрением технологии CRISPR/Cas в практику, и не только медицинскую. Этот подход, к примеру, используется сегодня для получения модифицированных микробов для нужд биотехнологии и модифицированных растений.
И здесь возникает очень серьезный этический вопрос: имеем ли мы право вмешиваться в ДНК человека? Или, наоборот, этично ли бездействовать, обрекая будущего ребенка на страдания?
Генетические изменения, внесенные в эмбрионы, сохранятся во всех клетках взрослого организма, и, соответственно, будут передаваться по наследству. Какой эффект окажет распространение таких модифицированных генов на человеческую популяцию в эволюционном аспекте, не говоря уже о риске возникновения новых евгенических движений?
Именно поэтому Д. Дудна, имеющая колоссальный авторитет в научном мире, призывает своих коллег не торопиться с применением этой технологии на эмбрионах человека, пока не будут разработаны международные этические и законодательные нормы для ее регулирования. В наши дни по всему миру проходят встречи, конференции, конгрессы и симпозиумы, на которых обсуждается будущее CRISPR/Cas. Возможно, от решений, которые будут приняты на них сейчас, зависят судьба человечества и то, как будет выглядеть наш мир в будущем.
В сентябре 2018 г. в новосибирском Академгородке также планируется провести международный конгресс по современным технологиям редактирования геномов, на котором будет обсуждаться технология CRISPR/Cas и, в частности, ее будущее в Российской Федерации.
Немудрый А. А., Валетдинова К. Р., Медведев С. П. и др. Системы редактирования геномов TALEN и CRISPR/Cas – инструменты открытий // Acta Naturae. 2014. Т. 6. № 3(22). С. 20—42.
Cox D. B., Platt R. J., Zhang F. Therapeutic genome editing: prospects and challenges // Nat Med. 2015. V. 21. N. 2. P. 121—131.
Jinek M., Chylinski K., Fonfara I. et al. A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity // Science. 2012. V. 337. N. 6096. P. 816—821.
Ma H., Marti-Gutierrez N., Park S. W. et al. Correction of a pathogenic gene mutation in human embryos // Nature. 2017. V. 548. N. 7668. P. 413—419.

ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом – эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки – гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
- 22 пары аутосом одинаковы у мужчин и женщин. В каждой паре хромосомы имеют одинаковую длину и содержат одинаковые наборы генов.
- Одна пара половых хромосом. У женщин это две X-хромосомы. Одна из них неактивна и плотно свернута – ее называют тельцем Барра. У мужчин одна половая хромосома представлена X-хромосомой, а вторая – Y-хромосомой, она меньше по размерам.
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод – световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
- Грубые изменения в кариотипе – изменение количества хромосом. Например, при синдроме Дауна в клетках ребенка присутствует лишняя хромосома №21.
- Присутствие в организме клеток с разными кариотипами. Это явление называется мозаицизмом.
- Хромосомные аберрации – нарушение структуры хромосом, внутрихромосомные и межхромосомные перестройки. Сюда относятся делеции (утрата участка хромосомы), дупликации (удвоение участка хромосомы), инверсии (поворот участка хромосомы на 180 градусов), транслокации (перенос участка одной хромосомы в другую).

Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:

Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
С помощью ХМА можно выявлять:
- изменения числа хромосом;
- дупликации и делеции, в том числе микродупликации и микроделеции;
- отсутствие гетерозиготности – утрату одной из двух копий гена. Это явление имеет важное значение в онкологии, при болезнях импринтинга (когда активность гена зависит от того, от какого из родителей он получен), аутосомно-рецессивных заболеваниях (связанных с рецессивными генами – о них мы поговорим ниже), близкородственных браках;
- однородительские дисомии, когда в геноме ребенка присутствуют две хромосомы от одного родителя.
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
Мутации в генах и заболевания, к которым они способны приводить
Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы.
Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома – тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS – определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.

Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4–10 бластомеров). Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38–40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант – исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
- биопсия хориона – когда берут клетки из плаценты;
- амниоцентез – когда берут клетки амниотической жидкости.
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.

Автор статьи
Пелина Ангелина Георгиевна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
1. Эпителий
Уменьшение или отсутствие эпителия в мазке – на атрофические изменения, недостаток эстрадиола или избыток андрогенов.
2. Лейкоциты
- влагалища принято 10,
- цервикального канала – до 25,
- а в уретре – не более 5 лейкоцитов в поле зрения.
Повышение показателя – очевидно, свидетельствует о воспалении, а полное отсутствие может иметь место в норме в самом начале цикла.
Слизь
Флора
Преобладающей флорой женских половых путей в норме у женщин репродуктивного возраста, как известно, являются лактобактерии (или палочки Дедерлейна). Количество которых может быть от умеренного до обильного, в том зависимости, в том числе, от фазы менструального цикла.
Патологические элементы
Присутствия мицелия грибов, трихомонад, диплококков (в том числе и возбудитель гонореи), лептотрикса, мобилункуса и прочих патогенных микроорганизмов в нормальном мазке не допускается, даже в минимальном количестве. А их выявление – серьезный повод незамедлительно обратиться за лечением.
По мнению большинства обывателей, наследование индивидуальных черт строения тела, болезней и предрасположенностей к тем или иным видам деятельности – это генетическая рулетка. Однако, это не так. По данным исследований, проведенных британскими учеными, наследование генов от отца и матери происходит в равной мере, однако агрессивность последних различна. Отцовские гены имеют более выраженную агрессивность, именно поэтому ребенок так часто имеет сходные внешние черты с отцом.

Генотип мужчины можно схематично представить как XY, что означает различный состав половых хромосом у представителей мужского пола. Y-хромосома содержит сцепленные с ней аллельные гены, которые специфичны только для мужской ДНК.
Отцовская хромосома определяет пол ребенка
Пол ребенка формируется посредством передачи половой хромосомы от матери (всегда Х) и половой хромосомы от отца (может быть как Х, так и Y – вероятность того или иного исхода 50%). Если в процессе образования зиготы сперматозоид передаст Y-хромосому, то на свет родится мальчик, если X-хромосому, то появится девочка.
Механизм, отвечающий за передачу той или иной части ДНК мужчины, до сих пор неизвестен. Однако имеется статистический факт, согласно которому: если у родителей мужчины рождались преимущественно дочки, то скорее всего большинство его детей будут иметь женский пол, и, наоборот, если у родителей мужчины на свет появлялись в основном мальчики, то его дети будут иметь мужской пол. По поводу мужчин, у которых нет родных братьев и сестер, однозначно нельзя предсказать пол будущих детей.
Заболевания, передающиеся от отца к сыну
К сожалению, гены, связанные с Y-хромосомой, всегда имеют доминантный характер. Существует большое количество заболеваний, которые передаются только от отца к сыну:
- синдактилия (это сращивание пальцев);
- раннее облысение (может проявиться в связи с высоким андрогенным фоном у ребенка, например, при использовании стероидных лекарственных средств);
- ихтиоз (покровный эпителий не слущивается, в результате чего кожа человека напоминает рыбью чешую);
- гипертрихоз (развитие волосяного покрова в ушных раковинах).
Также существуют исследования, которые декларируют, что предрасположенность к заболеваниям сердечно-сосудистой системы также передается от отца к сыну. Девочки не наследуют от отцов предрасположенность к развитию заболеваний, связанных с патологическими изменениями в функционировании сердечно-сосудистой системы.
Заболевания, передающиеся от отца к дочери
Однако если папина Х-хромосома все же окажется доминантной, то у дочери могут развиться следующие патологии:
- синдром Мартина-Белл (у человека нарушается развитие межнейронных связей, в результате чего ему трудно дается запоминание и обучение);
- синдром Блоха (при данном заболевании у женщины происходит практически в ста процентах случаев внутриутробная гибель плода);
- Орофационально-цифровой синдром первого типа (данная патология характеризуется наличием пороков развития лица, полости рта, а также поликистозом почек).
Отцовские гены определяют рост ребенка
Согласно современным научным данным рост ребенка определяется более чем восьмьюдесятью генами, которые наследуются от папы и от мамы. Однако существуют исследования, которые указывают на то, что рост ребенка в большей степени зависит от отцовских генов. Подтверждением данной теории является тот факт, что инсулиноподобный фактор роста (посредник действия гормона роста) экспрессируется генами, которые сцеплены с мужской хромосомой. Гены матери экспрессируют инсулиноподобный рецептор гормона роста, который посредством связывания соматотропного гормона, замедляет рост человека.
Британские ученые в недавних исследованиях обнаружили занимательный факт: чем старше отец, тем более высокие получаются дети. На данный момент биологического обоснования этому факту нет, однако существует целый статистические перечень, подтверждающий обнаруженную в Англии закономерность.
Случай из нашей практики
К сожаление, к нам часто обращаются клиенты с целью провести тест на отцовство или материнство, в случае, когда у ребенка обнаруживается то или иное генетическое заболевание. Потому что не понимают, как, например, абсолютно здоровый отец может передать ребенку генетическое заболевание. Но это не совсем так. Оба родители могут иметь определенный набор генов, отвечающие за предрасположенность к конкретному заболеванию, и эти предрасположенности могу подавляться "нормальными генами". Например, если оба родители не болеют муковисцидозом, но являются носителями этого гена, то с вероятностью 25% у них может родится ребенок с таким заболеванием.
Читайте также:

