Как сделать овр в органике
Обновлено: 04.07.2024
Основные правила составления окислительно-восстановительных реакций
Существует несколько основных правил, которые сильно упрощают составление окислительно-восстановительных реакций. Более подробно эти и другие правила рассматривается на других страницах этого раздела, но для ЕГЭ достаточно знать правила из этого списка.
Реакции простых веществ: металлов и неметаллов с щелочами, кислотами и солями:
1.1) Из металлов только Al, Zn и Be взаимодействуют со щелочами с выделением водорода:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
1.2) Из неметаллов только S, P, Si и галогены реагируют с щелочами:
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2.1) Металлы ( стоящие в ряду активности металлов до H2) реагируют с кислотами-неокислителями с выделением водорода:
2HCl + Fe → FeCl2 + H2
H2SO4(р) + Fe → FeSO4 + H2
2.2) Все металлы, кроме Pt и Au, реагируют с кислотами-окислителями без выделения водорода:
2H2SO4(к) + 2Ag → Ag2SO4 + SO2 + 2H2O
6H2SO4(к) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
2.3) Более сильные металлы вытесняют более слабые из растворов их солей:
3) Неметаллы не реагируют с кислотами-неокислителями:
C + HCl → реакция не идет
4) Такие неметаллы, как S, C, P могут реагировать с солями, проявляющими окислительные свойства (KClO3, KNO3 в расплавленном состоянии):

C + 2KNO3 (расплав) → CO2 + 2KNO2

S + 2KNO3 (расплав) → SO2 + 2KNO2
Важная реакция получения фосфора:
5) Из неметаллов только S, C, и P реагируют с кислотами-окислителями (в рамках ЕГЭ), а также I2 с HNO3(к):
C + H2SO4(конц.) → CO2 + 2SO2 + 2H2O (t)

S + 2H2SO4(конц.) → 3SO2 + 2H2O (t)

2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)

C + 4HNO3(конц.) → CO2 + 4NO2 + 2H2O

P + 5HNO3(конц.) → H3PO4 + 5NO2 + H2O

S + 6HNO3(конц.) → H2SO4 + 6NO2 + 2H2O

I2 + 10HNO3(к) → 2HIO3 + 10NO2+ 4H2O (t, другие галогены с кислотами не реагируют)
Фосфор
1) Наиболее устойчивая степень окисления фосфора +5, следовательно, любые другие соединения фосфора окисляются сильными окислителями до этой степени окисления (с образованием P2O5 или фосфат-иона):
Азот
1) Аммиак, как правило, окисляется до азота N2:

8NH3 + 3KBrO4 → 3KBr + 4N2 + 12H2O

2NH3 + 3CuO → 3Cu + N2 + 6H2O
Исключением является каталитическое окисление аммиака:
4NH3 + 5O2 → 4NO + 6H2O (катализатор)
Обычное горение аммиака протекает с образованием N2 (как и горение любых органических азотсодержащих соединений):
4NH3 + 3O2 → 2N2 + 6H2O
2) Нитрит-ионы окисляются до нитрат-ионов:

3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2 + 2KOH
3) Нитрит-ионы восстанавливаются до азота в реакциях с солями аммония:

NaNO2 + NH4Cl → N2 + NaCl + 2H2O (по сути, идет разложение нитрита аммония: NH4NO2 → N2 + 2H2O)

Ca(NO2)2 + (NH4)2SO4 → 2N2 + CaSO4 + 4H2O
4) Нитрит-ионы восстанавливаются до оксида азота (II) в реакциях с типичными восстановителями: HI, йодидами, солями Fe +2 и др.:

2KNO2 + 2KI + 2H2SO4 → 2NO + I2 + 2K2SO4 + 2H2O

HNO2 + 2HI → 2NO + I2 + 2H2O
Следующий тип реакций встречается в вариантах Ю.Н. Медведева.
5) Нитрат-ионы могут восстанавливаться до нитрит-ионов (соединениями Cr, Mn, Fe, сплавление в щелочной среде):
6) Восстановление нитратов до аммиака в реакциях с такими металлами, как Al, Zn, Mg (встречается очень редко):

3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3 + 8Na[Al(OH)4]

NaNO3 + 4Zn + 7NaOH + 6H2O → NH3 + 4Na2[Zn(OH)4]
KNO3 + 4Mg + 6H2O → NH3 + 4Mg(OH)2 + KOH
Кислород
1) Перекись водорода окисляется до кислорода O2 типичными окислителями:
KMnO4, K2Cr2O7, галогены, соли кислородсодержащих кислот хлора (например, KClO3) и некоторыми другими.

5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O
2) Перекись водорода восстанавливается до H2O типичными восстановителями:
KI (HI, йодиды), K2SO3 (SO2, сульфиты), KNO2 (нитриты), PbS (H2S, сульфиды), соединения Cr +3 в щелочной среде, соединения Fe +2 , NH3 и некоторыми другими.
Галогены
1) Галогены диспропорционируют в щелочах:
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2) Простые вещества галогены и соединения галогенов в любой положительной степени окисления восстанавливаются, как правило, до галогенид-ионов (т.е. до ст. ок. -1) в реакциях с типичными восстановителями:
KClO3 + 6Fe(OH)2 + 18HCl → 6FeCl3 + KCl + 15H2O
2Br2 + CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
3) Галогенид-ионы окисляются, как правило, до простых веществ: Cl2, Br2, I2:
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
16HCl + 2KMnO4 → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
4) Йодид меди восстанавливает серную кислоту до SO2, тогда как йодиды активных металлов до H2S:
5) Концентрированной серной кислотой окисляются только бромид- и йодид-ионы. В первом случае образуется SO2, во втором H2S.
Сера
1) Сульфид-ионы обычно окисляются до S типичными окислителями: Br2, I2, растворами солей K2Cr2O7, KMnO4 и др.:
3Na2S + K2Cr2O7 + 7H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O
5Na2S + 2KMnO4 + 16HCl → 5S + 2MnCl2 + 10NaCl + 2KCl + 8H2O
H2S + Br2 → S + 2HBr
H2S + H2O2 → S + 2H2O (образование H2SO4 возможно, зависит от условий задания)
2) С H2SO4(к) сероводород и сульфиды реагируют с образованием SO2, аналогично реакции кислоты с серой:
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O (t)

K2S + 4H2SO4(конц.) → K2SO4 + 4SO2 + 4H2O
В этой реакции сульфид-ион окисляется до SO2: S –2 -6e → S +4 .
Часть сульфат-ионов восстанавливается также до SO2 и часть остается для образования соли K2SO4.
3) Окисление H2S и сульфидов до сульфат-ионов протекает в реакциях с такими окислителями, как Cl2 в воде, H2O2, HNO3(конц.) при нагревании:

H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O (образование S будет считаться ошибкой!)
PbS + 4H2O2 → PbSO4 + 4H2O (черный сульфид свинца превращается в белый сульфат)
4) Сульфит-ионы любыми окислителями окисляются до сульфат-иона:
3Na2SO3 + 2KMnO4 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
Медь
1) Соединения Cu +2 окисляют соединения S +4 и I – (восстанавливаясь до Cu +1 ):
2CuCl2 + SO2 + 2H2O → 2CuCl + 2HCl + H2SO4
2Cu(NO3)2 + 4KI → 2CuI + I2 + 4KNO3

В реакции с аммиаком выделяется металлическая медь:
3CuO + 2NH3 → N2 + 3Cu + 3H2O
2) Йодиды меди реагируют с H2SO4(к) с образованием SO2, тогда как йодиды щелочных металлов с образованием H2S:
3) Медь по-разному реагирует с галогенами:
Cu + Cl2 → CuCl2
Cu + Br2 → CuBr2
2Cu + I2 → 2CuI (соль меди +1)
4) Медь в степени окисления +2 восстанавливается самой медью:
CuO + Cu → Cu2O (t)
CuCl2 + Cu → 2CuCl (t).
Железо
1) Соединения Fe +3 окисляют соединения S –2 , S +4 , I – и некоторые слабые металлы (восстанавливаясь до Fe +2 ):

Fe2O3 + 6HI → 2FeI2 + I2 + 3H2O
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl

2FeCl3 + H2S → 2FeCl2 + S + 2HCl
2FeCl3 + Cu → CuCl2 + 2FeCl2 (соль железа +2)
2) В кислой среде соединения Fe +2 окисляются такими окислителями, как KMnO4, K2Cr2O7, HNO3, H2SO4(к) и др. до солей Fe +3 :
3) Железо по-разному реагирует с галогенами:
4) Соединения Fe +2 , Fe +3 также могут быть окислены до степени окисления +6 (до ферратов, например, Na2FeO4) очень сильными окислителями, но на ЕГЭ знание этих реакций не проверяется (источник: вебинары от разработчиков экзамена):
3FeSO4 + 2NaClO3 + 12NaOH → 3Na2FeO4 + 2NaCl + 3Na2SO4 + 6H2O.
Марганец
1) В кислой среде образуются соли Mn +2 :
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4

2) В щелочной среде образуется манганат-ион MnO4 2– (зеленого цвета):
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
3) В нейтральной среде образуется осадок бурого цвета MnO2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4
2KMnO4 + 3K2S + 4H2O → 2MnO2 + 3S + 8KOH
K2MnO4 + Na2S + 2H2O → S + MnO2 + 2NaOH + 2KOH
Хром

1) Восстановление дихроматов в кислой среде протекает с образованием солей Cr +3 :
Na2Cr2O7 + 6NaI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
2) Окисление соединений Cr +2 в кислой среде протекает с образованием солей Cr +3 :
3) Окисление соединений Cr +3 очень сильными окислителями с щелочами или с карбонатами щелочных металлов протекает с образованием хроматов (типичные окислители: KNO3, Cl2, KClO3, H2O2 и др. в щел. среде):
4) Соединения Cr +6 в различных средах:
В щелочной среде устойчивы соли хромовой кислоты (хроматы, желтого цвета), например, Na2CrO4.
В кислой среде устойчивы соли дихромовой кислоты (дихроматы, оранжевого цвета), например, Na2Cr2O7.
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O (в кислотной среде желтая окраска переходит в оранжевую).
Na2Cr2O7 + 2NaOH → 2Na2CrO4 + H2O (в щелочной среде оранжевая окраска переходит в желтую).
Среда раствора
1) С карбонатами щелочных металлов реакции протекают аналогично щелочной среде реакции:
2) Если в реакцию вступает оксид серы (IV) SO2 в нейтральном растворе, то реакция протекает аналогично кислой среде раствора:
Поэтому очень важно не зубрить окислительно-восстановительные реакции, а знать какие соединения проявляют окислительные, а какие восстановительные свойства, и знать основные правила, приведенные выше.

Окислительно-восстановительные реакции в органической химии представляют наибольший интерес, т.к. переход из одной степени окисления в другую сильно зависит от правильного выбора реагента и условий проведения реакций. ОВР изучают в обязательном курсе химии недостаточно полно, но в контрольно-измерительных материалах ЕГЭ встречаются не только в заданиях С1 и С2 , но и заданиях СЗ, представляющих цепочку превращений органических веществ.

ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В ОРГАНИЧЕСКОЙ ХИМИИ
Окислительно-восстановительные реакции в органической химии представляют наибольший интерес, т.к. селективность перехода из одной степени окисления в другую сильно зависит от правильного выбора реагента и условий проведения реакций.
Но ОВР изучают в обязательном курсе химии недостаточно полно. Следует обратить особое внимание учащихся на окислительно-восстановительные процессы, происходящие с участием органических веществ. Это связано с тем, что окислительно-восстановительные реакции в контрольно-измерительных материалах ЕГЭ встречаются не только в заданиях С1 и С2 , но и заданиях СЗ, представляющих цепочку превращений органических веществ.

С3 . Задания этого блока проверяют знания по органической химии
В цепочках превращений органических веществ в подавляющем большинстве заданий встречаются ОВР. Эксперт имеет право начислить балл только в том случае, если записано уравнение, а не схема реакции, т.е. верно расставлены коэффициенты. В реакциях с участием неорганических окислителей (перманганат калия, соединения хрома ( VI ), пероксид водорода и др.) сделать это бывает непросто, без электронного баланса.

Определение степени окисления атомов в молекулах органических соединений
СО (атома) = число связей с более ЭО атомами минус число связей с менее ЭО атомами.
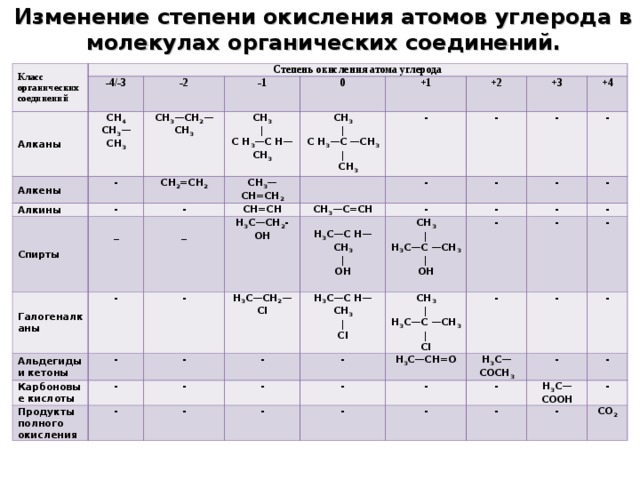
Изменение степени окисления атомов углерода в молекулах органических соединений.
Класс органических соединений
Степень окисления атома углерода
CH 3 —CH 3
CH 3 —CH 2 —CH 3
CH 3 | C H 3 —C H—CH 3
CH 2 =CH 2
CH 3 —CH=CH 2
Галогеналканы
CH 3 | C H 3 —C —CH 3 | CH 3
Альдегиды и кетоны
CH 3 —C=CH
Карбоновые кислоты
H 3 C—CH 2 - ОН
H 3 C—CH 2 — CI
Продукты полного окисления
H 3 C—C H—CH 3 |
CH 3 | H 3 C — C — CH 3 | OH
H 3 C — C H — CH 3 |
CH 3 | H 3 C — C — CH 3 | CI
H 3 C—CH =O
H 3 C—C OCH 3
H 3 C—C OOH


Склонность органических соединений к окислению связывают с наличием:
1.МЯГКОЕ ОКИСЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Для мягкого окисления органических соединений (спиртов, альдегдов, непредельных соединений) используются соединения хрома ( VI ) – оксид хрома ( VI ), CrO 3 , дихромат калия К 2 С r 2 O 7 и др. Как правило, окисление проводится в кислой среде, продуктами восстановления являются соли хрома ( III ), например:
3CH 3 –CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 –COOH + 4K 2 SO 4 + Cr 2 (SO 4 ) 3 + 4H 2 O
3CH 3 –CH 2 OH+2K 2 Cr 2 O 7 +8H 2 SO 4 →3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4 ) 3 + 11H 2 O
При окислении спиртов дихроматом калия на холоду окисление можно остановить на стадии образования альдегида, при нагревании же образуются карбоновые кислоты:
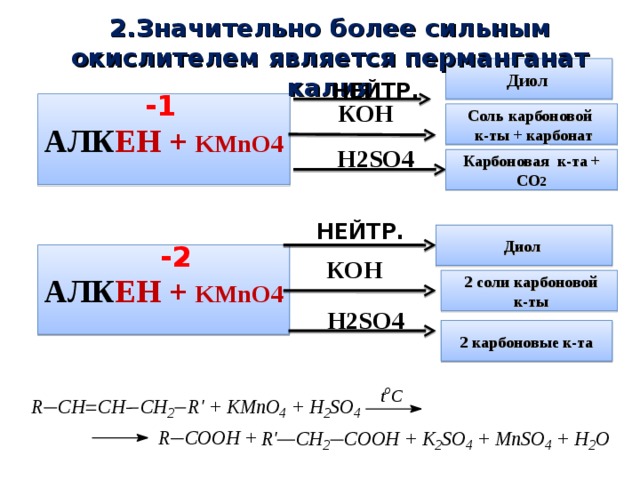
2.Значительно более сильным окислителем является перманганат калия
АЛК ЕН + KMnO4
Соль карбоновой
к-ты + карбонат
Н 2SO4
Карбоновая к-та + СО 2
АЛК ЕН + KMnO4
2 соли карбоновой
Н 2SO4
2 карбоновые к-та
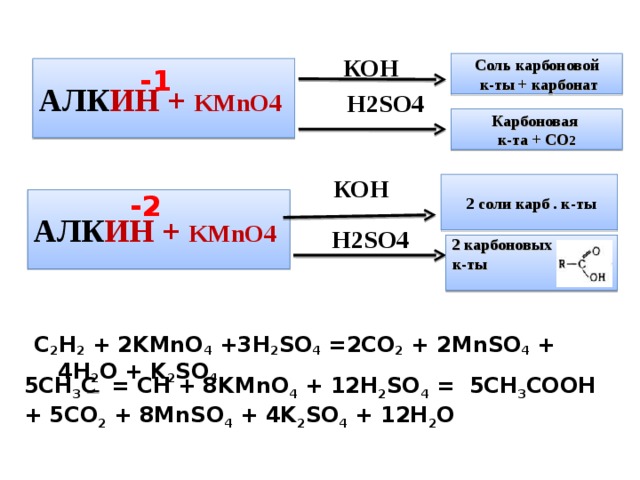
C 2 H 2 + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4
Соль карбоновой
к-ты + карбонат
АЛК ИН + KMnO4
Н 2SO4
к-та + СО 2
2 соли карб . к-ты
АЛК ИН + KMnO4
Н 2SO4
2 карбоновых
5CH 3 C = CH + 8KMnO 4 + 12H 2 SO 4 = 5CH 3 COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O
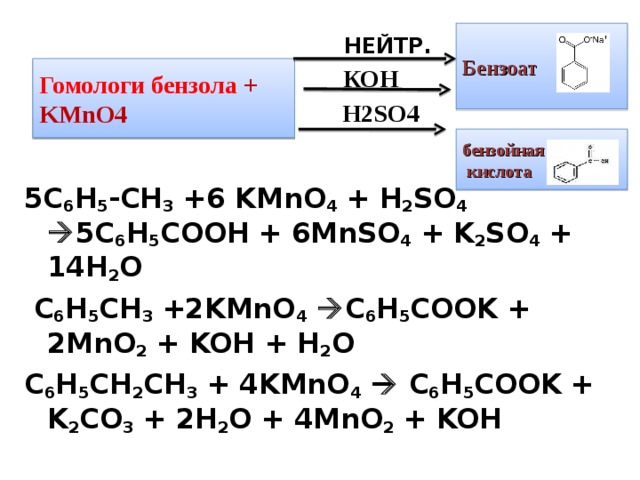
5C 6 H 5 -CH 3 +6 KMnO 4 + H 2 SO 4 5C 6 H 5 COOH + 6MnSO 4 + K 2 SO 4 + 14H 2 O
C 6 H 5 CH 3 +2KMnO 4 C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O
C 6 H 5 CH 2 CH 3 + 4KMnO 4 C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4MnO 2 + KOH
Гомологи бензола + KMnO4
Н 2SO4

Окислительно-восстановительные свойства кислородсодержащих соединений
Окислителями спиртов чаще всего являются оксид меди ( II ) или
перманганат калия, а окислителями альдегидов и кетонов - гидроксид меди ( II ), аммиачный раствор оксида серебра и другие
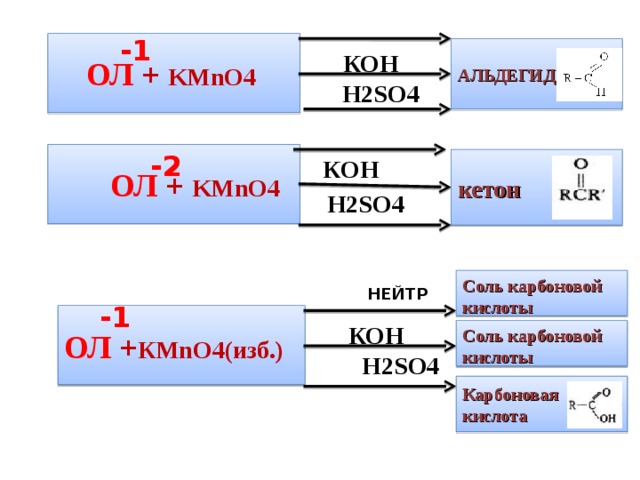
ОЛ + KMnO4
Н 2SO4
ОЛ + KMnO4
Н 2SO4
Соль карбоновой кислоты
ОЛ + К MnO4 (изб.)
Соль карбоновой кислоты
Н 2SO4
Карбоновая кислота
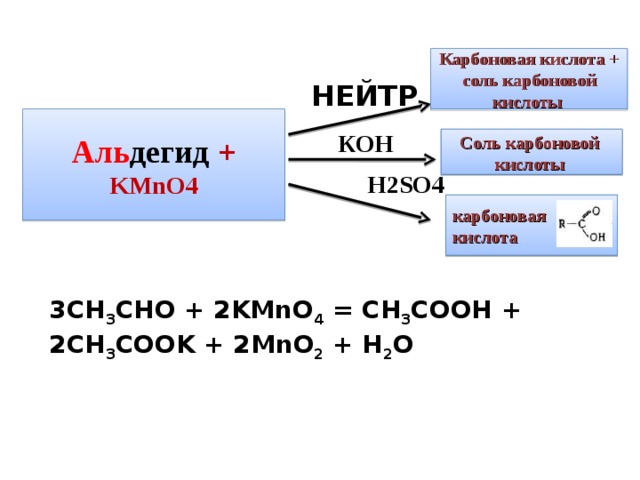
Карбоновая кислота +
соль карбоновой кислоты
Аль дегид + KMnO4
Соль карбоновой
Н 2SO4
3CH 3 CHO + 2KMnO 4 = CH 3 COOH + 2CH 3 COOK + 2MnO 2 + H 2 O
![Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями CH 3 CHO + 2[Ag(NH 3 ) 2 ]OH CH 3 COONH 4 + 2Ag + H 2 O + 3NH 3](https://fsd.multiurok.ru/html/2018/01/23/s_5a671b17bdb40/img14.jpg)
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями
CH 3 CHO + 2[Ag(NH 3 ) 2 ]OH CH 3 COONH 4 + 2Ag + H 2 O + 3NH 3
Алгоритм подбора коэффициентов
Поскольку в задании С3 при составлении уравнений ОВР не требуется написания уравнений электронного баланса, подбирать коэффициенты удобно методом подстрочного баланса – упрощенным способом баланса электронного.
1 . Составляется схема ОВР. Например, для окисления толуола до бензойной кислоты подкисленным раствором перманганата калия схема реакции такова:
С 6 Н 5 -СН 3 + KMnO 4 + H 2 SO 4 С 6 Н 5 -С OO Н + K 2 SO 4 + MnSO 4 + H 2 O
2. Указываются с.о. атомов. С.о. атома углерода определяется по приведенному выше способу.
3. Число электронов, отданных атомом углерода (6), записывается как коэффициент перед формулой окислителя (перманганата калия):
4. Число электронов, принятых атомом марганца (5), записывается как коэффициент перед формулой восстановителя (толуола):
5. Важнейшие коэффициенты на месте. Дальнейший подбор не составляет труда:
5 С 6 Н 5 -СН 3 + 6 KMnO 4 + 9 H 2 SO 4 5 С 6 Н 5 -С OO Н + 3 K 2 SO 4 + 6 MnSO 4 + 14 H 2 O
Пример тестового задания(С3)
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Hg 2+ , H + KMnO 4 , H + С l 2 (эквимол.), h
С 2 Н 2 Х 1 СН 3 СООН Х 2 СН 4 X 3
1. реакция Кучерова.
Hg 2+ , H +
CH CH + H 2 O CH 3 CHO
2.Альдегиды легко окисляются до карбоновых кислот, в том числе таким сильным окислителем, как перманганат калия в кислой среде.
CH 3 CHO + KMnO 4 + H 2 SO 4 CH 3 COOH + K 2 SO 4 + MnSO 4 + H 2 O
5 CH 3 CHO + 2 KMnO 4 + 3 H 2 SO 4 5 CH 3 COOH + K 2 SO 4 + 2 MnSO 4 + 3 H 2 O
3.Для выполнения следующего звена цепочки необходимо оценить вещество Х 2 с двух позиций: во-первых, оно в одну стадию образуется из уксусной кислоты, во-вторых, из него можно получить метан. Это вещество – ацетат щелочного металла. Записываются уравнения третьей и четвертой реакций.
CH 3 COOH + NaOH CH 3 COONa + H 2 O
4. CH 3 COONa + NaOH CH 4 + Na 2 CO 3
5.Условия протекания следующей реакции (свет) однозначно указывают на ее радикальный характер. С учетом указанного соотношения реагентов (эквимолярное) записывается уравнение последней реакции:
В ОВР органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода всегда образуется углекислый газ и вода. Сложнее протекают реакции при использовании менее активных окислителей. В этом параграфе рассмотрены только реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Алкены. При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
Алкины. Алкины начинают окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алканов, атомы-восстановители здесь – атомы углерода, связанные в данном случае тройной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
Иногда удается выделить промежуточные продукты окисления. В зависимости от положения тройной связи в молекуле это или дикетоны (R1–CO–CO–R2), или альдокетоны (R–CO–CHO).
Ацетилен может быть окислен перманганатом калия в слабощелочной среде до оксалата калия:
В кислотной среде окисление идет до углекислого газа:
Гомологи бензола. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
Окисление этих веществ дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
Спирты. Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. Все реакции идут при нагревании.
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислотной среде с раствором KMnO4 или K2Cr2O7 легко окисляется до углекислого газа и воды, но иногда удается выделить и промежуточные продукты (HOCH2–COOH, HOOC–COOH и др.).
Альдегиды. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH. Все реакции идут при нагревании:
Формальдегид с избытком окислителя окисляется до углекислого газа.
Из определений понятий " атом-окислитель" и " атом-восстановитель" следует, что только окислительными свойствами обладают атомы в высшей степени окисления. Наоборот, только восстановительными свойствами обладают атомы в низшей степени окисления. Атомы, находящиеся в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями.
Вместе с тем, основываясь только на степени окисления, невозможно однозначно оценить окислительно-восстановительные свойства веществ. В качестве примера рассмотрим соединения элементов VA группы. Соединения азота(V) и сурьмы(V) являются более или менее сильными окислителями, соединения висмута(V) – очень сильные окислители, а соединения фосфора(V) окислительными свойствами практически не обладают. В этом и других подобных случаях имеет значение, насколько данная степень окисления характерна для данного элемента, то есть, насколько устойчивы соединения, содержащие атомы данного элемента в этой степени окисления.
Любая ОВР протекает в направлении образования более слабого окислителя и более слабого восстановителя. В общем случае возможность протекания какой-либо ОВР, как и любой другой реакции, может быть определена по знаку изменения энергии Гиббса. Кроме того, для количественной оценки окислительно-восстановительной активности веществ используют электрохимические характеристики окислителей и восстановителей (стандартные потенциалы окислительно-восстановительных пар). Основываясь на этих количественных характеристиках, можно построить ряды окислительно-восстановительной активности различных веществ. Известный вам ряд напряжений металлов построен именно таким образом. Этот ряд дает возможность сравнивать восстановительные свойства металлов в водных растворах, находящихся в стандартных условиях (с = 1 моль/л, Т = 298,15 К), а также окислительные свойства простых аквакатионов. Если в верхней строке этого ряда поместить ионы (окислители), а в нижней – атомы металлов (восстановители), то левая часть этого ряда (до водорода) будет выглядеть так:
В этом ряду окислительные свойства ионов (верхняя строка) усиливаются слева направо, а восстановительные свойства металлов (нижняя строка), наоборот, справа налево.
Учитывая различия в окислительно-восстановительной активности в разных средах, можно построить аналогичные ряды и для окислителей. Так, для реакций в кислотной среде (pH = 0) получается " продолжение" ряда активности металлов в направлении усиления окислительных свойств
Как и в ряду активности металлов, в этом ряду окислительные свойства окислителей (верхняя строка) усиливаются слева направо. Но, используя этот ряд, сравнивать восстановительную активность восстановителей (нижняя строка) можно только в том случае, когда их окисленная форма совпадает с приведенной в верхней строке; в этом случае она усиливается справа налево.
Рассмотрим несколько примеров. Чтобы узнать, возможна ли данная ОВР будем использовать общее правило, определяющее направление протекания окислительно-восстановительных реакций (реакции протекают в направлении образования более слабого окислителя и более слабого восстановителя).
1. Можно ли магнием восстановить кобальт из раствора CoSO4?
Магний более сильный восстановитель, чем кобальт, и ионы Co 2 более сильные окислители, чем ионы Mg 2 , следовательно, можно.
2. Можно ли раствором FeCl3 окислить медь до CuCl2 в кислотной среде?
Так как ионы Fe 3B более сильные окислители, чем ионы Cu 2 , а медь более сильный восстановитель, чем ионы Fe 2 , то можно.
3. Можно ли, продувая кислород через подкисленный соляной кислотой раствор FeCl2, получить раствор FeCl3?
Казалось бы нет, так как в нашем ряду кислород стоит левее ионов Fe 3 и является более слабым окислителем, чем эти ионы. Но в водном растворе кислород практически никогда не восстанавливается до H2O2, в этом случае он восстанавливается до H2O и занимает место между Br2 и MnO2. Следовательно такая реакция возможна, правда, протекает она довольно медленно (почему?).
4. Можно ли в кислотной среде перманганатом калия окислить H2O2?
В этом случае H2O2 восстановитель и восстановитель более сильный, чем ионы Mn 2B , а ионы MnO4 окислители более сильные, чем образующийся из пероксида кислород. Следовательно, можно.
Аналогичный ряд, построенный для ОВР в щелочной среде, выглядит следующим образом:
В отличие от " кислотного" ряда, этот ряд нельзя использовать совместно с рядом активности металлов.
Метод электронно-ионного баланса (метод полуреакций), межмолекулярные ОВР, внутримолекулярные ОВР, ОВР дисмутации (диспропорционирования, самоокисления-самовосстановления), ОВР конмутации, пассивация.
- Используя метод электронно-ионого баланса, составьте уравнения реакций, протекающих при добавлении к подкисленному серной кислотой раствору перманганата калия раствора а) H2S 8>; б) KHS; в) K2S; г) H2SO3; д) KHSO3; е) K2SO3; ё) HNO2; ж) KNO2; и) KI 2>; к) FeSO4; л) C2H5OH 3COOH>; м) CH3CHO; н) (COOH)22>; п) K2C2O4. Здесь и далее в необходимых случаях в фигурных скобках указаны продукты окисления.
- Составьте уравнения реакций, протекающих при пропускании следующих газов через подкисленный серной кислотой раствор перманганата калия: а) C2H22>; б) C2H42>; в) C3H4 (пропин) 2 и CH3COOH>; г) C3H6; д) CH4; е) HCHO.
- То же, но раствор восстановителя добавлен к нейтральному раствору перманганата калия: а) KHS; б) K2S; в) KHSO3; г) K2SO3; д) KNO2; е) KI.
- То же, но в раствор перманганата калия предварительно добавлен раствор гидроксида калия: а) K2S 2SO4>; б) K2SO3; в) KNO2; г) KI 3>.
- Составьте уравнения следующих реакций , протекающих в растворе: а) KMnO4 + H2S . ;
б) KMnO4 + HCl . ;
в) KMnO4 + HBr . ;
г) KMnO4 + HI . - Составьте следующие уравнения ОВР диоксида марганца:
В каких из этих реакций пероксид водорода является окислителем, а в каких – восстановителем?
Опыт 2. Окислительные свойства перманганата калия в нейтральной среде. К 3-4 каплям раствора перманганата калия прилить 5-6 капель раствора сульфита натрия. Какое вещество выделилось в виде осадка?
Опыт 3. Окислительные свойства перманганата калия в щелочной среде. К 3-4 каплям раствора перманганата калия прилить 10 капель концентрированного раствора гидроксида натрия и 2 капли раствора сульфита натрия. Раствор должен приобрести зеленую окраску.
Опыт 4. Окислительные свойства дихромата калия в кислотной среде. 6 капель раствора дихромата калия подкислить четырьмя каплями разбавленного раствора серной кислоты и добавить раствор сульфита натрия до изменения окраски смеси.
Опыт 6. Окислительные свойства концентрированной серной кислоты. Аналогично опыту 5, но добавить концентрированный раствор серной кислоты. Через минуту после начала выделения газообразных продуктов реакции ввести в пробирки полоски фильтровальной бумаги, смоченные растворами перманганата калия и сульфата меди. Объяснить происходящие явления. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ!
Опыт 7. Окислительные свойства разбавленной азотной кислоты. Аналогично опыту 5, но добавить разбавленный раствор азотной кислоты. Наблюдать изменение цвета газообразных продуктов реакции. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ!
Опыт 8. Окислительные свойства концентрированной азотной кислоты. В пробирку поместить кусочек медной ленты и прилить 10 капель концентрированного раствора азотной кислоты. Осторожно нагреть до полного растворения металла. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ!
Опыт 9. Окислительные свойства нитрита калия. К 5-6 каплям раствора нитрита калия прилить равный объем разбавленного раствора серной кислоты и 5 капель раствора иодида калия. Образование каких веществ наблюдается?
Опыт 10. Восстановительные свойства нитрита калия. К 5-6 каплям раствора перманганата калия добавить равный объем разбавленного раствора серной кислоты и раствор нитрита калия до полного обесцвечивания смеси.
Опыт 11. Термическое разложение нитрата меди. Один микрошпатель тригидрата нитрата меди поместить в пробирку, закрепить ее в штативе и осторожно нагреть открытым пламенем. Наблюдать обезвоживание и последующее разложение соли. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ!
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору

1) Реакции, которые протекают без изменения степеней окисления элементов: степени окисления всех элементов в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции. Например:

2) Реакции, которые протекают с изменением степеней окисления элементов: степени окисления всех или некоторых элементов в молекулах исходных веществ не равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
Реакции второго типа называются окислительно-восстановительными.
Окислительно-восстановительные реакции (ОВР) — это химические реакции, при протекании которых степени окисления элементов изменяются.
Изменение степеней окисления в ходе ОВР обусловлено полным или частичным переходом электронов от атомов одного элемента к атомам элемента.
Так, в реакции 4.1.2 каждый атом магния отдает 2 электрона:
Mg 0 = Mg +2 + 2ē (или: Mg 0 — 2ē = Mg +2 ) (4.1.4)
Эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле О2 присоединяет 2 электрона, поэтому молекула кислорода присоединяет 4 электрона:
В реакции 4.1.3 атомы хлора, которые в молекулах HCl имеют степень окисления —1 , отдают по одному электрону и превращаются в нейтральные атомы хлора, которые соединяются попарно и образуют молекулы хлора Сl2:
Cl -1 = Cl 0 + 1ē; Cl 0 + Cl 0 = Cl2
Рассмотренный выше механизм ОВР объясняет, почему эти реакции называют реакциями с переносом электронов. Реакции, при протекании которых степени окисления не изменяются, называются реакциями без переноса электронов. Таким образом, любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называется окислением. В результате процесса окисления алгебраическая величи на степени окисления элемента повышается.
В рассмотренных примерах процессы 4.1.4 и 4.1.6 являются процессами окисления.
Процесс присоединения электронов называется восстановлением. В результате процесса восстановления алгебраическая величина степени окисления понижается.
Процессы 4.1.5 и 4.1.7 являются примерами процессов восстановления.
Частицы (атомы, молекулы, ионы), которые отдают электроны, называются восстановителями.
В реакциях 4.1.2 и 4.1.3 восстановителями являются соответственно Mg и НCl.
Частицы, которые присоединяют электроны, называются окислителями.
В реакциях 4.1.2 и 4.1.3 окислителями являются соответственно O2 и KМnО4.
Следовательно, в общем виде окислительно-восстановительную реакцию можно представить следующей схемой:
Восстановитель + Окислитель = Продукты реакции
Восстановитель участвует в процессе окисления, т. е. окисляется. А окислитель участвует в процессе восстановления, т. е. восстанавливается.
Важнейшие окислители и восстановители
Какие же вещества могут быть окислителями и какие восстановителями? Это зависит от величины степеней окисления элементов, которые входят в состав данных веществ. Как известно, некоторые элементы имеют постоянные степени окисления во всех или в большинстве сложных веществ. Для таких элементов изменение степеней окисления нехарактерно. Поэтому свойства веществ обычно не зависят от присутствия этих элементов. Элементы с переменной степенью окисления, как правило, легко ее изменяют, т. е. могут участвовать в процессах отдачи или присоединения электронов. Поэтому свойства сложных веществ обусловлены наличием в их составе элементов с переменной степенью окисления.
Если в состав вещества входит элемент с высшей степенью окисления, он может только понижать ее, т. е. участвовать в процессе восстановления. Следовательно, данное вещество может только присоединять электроны и выступать только в роли окислителя.
Если в состав вещества входит элемент с низшей степенью окисления, он может только повышать ее, т. е. участвовать в процессе окисления. Следовательно, данное вещество может только отдавать электроны и выступать только в роли восстановителя.
Например, свойства аммиака NH3 определяются степенью окисления азота (для водорода степень окисления +1 является практически постоянной). Азот в NH3 имеет низшую степень окисления —3, поэтому NH3 может быть только восстановителем.
Если в состав вещества входит элемент с промежуточной степенью окисления, он может как повышать, так и понижать ее, т. е. может участвовать и в процессе окисления, и в процессе восстановления. Следовательно, данное вещество может быть и окислителем, и восстановителем. Это зависит от второго участника реакции.

Например, свойства сульфита натрия Na2SО3 определяются степенью окисления серы, которая имеет промежуточную степень окисления +4. Поэтому Na2SО3 проявляет окислительно-восстановительную двойственность. В реакции с перманганатом калия:

сульфит натрия окисляется до сульфата натрия, т. е. выступает в роли восстановителя. Это обусловлено тем, что KМnО4 может быть только окислителем (см. выше). А в реакции с сероводородом:
сульфит натрия восстанавливается до свободной серы, т. е. выступает в роли окислителя, так как H2S может быть только восстановителем (сера в H2S находится в низшей степени окисления).
Важнейшими окислителями являются:
б) сложные вещества, молекулы которых содержат элементы в высшей степени окисления — перманганат калия KМnО4, хроматы и дихроматы (например, дихромат калия K2СrО7), азотная кислота HNO3 и ее соли — нитраты, концентрированная серная кислота H2SO4, оксид свинца (IV) РbО2, хлорная кислота HClO4 и ее соли — перхлорат и др.
Важнейшими восстановителями являются:
б) сложные вещества, молекулы которых содержат элементы в низшей степени окисления — метан силан SiH4, аммиак NH3, фосфин PН3, нитриды и фосфиды металлов (например, Na3N, Са3Р2), сероводород Н2S и сульфиды металлов, гaлогеноводороды HI, НВr НСl и галогениды металлов, гидриды металлов (например, NaH, СаН2) и др.
Среди веществ, содержащих элементы в промежуточных степенях окисления, есть вещества, для которых более характерными являются или окислительные, или восстановительные свойства. Обычно являются окислителями галогены Сl2 и Br2, хлорноватистая кислота НClО и ее соли — гипохлориты, хлораты (KСlO3 и др.), оксид марганца (IV) МnO2, соли трехвалентного железа (FeCl3 и др.). Как правило, в роли восстановителей выступают водород Н2, углерод С, оксид углерода (II) СО, сульфиты металлов (Na2SO3 и др.), соли двухвалентного железа (FeSO4 и др.).
Типы окислительно-восстановительных реакций
Различают 3 типа окислительно-восстановительных реакций.

1) Межмолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ. Примерами данного типа реакций являются

2) Внутримолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества. Например:
К этому типу ОВР относятся многие реакции термического разложения веществ.
З) Реакции самоокисления-самовосстановления, называемые также реакциями диспропорционирования. Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется и восстанавливается. Часть атомов данного элемента отдает электроны другой части атомов этого же элемента. Например:

Составление уравнений окислительно-восстановительных реакций
Для составления уравнений окислительно-восстановительных реакций часто используется специальный метод — метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которые отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.

Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой:

а) Определим степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:

б) Подчеркнем символы элементов, которые изменяют степени окисления в ходе реакции:

в) Составим уравнения процессов окисления и восстановления:
Обратите внимание, что в левой части уравнения процесса окисления взято два атома брома, так как продуктом окисления является двухатомная молекула брома Br2.

д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие в процессах окисления и восстановления:

е) После этого уравниваем числа атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода.
Обычно числа атомов водорода и кислорода уравнивают в последнюю очередь. Во многих случаях равенство чисел атомов кислорода в левой и в правой частях уравнения ОВР свидетельствует о том, что это уравнение составлено правильно (в составленном уравнении 40 атомов кислорода и в левой, и в правой частях).
Рассмотрим некоторые более сложные примеры составления уравнений ОВР.

Составим уравнение реакции, которая протекает по следующей схеме:

Определим степени окисления всех элементов и подчеркнем символы элементов, которые изменяют свои степени окисления:
Составим уравнения процессов окисления и восстановления и найдем множители, на которые нужно умножить эти уравнения:


Обратите внимание, что не все атомы азота, которые входят в состав HNО3, изменяют свою степень окисления: часть атомов азота без изменения степени окисления переходит в молекулы Cu(NO3)2 Поэтому найденные методом электронного баланса коэффициенты напишем перед всеми формулами, содержащими Сu и N, кроме формулы HNO3:

Коэффициент перед формулой HNO3 равен общему числу атомов азота в правой части уравнения, т. е. равен 8 (из них 6 атомов, которые не изменяют степень окисления):

В последнюю очередь уравниваем числа атомов водорода и кислорода:

В некоторых ОВР более двух элементов изменяют свои степени окисления. В качестве примера рассмотрим следующую реакцию:
Два элемента — фосфор и сера — в ходе этой реакции окисляются, один элемент — азот — восстанавливается:


Общее число электронов, которые участвуют в процессах окисления, равно 22; в процессе восстановления участвует 1 электрон. Поэтому общий множитель для двух уравнений процессов окисления равен 1, а множитель для уравнения процесса восстановления равен 22. Запишем эти множители в качестве коэффициентов перед формулами соответствующих веществ:

В заключение уравняем числа атомов водорода и кислорода:
Читайте также:

