Как сделать окись хрома
Добавил пользователь Алексей Ф. Обновлено: 04.10.2024
Аннотация научной статьи по нанотехнологиям, автор научной работы — Колоницкий Петр Дмитриевич, Суходолов Николай Геннадьевич
Разработана методика синтеза оксида Cr(III), сочетающая золь-гель метод и самораспространяющуюся реакцию, инициированную микроволновым излучением. Из-за высокой температуры на последней стадии синтеза получены структуры размером около микрона, которые были разрушены ультразвуком до размеров в несколько сотен нанометров. Фазовый состав порошков был исследован методом рентгенофазового анализа. Получены микрофотографии образцов до и после обработки ультразвуком. Методом БЭТ измерена удельная поверхность образца 33 м 2/г. Методом лазерной дифракции определены размеры частиц и их распределения. Большинство частиц имеют размеры 90-200 нм. Распределения частиц по размерам, показали, что ультразвук разрушает полученные в результате синтеза агрегаты. Показано, что полученные частицы, имеющие слоисто-пористую структуру, разрушаются ультразвуком до наноразмерного состояния.
Похожие темы научных работ по нанотехнологиям , автор научной работы — Колоницкий Петр Дмитриевич, Суходолов Николай Геннадьевич
Наноразмерные частицы оксида цинка, полученные в плазменном разряде под действием ультразвуковой кавитации в жидкой фазе и методом осаждения
Наноразмерные частицы оксидов металлов, полученные в плазменном разряде в жидкой фазе под действием ультразвуковой кавитации. 2. Размеры и устойчивость. Исследование методом ДРС
MICROWAVE SYNTHESIS OF CHROMIUM OXIDE
During this work a method of synthesis of chromium(III) oxide, combining the sol-gel method and self-propagating reaction initiated by microwave radiation, has been developed. Due to the high temperature at the last stage of the synthesis structures about a micron in size were obtained and destroyed by ultrasound up to a few hundred nanometers in size. The phase composition of the investigated powders was investigated by X-ray analysis. Microphotographs of samples before and after ultrasound were obtained. By the BET method specific surface area of the sample was measured 33 m 2 /g. The size of particles and size distributions were determined by laser diffraction. The bulk quantity of particles has a size of 90-200 nm. The distributions of particle size shows influence of ultrasound on size of particles. The results of the research showed that the obtained aggregates having a layered-porous structure are destroyed by ultrasound up to the nanoscale state.
Вестник СПбГУ. Сер. 4. Т. 2 (60). 2015. Вып. 1
П. Д. Колоницкий, Н. Г. Суходолов
МИКРОВОЛНОВЫЙ СИНТЕЗ ОКСИДА ХРОМА
Санкт-Петербургский государственный университет, Российская Федерация, 199034, Санкт-Петербург, Университетская наб., 7—9
Разработана методика синтеза оксида Cr(III), сочетающая золь-гель метод и самораспространяющуюся реакцию, инициированную микроволновым излучением. Из-за высокой температуры на последней стадии синтеза получены структуры размером около микрона, которые были разрушены ультразвуком до размеров в несколько сотен нанометров. Фазовый состав порошков был исследован методом рентгенофазового анализа. Получены микрофотографии образцов до и после обработки ультразвуком. Методом БЭТ измерена удельная поверхность образца — 33 м2/г. Методом лазерной дифракции определены размеры частиц и их распределения. Большинство частиц имеют размеры 90—200 нм. Распределения частиц по размерам, показали, что ультразвук разрушает полученные в результате синтеза агрегаты. Показано, что полученные частицы, имеющие слоисто-пористую структуру, разрушаются ультразвуком до наноразмерного состояния. Библиогр. 6 назв. Ил. 4. Табл. 2.
Ключевые слова: микроволновый синтез, наноразмерные частицы, оксид хрома.
P. D. Kolonitskii, N. G. Sukhodolov
MICROWAVE SYNTHESIS OF CHROMIUM OXIDE
St. Petersburg State University, 7—9, Universitetskaya nab., St. Petersburg, 199034, Russian Federation
During this work a method of synthesis of chromium(III) oxide, combining the sol-gel method and self-propagating reaction initiated by microwave radiation, has been developed. Due to the high temperature at the last stage of the synthesis structures about a micron in size were obtained and destroyed by ultrasound up to a few hundred nanometers in size. The phase composition of the investigated powders was investigated by X-ray analysis. Microphotographs of samples before and after ultrasound were obtained. By the BET method specific surface area of the sample was measured — 33 m2/g. The size of particles and size distributions were determined by laser diffraction. The bulk quantity of particles has a size of 90—200 nm. The distributions of particle size shows influence of ultrasound on size of particles. The results of the research showed that the obtained aggregates having a layered-porous structure are destroyed by ultrasound up to the nanoscale state. Refs 6. Figs 4. Tables 2.
Keywords: microwave synthesis, nanoparticles, chromium oxide.
Введение. Активное исследование и широкое применение наноразмерных частиц в химии, биологии и медицине обусловливает необходимость быстрого и простого их получения. Так, например, нанодисперсные оксиды металлов могут быть успешно использованы для специфичной экстракции многих биологически активных соединений, таких как белки, лекарственные препараты, пестициды [1]. В представленной работе использован новый метод [2] синтеза наночастиц оксидов металлов, основанный на микроволновой обработке водных растворов солей различных металлов в присутствии мочевины. Его преимуществом является получение наноразмерных частиц оксидов металлов в неравновесных условиях.
На данный момент практически все методы получения наночастиц связаны или с применением дорогостоящего оборудования, или с использованием дорогих или опасных прекурсоров. Целью нашей работы было получение наноразмерного оксида хрома и изучение его структурных и поверхностных свойств. Предложенный метод синтеза
Экспериментальная часть. Синтез оксида Cr(III) проводили разложением водного раствора нитрата хрома(Ш) в присутствии карбамида под воздействием микроволнового излучения (рис. 1). Механизм синтеза до конца не исследован, но можно предположить, что данный процесс идёт в две стадии. На первой стадии из исходного раствора образуется золь, который на второй стадии термически разрушается до образования твёрдого продукта. Таким образом, механизм можно классифицировать как комбинацию золь-гель метода и самораспространяющейся реакции, индуцированной микроволновым излучением. Можно предположить следующую схему процесса:
Cr(NO3)3 + (NH2)2CO ^ Cr2O3 + NOx + H2O + CO2.
Образование оксида хрома сопровождается выделением большого количества газообразных продуктов, но их качественный и количественный состав точно установить не представляется возможным из-за большого выделения тепла на последней стадии синтеза. В результате образуются наночастицы, которые агрегируют до субмикронных и микронных размеров.
Для определения структуры и размера полученных частиц образец был исследован методом СЭМ (сканирующей электронной микроскопии) на приборе Hitachi S3400N SEM. Фотографии исходного образца и образца, обработанного ультразвуком (40 кГц, 40 кВ) в течение 30 с представлены на рис. 2.
На первых двух фотографиях показан общий вид образца до и после ультразвука. Видно, что чёткая структура образца теряется, а размеры агрегатов уменьшаются. Следующие изображения демонстрируют вид отдельных агрегатов. Последние фотографии иллюстрируют структуру агрегатов. Вне зависимости от обработки ультразву-
Рис. 1. Дифрактограмма синтезированного оксида хрома
Рис. 2. Микрофотографии исходного образца (а, б, в); образца после ультразвука (г, д, е): а, г — 100 мкм; б, д — 10 и 20 мкм; в, е — 5 мкм
ком образцы имеют слоисто-пористую структуру. Толщина стенки такой структуры около 100 нм.
Для определения среднего размера агрегатов использован метод лазерной дифракции [3]. Измерения были проведены на приборе Mastersizer 3000. Метод измерения — лазерная дифракция, расчёты — теория Ми [4].
Метод измерения основан на преломлении/отражении пучка света, проходящего через кювету с частицами. В зависимости от формы и размера частиц свет, источником которого являются красный или синий лазеры (в зависимости от размера частиц), достигает различных детекторов. Эти сигналы собираются и обрабатываются. В результате измерения рассчитываются количественное и объёмное распределения частиц по размерам.
Объёмное распределение широко используется в промышленности, поскольку оно показывает средний объём частиц в образце (табл. 1). Однако, надо заметить, что малая доля больших частиц может сильно повлиять на полученные результаты. Например, десять частиц размером 100 мкм дадут сигнал с той же интенсивностью, что и тысяча частиц размером 1 мкм. Поэтому часто используется также количественное распределение, характеризующее не средний объём частиц в смеси, а, как понятно из названия, количество частиц, данного диаметра прошедших через измерительную кювету (табл. 2). Оба этих распределения являются результатами различной обработки экспериментальных данных и одинаково могут использоваться для характеризации исследуемого образца. В представленных таблицах Ву — размер частиц, занимающих 90, 50 или 10% объёма смеси, а Пп — размеры частиц, представляющих те же процентные части количества частиц в смеси. Из-за разогрева смеси на последней стадии синтеза
получаются агрегаты. Для оценки размеров исходных частиц агрегаты подвергались воздействию ультразвука. Обработка проводилась ультразвуком в течение 30 с (40 кГц, 40 кВ — ТО 1) и 2 мин (40 кГц, 40 кВ — ТО 2) (рис. 3).
Размеры частиц в объёмном распределении
Образец Dv 10, мкм Dv 50, мкм Dv 90, мкм
Сг2Оз 7,50 18,4 34,7
Сг2Оз (US 1) 1,82 5,40 13,1
Сг2Оз (US 2) 0,584 1,32 3,39
Таблица 2 Размеры частиц в количественном распределении
Образец D„ 10, мкм D„ 50, мкм Dn 90, мкм
Сг2Оз 0,792 1,16 2,84
Сг2Оз (US 1) 0,353 0,542 1,53
Сг2Оз (US 2) 0,0943 0,129 0,207
Рис. 3. Объёмное (а) и количественное (б) распределения частиц по размерам:
1 — для агрегированных частиц; 2 — для частиц после обработки ультразвуком в течение 30 с, 40 кГц, 40 кВ; 3 — ультразвуком в течение 2 мин, 40 кГц, 40 кВ
Как видно из представленных результатов, исходные агрегаты размерами в десятки микрон легко разрушаются ультразвуком сначала до микрон, а затем и до сотен нанометров.
Для определения удельной поверхности полученного оксида хрома построена изотерма адсорбции азота при температуре 77,4 К. Далее по методу БЭТ (Брунауэра—Эм-мета—Теллера) [5] была рассчитана удельная поверхность образца.
Изотерма адсорбции азота измерена на волюметрическом анализаторе ASAP2020 MP (Micrometrics Instrument Corporation). Согласно классификации ИЮПАК полученная изотерма адсорбции вследствие наличия петли гистерезиса и перегиба в области низких относительных давлений характерна для адсорбции азота мезопористым твёрдым телом (рис. 4). Поскольку форма изотермы может маскировать наличие микропористости, для её определения был построен t-график [6] (зависимость количества адсорбированного газа от статистической толщины адсорбционного слоя). Эта-
Рис. 4. Изотерма адсорбции азота при температуре 77 К
90 80 70 60 j- 50 3 40 30 20 10
0,0 0,2 0,4 0,6 0,8 1,0
лонная кривая статистической толщины адсорбционного слоя построена по уравнению Харкинса—Юра, полученного обобщением данных по адсорбции азота при 77 К на различных непористых оксидах. Рассчитанное значение объёма микропор составило 1,05 • 10-4 см3/г, внешняя удельная поверхность 33 м2/г.
В ходе исследования разработана методика синтеза оксида Сг(111), структура которого подтверждена РФА. Полученные частицы представляют собой мезопористые агрегаты размерами 1-10 мкм с некоторым количеством микропор. Данные агрегаты легко разрушающиеся ультразвуком до наноразмерных частиц (90-200 нм). Таким образом, предложенная нами методика позволяет без жёстких условий, дорогого лабораторного оборудования и токсичных реактивов получать наноразмерные частицы оксида Сг(Ш) с большой для оксидов металлов удельной поверхностью (33 м2/г).
1. Гладилович В. Д., Шрейнер Е. В., Дубровский Я. А. и др. Исследование специфичных свойств регулярного мультимолекулярного сорбента Fe(III) // Науч. приборостроение. 2013. T. 23, № 1. C. 106-114.
2. СелютинА. А., Колоницкий П. Д., Суходолов Н. Г. Синтез и характеризация нанорегулярных сорбентов на основе оксида циркония // Науч. приборостроение. 2013. T. 23, № 1. C. 115-122.
3. РоулА. Основные принципы анализа размера частиц. Malvern Industries, Ltd, 2009. 12 с.
4. Mercus H. G. Particle size measurements. Springer, 2009.
5. BrunauerS., Emmett P. H., Teller E. Adsorption of gases in multimolecular layers //J. Am. Chem. Soc. 1938. Vol. 60, N 2. P. 309-319.
6. LippensB. C., De Boer J. H. Studies on pore systems in catalysts //J. Catalysis. 1964. Vol. 3, N 1. P. 32-37.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Поверхностная оксидная пленка является причиной инертности хрома при обычной температуре, благодаря чему этот металл не подвергается атмосферной коррозии (в отличие от железа). При нагревании хром проявляет свойства довольно активного металла, что соответствует его положению в электрохимическом ряду напряжений. Тонкоизмельченный хром интенсивно горит в токе кислорода. На воздухе реакция с O2 происходит лишь на поверхности металла. При осторожном окислении амальгамированного хрома образуется низший оксид CrO. (Сr не взаимодействует с Н2, но поглощает его в больших количествах) CrCl3 и CrS - ионные соединения. CrN и rxCy - ковалентные тугоплавкие инертные вещества, по твердости сравнимы с алмазом. - смесь концентрированных HNO33 и НСl (1:3), растворяет золото и платиновые металлы (Pd,Os,Ru). Соединения Cr (II)СrO - оксид хрома (II). Твердое черное вещество, н. р. в Н2O. 1) медленное окисление хрома, растворенного в ртути 2) обезвоживание Сr(ОН)2 в восстановительной атмосфере: СrO - неустойчивое вещество, легко окисляется при небольшом нагревании до Сr2O3; при более высоких Т диспропорционирует: СrO - типичный основный оксид, проявляет характерные для этого класса свойства. Реакции необходимо проводить в восстановительной среде. Сr(OН)2 - гидроксид хрома (II) твердое желтое вещество, н. р. в Н2O. обменными реакциями из солей Сr 2+ : Неустойчивое вещество, разлагается при нагревании; на воздухе быстро окисляется с образованием зеленого гидроксида хрома (III); Наиболее важные: CrCl2, CrSO4, (СН3СОО)2Сr. Гидратированный ион Сr 2+ имеет бледно-голубую окраску. 1. Сr + неметалл (S, Hal2) 2. Восстановление солей Сr 3+ : 1. Соли Сr 2+ - сильные восстановители, так как очень легко окисляются до солей Сr 3+ 2. Раствор CrSO4 в разбавленной H2SO4 - превосходный поглотитель кислорода: 3. С аммиаком соли Сr 2+ образуют комплексные соли - аммиакаты: Для Сr 2+ характерно образование двойных сульфатов, например: K2Cr(SO4)2• 6Н2O Соединения Сr(III), важнейшее природное соединение хрома. Сr2О3, полученный химическими методами, представляет собой темно-зеленый порошок. 1. Синтез из простых веществ: 2. Термическое разложение гидроксида хрома (III) или дихромата аммония: 3. Восстановление дихроматов углеродом или серой: Сr2O3 - типичный амфотерный оксид В порошкообразном виде реагирует с сильными кислотами и сильными щелочами, в кристаллическом виде - химически инертное вещество. К наиболее практически важным реакциям относятся следующие: 1. Восстановление с целью получения металлического хрома: 2. Сплавление с оксидами и карбонатами активных металлов: Образующиеся метахромиты являются производными метахромистой кислоты НСrO2. 3. Получение хлорида хрома (III): Образуется в виде синевато-серого осадка при действии щелочей на соли Сr 3+ : Практически нерастворимый в воде гидроксид может существовать в виде коллоидных растворов. В твердом состоянии гидроксид хрома (III) имеет переменный состав Сr2O3• nН2O. Теряя молекулу воды, Сr(ОН)3 превращается в метагидроксид СrО(ОН). Сr(ОН)3 - амфотерный гидроксид, способный растворяться как в кислотах, так и в щелочах: Сr(ОН)3 + ЗОН - = [Cr(OH)6] 3- гексагидроксохромитанион При сплавлении с твердыми щелочами образуются метахромиты: Растворением осадка Сr(ОН)3 в кислотах получают нитрат Cr(NO3)3, хлорид СrСl3, сульфат Cr2(SO4)3 и другие соли. В твердом состоянии чаще всего содержат в составе молекул кристаллизационную воду, от количества которой зависит окраска соли. Самой распространенной является двойная соль КСr(SO4)2• 12H2O - хромокалиевые квасцы (сине-фиолетовые кристаллы). Хромиты, или хроматы (III) - соли, содержащие Сr 3+ в составе аниона. Безводные хромиты получают сплавлением Сr2O3 с оксидами двухвалентных металлов: В водных растворах хромиты существуют в виде гидроксокомплексов. К наиболее характерным свойствам солей Cr(III) относятся следующие: 1. Осаждение катиона Сг 3+ под действием щелочей: Характерный цвет осадка и его способность растворяться в избытке щелочи используется для отличия ионов Сг 3+ от других катионов. 2. Легкая гидролизуемость в водных растворах, обусловливающая сильнокислый характер среды: Сr 3+ + Н2O = СrОН 2+ + Н + Соли Сr (III) с анионами слабых и летучих кислот в водных растворах не существуют; так как подвергаются необратимому гидролизу, например: 3. Окислительно-восстановительная активность: а) окислитель: соли Cr(III) → соли(VI) б) восстановительь: соли Cr(III) → соли(II) 4. Способность к образованию комплексных соединений - аммиакатов и аквакомплексов, например: Соединения Cr(VI)Кристаллическое вещество темно-красного цвета, очень гигроскопичное, легко растворимое в воде. Основной способ получения: СrО3 - кислотный оксид, активно взаимодействует с водой и щелочами, образуя хромовые кислоты и хроматы. Хромовый ангидрид - чрезвычайно энергичный окислитель. Например, этанол воспламеняется при соприкосновении с СrO3: Продуктом восстановления хромового ангидрида, как правило, является Сr2O3. Хромовые кислоты - Н2СrO4, Н2Сr2O7.При растворении CrO3 в воде образуются 2 кислоты: Обе кислоты существуют только в водных растворах. Между ними устанавливается равновесие: Обе кислоты очень сильные, по первой ступени диссоциированы практически полностью: - соли, содержащие анионы хромовой кислоты CrO4 2- . Почти все имеют желтую окраску (реже - красную). В воде хорошо растворяются только хроматы щелочных металлов и аммония. Хроматы тяжелых металлов н. р. в Н2O. Наиболее распространены: Na2CrO4, К2CrO4, РЬCrO4 (желтый крон). 1. Сплавление CrO3 с основными оксидами, основаниями: 2. Окисление соединений Cr(III) в присутствии щелочей: 3. Сплавление Сr2O3 со щелочами в присутствии окислителя: Хроматы существуют только в разбавленных щелочных растворах, которые имеют желтую окраску, характерную для анионов СrO4 2- . При подкислении раствора эти анионы превращаются в оранжевые дихромат-анионы: 2СrO4 2- + 2Н + = Сr2O7 2- + Н2O Это равновесие мгновенно сдвигается в ту или иную сторону при изменении рН растворов. Хроматы - сильные окислители. При нагревании хроматы тяжелых металлов разлагаются; например: - соли, содержащие анионы дихромовой кислоты Сr2O7 2- В отличие от монохроматов имеют оранжево-красную окраску и обладают значительно лучшей растворимостью в воде. Наиболее важные дихроматы - К2Сr2O7, Na2Cr2O7, (NH4)2Cr2O7. Их получают из соответствующих хроматов под действием кислот, даже очень слабых, например: Водные растворы дихроматов имеют кислую среду вследствие устанавливаемого равновесия с хроматанионами (см. выше). Окислительные свойства дихроматов наиболее сильно проявляются в подкисленных растворах: При добавлении восстановителей к кислым растворам дихроматов окраска резко изменяется от оранжевой до зеленой, характерной для соединений Сг 3+ . Эта реакция используется для получения хромокалиееых квасцов KCr(SO4)2 • 12H2O Твердый металл голубовато-белого цвета. Этимология слова "хром" берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.
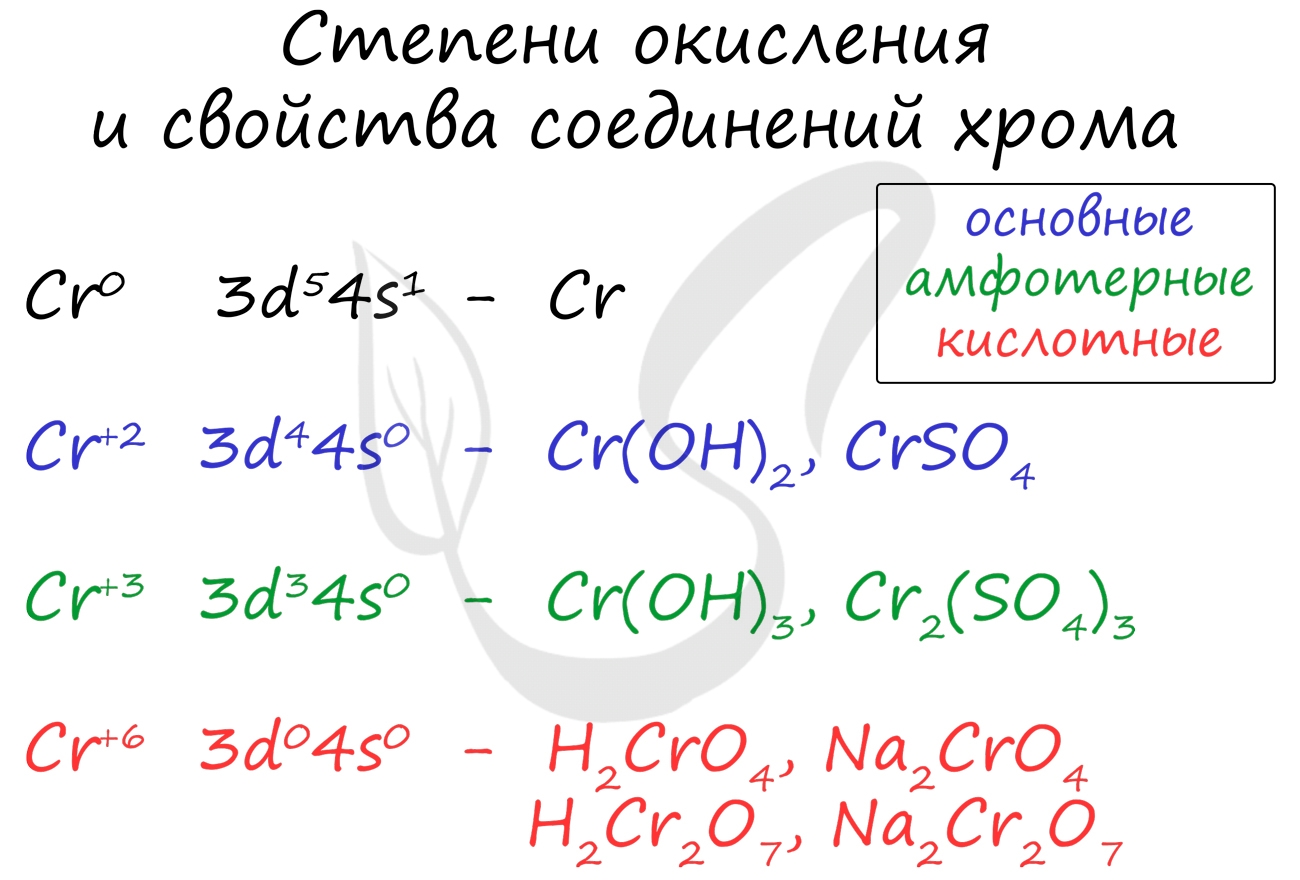
Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 - амфотерные, +6 - кислотные.
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома (III) - Cr2O3 - происходит пассивирование. Реагирует с неметаллами при нагревании.
Протекает в раскаленном состоянии.
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании. Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него. Соединения хрома (II) Соединение хрома (II) носят основный характер. Оксид хрома (II) окисляется кислородом воздуха до более устойчивой формы - оксида хрома (III), реагирует с кислотами, кислотными оксидами.
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.
Соединения хрома (III) Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).
Оксид хрома (III) реагирует как с щелочами, так и с кислотами. В реакциях с щелочами при нормальной температуре (в растворе) образуются комплексные соли, при прокаливании - смешанные оксиды. С кислотами оксид хрома (III) образует различные соли. H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия) Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия) Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr +3 )
Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии). При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде). Соединения хрома (VI) В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома (VI) - CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая - H2CrO4 и дихромовая кислоты - H2Cr2O7. Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы - в оранжевый цвет.
Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый. Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый - образуется хромат. Разложение дихромата аммония выглядит очень эффектно и носит название "вулканчик" :)
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства. ЖелезоЯвляется одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
Получают железо восстановлением из его оксида - руды. Восстанавливают с помощью угарного газа, водорода. Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Fe + S = FeS (t > 700°C) Fe + S = FeS2 (t 2+ в растворе является реакция с красной кровяной солью - K3[Fe(CN)6] - гексацианоферратом (III) калия. В результате реакции образуется берлинская лазурь (прусский синий). Качественной реакцией на ионы Fe 2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета. Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами. Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия) При сплавлении комплексные соли не образуются из-за испарения воды. Гидроксид железа (III) - ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.
Качественной реакцией на ионы Fe 3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий). Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
И еще одна качественная реакция на ионы Fe 3+ - взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета. Соединения железа (VI) - ферраты - соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами. Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например - железом.
Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде. CuSO4 + H2O = Cu + O2 + H2SO4 (медь - на катоде, кислород - на аноде)
Во влажном воздухе окисляется с образованием основного карбоната меди. При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом. 4Cu + O2 = (t) 2Cu2O (при недостатке кислорода) 2Cu + O2 = (t) 2CuO (в избытке кислорода)
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной - реакция идет.
Реагирует с царской водкой - смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl. Медь способна восстанавливать неметаллы из их оксидов. Cu + SO2 = (t) CuO + S Cu + NO = (t) CuO + N2↑ Соединения меди IВ степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II). Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом. Оксид меди (I) окисляется кислородом до оксида меди (II). Оксид меди (I) вступает в реакции с кислотами. Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду. Соединения меди (II)Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства. Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
CuO + CO = Cu + CO2 Гидроксид меди (II) - Cu(OH)2 - получают в реакциях обмена между растворимыми солями меди и щелочью.
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду. Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс. Обратите особое внимание на реакцию взаимодействия соли меди (II) - сульфата меди (II), карбоната натрия и воды. Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. Читайте также:
|