Как сделать нитробензол
Обновлено: 03.07.2024
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Методика синтеза. В тригорлову колбу объемом 100 мл вносят 11 мл азотной кислоты и при охлаждении добавляют небольшим порциями 12,5 мл серной кислоты. При необходимости смесь охлаждают до комнатной температуры (20 ° С).
Колбу соединяют с обратным холодильником, термометром и капельной воронкой. Через капельную воронку в нитрующей смеси, уже находящегося в колбе, порциями добавляют 0,11 моль бензола, встряхивая каждый раз реакционную смесь (для этого закрепления колбы в муфте должно быть несколько ослаблено). Температура реакционной смеси при этом не должна превышать 50 ° С (при необходимости смесь охлаждают в заранее приготовленной ледовой бане).
После окончания добавления бензола реакционную смесь нагревают на водяной бане до температуры 60 ° С и выдерживают ее в течение 1 час.
Выделение продукта. После окончания реакции реакционную смесь охлаждают, переливают в делительную воронку и оставляют для отстоя-вания. Верхний слой (нитробензол) отделяют, промывают водой и дважды раствором гидроксида (2 х 20 мл) и снова водой (40 мл). Смесь переносят в делительную воронку и отделяют нижний слой - нитробензол.
Промытый нитробензол вносят в сухую колбу, присоединенную к обратному холодильнику, добавляют безводный CaCl2 и нагревают реакционную массу до ее освещения. При охлаждении реакционной массы нижний слой должен затвердевать, образуя кристаллогидрат CaCl2 · 6Н2О, если этого не происходит, то в колбу добавляют еще CaCl2 и повторяют операцию до полного обезвоживания нитробензола.
Сухой нитробензол вносят в колбу Вюрца и перегоняют его, отбирая фракцию при 204 - 210 ° С. Ни в коем случае нитробензол НЕ перегоняют насухо - это может привести к взрыву. В колбе должно остаться 10 - 15% первоначального объема.
Характеристика конечного продукта. Нитробензол чистый - бесцветная жидкость, технический - жидкость светло-желтого цвета. Легко растворим в этаноле, эфире, бензоле, нерастворимый в воде, Тпл = 5,76 ° С, Ткип = 210,8 ° С, d420 = 1,208, nd20 = 1,5526.
Токсичность. Очень ядовитое вещество, окисляет гемоглобин до метгемоглобина, нарушает деятельность центральной нервной системы, вызывает заболевания печени. ГДКр.з. = 3 мг/м3.
Использование. Для получения анилина, а также бензидина, м-ды-нитробензола, м нитрохлорбензола, м нитробензолсульфокислоты; в производстве красителей как растворитель при очистке сырой нефти, а также используется как мягкий окислитель.
Из ароматических нитросоединений производные нитробензола выпускаются в промышленности в наибольшем масштабе. Объем производства нитробензола в мире составляет примерно 2 млн. т. в год.
Существует несколько способов получения нитробензола. Традиционным является способ, заключающийся в непрерывном изотермическом нитровании нитрующей смесью, содержащей примерно 45 % азотной кислоты, и температуре 60-70°С. Другим способом является парофазное нитрование бензола с применением эффективных катализаторов. Нитробензол используется как полупродукт в анилинокрасочной продукции, Фармацевтической, парфюмерной промышленности. Нитробензол используется во многих отраслях промышленности как растворитель. В нефтяной промышленности нитробензол используется как растворитель для очистки смазочных масел.
Небольшое количество нитробензола идет для приготовления хлоратных взрывчатых веществ, где он играет роль горючего и флегматизатора. Так же используется в качестве полировальных составов для металлов.
Нитробензол выпускают под марками А и Б.
Нитробензол марки Б получают методом нитрования бензола смесью концентрированной азотной кислоты с купоросным маслом в емкостном нитраторе.
Непрерывное изотермическое нитрование производят нитрующей смесью, содержащей примерно 45% азотной кислоты и температуре 60-70°С.
Замечено, что протеканию реакции окисления способствует наличие в нитрующей смеси окислов азота. Возможно, что образование кислородосодержащих соединений протекает с промежуточным нитрозированием углерода:
На протекание окислительных процессов в значительной мере влияет температура нитрования: повышение температуры ускоряет образование гидроксисоединений. Из последовательных реакций в основном протекает образование динитробензола. Наличие динитробензола в нитробензоле создает опасность взрыва.
Второй побочной реакцией является образование динитробензола:
Для уменьшения образования динитробензола необходимо не превышать установленного фактора нитрующей активности, поддерживать концентрацию азотной кислоты в отработанной кислоте менее 1%, не хранить долго отработанную кислоту при температуре выше 30°С и не превышать температуру нитрования сверх установленного регламента. Получение нитробензола является экзотермичной реакцией. Кроме того, при нитровании выделяется вода, которая разбавляет серную кислоту. Интенсивное выделение тепла во многом определяет технологию процесса нитрования бензола и его невозможно проводить без обеспечения охлаждения реакционной смеси.
В связи с тем, что реакция идет на поверхности разделения фаз - необходимо интенсивное перемешивание. Температура реакции подбирается в зависимости от используемой нитрующей смеси. Безопасный интервал температуры должен быть не менее 10-20°С. При выборе нижней границы безопасного температурного интервала необходимо учитывать то, что вначале при быстром добавлении нитрующей смеси, возможно, быстрое закритическое повышение температуры. Поэтому скорость подачи нитрующего агента, вначале должна строго регламентироваться.
В нитробензол представляет собой ароматическое органическое соединение, образованное бензольным кольцом C6ЧАС5- и нитрогруппа –NO2. Его химическая формула - C6ЧАС5Нет2. Это бесцветная или бледно-желта
Содержание:
В нитробензол представляет собой ароматическое органическое соединение, образованное бензольным кольцом C6ЧАС5- и нитрогруппа –NO2. Его химическая формула - C6ЧАС5Нет2. Это бесцветная или бледно-желтая маслянистая жидкость с запахом горького миндаля или крема для обуви.
Нитробензол - очень полезное соединение в химической промышленности, поскольку позволяет получать ряд химических веществ, которые имеют различное применение. Это потому, что он может подвергаться различным типам реакций.
Среди важных химических реакций - нитрование (которое позволяет добавлять больше -NO2 к молекуле) и восстановлению (противоположность окислению, поскольку два атома кислорода нитро-NO группы удаляются2 и заменяются атомами водорода).
Из нитробензола можно получить, например, анилин и пара-ацетаминофенол. Последний представляет собой хорошо известный ацетаминофен, который является жаропонижающим (лекарство от лихорадки) и легким анальгетиком (лекарством от незначительной боли).
С нитробензолом следует обращаться с осторожностью, поскольку он раздражает и токсичен, среди некоторых симптомов он может вызвать анемию, и считается, что он вызывает рак. Это также вредно для окружающей среды.
Состав
Нитробензол C6ЧАС5-НЕТ2 представляет собой плоскую молекулу, образованную бензольным кольцом C6ЧАС5- к которой присоединена нитрогруппа -NO2. Его молекула плоская, потому что существует электронное взаимодействие между нитро-NO группой.2 и бензольное кольцо.
Группа нитро-NO2 стремится притягивать электроны из бензольного кольца C6ЧАС5–.
По этой причине у молекулы есть немного более отрицательная сторона (где кислород -NO2) и немного более положительной стороны (бензольное кольцо).
Номенклатура
- Масло или эссенция мирбана или мирбаны (неиспользуемый термин).
Свойства
Физическое состояние
Маслянистая жидкость от бесцветного до бледно-желтого цвета.
Молекулярный вес
Температура плавления
Точка кипения
Точка возгорания
88 ºC (метод закрытой чашки).
температура самовоспламенения
Плотность
1,2037 г / см 3 при 20 ° С.
Растворимость
Слабо растворим в воде: 0,19 г / 100 г воды при 20 ° C. Полностью смешивается со спиртом, бензолом и диэтиловым эфиром.
Химические свойства
Нитробензол стабилен примерно до температуры 450 ° C, при которой он начинает разлагаться с образованием (в отсутствие кислорода) NO, NO2, бензол, бифенил, анилин, дибензофуран и нафталин.
Важные реакции нитробензола включают восстановление, нитрование, галогенирование и сульфирование.
При нитровании нитробензола сначала образуется метанитробензол, а при длительном времени реакции получается 1,3,5-нитробензол.
Путем взаимодействия брома или хлора с нитробензолом в присутствии подходящего катализатора получают 3-бромнитробензол (мета-бромонитробензол) или 3-хлорнитробензол (мета-хлорнитробензол).
Примером восстановления является то, что при обработке мета-галогенонитробензолов оловом (Sn) в соляной кислоте (HCl) получаются мета-галогеноанилины.
Сульфирование нитробензола проводится дымящей серной кислотой при 70-80 ° C, и продукт представляет собой мета-нитробензолсульфоновую кислоту. Его можно восстановить железом и HCl с получением метаниловой кислоты.
Образование димера
В растворе бензола С6ЧАС6 Молекулы нитробензола связываются друг с другом с образованием димеров или пар молекул. В этих парах одна из молекул находится в перевернутом положении по отношению к другой.
Образование димеров нитробензола с молекулами, одна инвертированная относительно другой, возможно, происходит из-за того, что каждая из них имеет немного более положительно заряженную сторону и противоположную слегка более отрицательно заряженную сторону.
В димере чуть более положительно заряженная сторона одной из молекул, возможно, близка к слегка отрицательно заряженной стороне другой молекулы, поскольку противоположные заряды притягиваются, и то же самое происходит с двумя другими сторонами.
Другие свойства
Имеет запах, похожий на запах миндаля или крема для обуви. При понижении температуры он затвердевает в виде зеленовато-желтых кристаллов.
Получение
Его получают обработкой бензолом C6ЧАС6 со смесью азотной кислоты HNO3 и серная кислота H2ЮЗ4. Этот процесс называется нитрованием и включает образование иона нитрония NO.2 + благодаря наличию серной кислоты H2ЮЗ4.
- Образование иона нитрония NO2 + :
- Ион нитрония атакует бензол:
Реакция нитрования бензола очень экзотермична, то есть выделяется много тепла, поэтому она очень опасна.
Приложения
При получении анилина и ацетаминофена
Нитробензол в основном используется для синтеза анилина C6ЧАС5NH2, который представляет собой соединение, широко используемое для приготовления пестицидов, жевательных резинок, красителей, взрывчатых веществ и лекарств.
Получение анилина происходит путем восстановления нитробензола в кислой среде в присутствии железа или олова, что осуществляется в соответствии со следующими этапами:
Нитробензол → Нитрозобензол → Фенилгидроксиламин → Анилин
В зависимости от условий процесс можно остановить на одной из промежуточных стадий, например на фенилгидроксиламине. Исходя из фенилгидроксиламина в сильнокислой среде, пара-аминофенол можно получить:
Последний обрабатывают уксусным ангидридом для получения парацетамола (ацетаминофена), известного жаропонижающего и легкого анальгетика, то есть лекарства для лечения лихорадки и боли.
Другой способ получения анилина - восстановление нитробензола монооксидом углерода (CO) в водной среде в присутствии очень маленьких частиц (наночастиц) палладия (Pd) в качестве катализатора.
При получении других химических соединений
Нитробензол - это отправная точка для получения широкого спектра соединений, используемых в качестве красителей, пестицидов, лекарств и косметики.
Например, он позволяет получить 1,3-динитробензол, который путем хлорирования (добавление хлора) и восстановления (отщепление атомов кислорода) образует 3-хлоранилин. Он используется в качестве промежуточного продукта для пестицидов, красителей и лекарств.
Нитробензол был использован для получения бензидина, который является красителем. Кроме того, нитробензол используется для получения хинолина, азобензола, метаниловой кислоты, динитробензола, изоцианатов или пироксилина среди многих других соединений.
В различных приложениях
Нитробензол используется или использовался как:
- Растворитель для экстракции для очистки смазочных масел, используемых в машиностроении.
- Растворитель для эфиров целлюлозы
- Состав смесей для полировки металлов
- В смесях для полировки обуви
- Консервант для аэрозольных красок
- Компонент смесей для полировки полов
- Заменитель миндальной эссенции
- В парфюмерной индустрии
- При производстве синтетического каучука
- Растворитель в различных процессах
Риски
Нитробензол токсичен при вдыхании, проглатывании и абсорбции через кожу.
Раздражает кожу, глаза и дыхательные пути. Это может вызвать тип анемии, называемый метгемоглобинемией, который представляет собой снижение способности эритроцитов выделять кислород в ткани и приводит к усталости.
Кроме того, нитробензол вызывает одышку, головокружение, нарушение зрения, одышку, коллапс и смерть. Он также повреждает печень, селезенку, почки и центральную нервную систему.
Считается, что он может быть мутагеном и, возможно, вызывать рак у людей, поскольку он вызвал его у животных.
Кроме того, нитробензол не следует выбрасывать в окружающую среду.Его токсичность по отношению к животным, растениям и микроорганизмам делает его очень вредным для экосистем.
Токсичность по отношению к микроорганизмам снижает их биоразлагаемость.
Процедуры по его выведению из окружающей среды
Загрязнение окружающей среды нитробензолом может происходить через отходы различных производств, в которых он используется, таких как производство красок или взрывчатых веществ.
Нитробензол - высокотоксичный загрязнитель, который трудно разлагается в естественных условиях, по этой причине он может вызвать серьезное загрязнение питьевой воды и систем орошения сельскохозяйственных культур.
Из-за его высокой стабильности и токсичности по отношению к микроорганизмам его часто выбирают в качестве модели при исследованиях очистки сточных вод.
Изучаются различные способы удаления нитробензола из загрязненной воды. Один из них - через фотокаталитическую деградацию, то есть использование солнечного света в качестве ускорителя реакции разложения в присутствии диоксида титана TiO.2.
Методы микроэлектролиза с катализатором из железа (Fe) и меди (Cu) в керамике также были успешно испытаны. Микроэлектролиз позволяет разрушить нитробензол электрическим током.



Нитросоединения жирного ряда могут быть получены при непосредственном действии азотной кислоты или окислов азота на предельные углеводороды. Прямое нитрование углеводородов жирного ряда и нафтеновых углеводородов изучено М. И. Коноваловым (реакция Коновалова). С. С. Наметкин объяснил механизм этой реакции и широко использовал ее для установления строения терпеновых углеводородов. Однако метод прямого нитрования мало пригоден для препаративных целей, так как он не дает возможности получить достаточно однородный продукт. Лучшие результаты получаются при действии азотистокислых солей на галоидопроизводные углеводородов, например:
В качестве побочного продукта при этом образуется некоторое количество сложного эфира азотистой кислоты C 2 H 5 -O-NO, который легко отделить от нитросоединения ввиду значительно более низкой температуры его кипения.
Нитросоединения ароматического ряда, напротив, легко получаются при непосредственном нитровании углеводородов и других ароматических соединений - фенолов, кислот и пр. В случае легко нитрующихся соединений реакция идет при применении разбавленной азотной кислоты; трудно вступающие в реакцию вещества нитруют смесью концентрированных азотной и серной кислот. Серная кислота связывает образующуюся при реакции воду и тем самым поддерживает необходимую для реакции концентрацию азотной кислоты. Непосредственное нитрование является единственным практически применяемым методом получения нитросоединений ароматического ряда.
Примером получения нитросоединений жирного ряда действием азотистокислых солей на галоидные производные может служить синтез нитрометана. В качестве исходного вещества берут монохлоруксусную кислоту, в которой хлор обладает значительной подвижностью. При взаимодействии натриевой соли хлоруксусной кислоты с азотнокислым натрием образуется натриевая соль нитроуксусной кислоты:
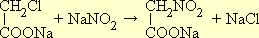
При нагревании нитроуксусная кислота легко декарбоксилируется (т. е. отщепляет CO 2 ), образуя нитрометан:
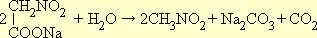
Реактивы:
Хлоруксусная кислота. 18,9 г (0,2 моля)
Азотистокислый натрий. 14 г (0,2 моля)
Едкий натр; хлористый кальций
К смеси указанного количества хлоруксусной кислоты и 20 г толченого льда прибавляют при помешивании 14 мл охлажденного во льду 40%-ного раствора едкого натра до щелочной реакции (по фенолфталеину). При нейтрализации температура смеси не должна подниматься выше 20°. Полученный раствор хлоруксуснокислого натрия приливают к раствору азотистокислого натрия в 18 мл воды, находящемся в перегонной колбе емкостью 200 мл. Колбу соединяют с холодильником и закрывают пробкой с термометром, шарик которого должен быть погружен в жидкость.
Смесь медленно нагревают до начала выделения пузырьков углекислого газа, что происходит при температуре около 80°. После этого прекращают нагревание, так как реакция продолжается самостоятельно, без подогрева извне. Если температура смеси начинает понижаться, то вновь осторожно подогревают до 85°. Когда реакция в основном закончится, реакционную смесь осторожно подогревают, доводя температуру ее к концу реакции до 110°. Нитрометан начинает перегоняться при температуре около 90°. При отгонке получают не менее 5 мл нитрометана и около 15 мл воды.
Темп. кип. чистого нитрометана 101,2°; уд. вес 1,1382; показатель преломления 1,3935.
Нитрометан является нейтральным соединением, но в присутствии щелочей изомеризуется в аци-форму, взаимодействующую со щелочью с образованием соли:
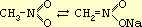
При подкислении раствора соль разлагается и выделившаяся в свободном виде аци-форма постепенно переходит в нейтральный нитрометан. Присутствие аци-формы нитрометана может быть обнаружено по характерному окрашиванию с хлорным железом.
Растворяют 0,5 мл нитрометана при нагревании в 1 мл 1 н. раствора едкого натра и прибавляют несколько капель раствора хлорного железа. По охлаждении в пробирку осторожно по каплям прибавляют разбавленный раствор соляной кислоты. Появляется кровавокрасное окрашивание.
Обязательным условием успешного протекания реакции является хорошее перемешивание реагирующих веществ.
Наряду с нитробензолом образуется небольшое количество динитробензола. Повышение температуры во время нитрования приводит к образованию значительных количеств динитропродукта.
Реактивы:
Бензол. 18 мл или 15,6 г (0,2 моля)
Азотная кислота уд. веса 1,4. 20 мл (0,28 моля)
Серная кислота конц. 25 мл (0,45 моля)
Углекислый натрий; хлористый кальций
В колбе емкостью 260 мл осторожно, при охлаждении, смешивают азотную кислоту с серной. К охлажденной до комнатной температуры смеси постепенно, небольшими порциями, прибавляют бензол, каждый раз хорошо перемешивая содержимое колбы и наблюдая за тем, чтобы температура смеси не превышала 50-60°. В случае необходимости колбу охлаждают водой. (Для уменьшения потерь бензола за счет испарения к колбе присоединяют воздушный холодильник.) Когда весь бензол прибавлен, колбу помещают на водяную баню, нагретую до 60°, и ведут реакцию при этой температуре в течение получаса, часто и энергично перемешивая жидкость.
Затем реакционную смесь переливают в литровую колбу, содержащую 300 мл воды, перемешивают жидкость, охлаждают и при помощи делительной воронки отделяют находящийся в нижнем слое нитробензол *1 . Его промывают в делительной воронке сначала разбавленным раствором углекислого натрия, а затем чистой водой.
Промытый нитробензол переливают в небольшую колбу и прибавляют прокаленный хлористый кальций. Колбу закрывают пробкой, в которую вставлена стеклянная трубка (в качестве обратного воздушного холодильника), и нагревают на водяной бане. Когда жидкость станет прозрачной, переливают нитробензол в перегонную колбу и перегоняют с воздушным холодильником. После отгонки небольшого количества непрореагировавшего бензола перегоняется нитробензол при температуре 204-207°. Отгонять продукт досуха не следует во избежание разложения остающегося в колбе динитробензола *2 .
Темп. кип. чистого нитробензола 210,9°; уд. вес 1,2055; показатель преломления 1,5532.
Согласно правилу замещения в бензольном ядре, вторая нитрогруппа вступает в мета-положение по отношению к первой:
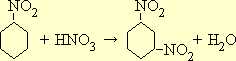
Так как замещение второго водородного атома бензольного ядра на нитрогруппу идет значительно труднее, чем замещение первого, то при получении динитробензола приходится создавать более жесткие условия нитрования (повышенная концентрация кислот, более высокая температура).
При реакции, кроме основного продукта м -динитробензола, получаются небольшие количества п -динитробензола (около 3%) и о -динитробензола (около 1%), которые можно удалить путем перекристаллизации препарата из спирта.
Реактивы:
Нитробензол. 12,3 г (0,1 моля)
Азотная кислота уд. веса 1,4. 10 мл (0,14 моля)
Серная кислота конц. 30 мл (0,55 моля)
Углекислый натрий; спирт
В колбу емкостью 200 мл вливают нитробензол и нагревают под тягой на кипящей водяной бане. К горячему нитробензолу при энергичном перемешивании небольшими порциями прибавляют нитрующую смесь. Температура реакционной смеси во время нитрования не должна подниматься выше 115°.
После внесения всего количества нитрующей смеси нагревание и перемешивание продолжают еще в течение 30-40 мин. Конец реакции устанавливают на основании следующей пробы: каплю раствора вносят в пробирку с водой; динитробензол должен при этом выпадать в виде бледножелтых кристаллов; если этого не происходит, нагревание необходимо продолжить.
По окончании реакции смесь охлаждают до 70° и при энергичном перемешивании ( под тягой ) выливают в 100 мл холодной воды. Сырой динитробензол выпадает в виде аморфной массы. По охлаждении кислый раствор декантацией сливают с осадка *1 , добавляют к последнему 50 мл воды и нагревают до кипения; динитробензол при этом плавится. По охлаждении воду сливают и повторяют ту же операцию, добавляя к воде углекислый натрий до резко щелочной реакции (по лакмусу). Охладив раствор, сливают воду через фильтр, а оставшийся на дне стакана динитробензол (в виде твердой лепешки) еще два раза плавят в чистой воде, беря каждый раз по 50 мл воды и сливая охлажденный раствор через тот же фильтр. Небольшое количество задержанных фильтром кристаллов промывают холодной водой, отжимают между листами фильтровальной бумаги, присоединяют к основной массе динитробензола, который вынимают из стакана, и высушивают на воздухе.
Полученный продукт плавится около 80°. Для получения вполне чистого м -динитробензола его перекристаллизовывают из спирта. Он образует бесцветные длинные иглы с темп. пл. 90°.
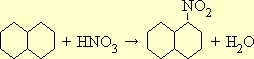
Реактивы:
Нафталин. 12,8 г (0,1 моля)
Азотная кислота уд. веса 1,4. 7,2 (0,1 моля)
Серная кислота конц. 13 мл (0,23 моля)
Метиловый спирт
Серную кислоту смешивают с 7 мл воды и с указанным количеством азотной кислоты. К смеси, нагретой до 50°, прибавляют тонко растертый нафталин и, поддерживая указанную температуру, ведут реакцию в течение 1 часа при постоянном перемешивании. (Целесообразно применить механическую мешалку.) Затем повышают температуру до 60° и в течение часа продолжают перемешивание смеси.
По охлаждении нитронафталин застывает в виде лепешки, плавающей на поверхности раствора. Кислую жидкость сливают, а сырой нитронафталин плавят в кипящей воде. По охлаждении воду сливают и повторяют эту операцию еще два раза. При такой обработке большая часть непрореагировавшего нафталина улетучивается с парами воды. Расплавленный продукт при энергичном перемешивании выливают в холодную воду, в которой он застывает в виде маленьких шариков. Осадок отфильтровывают, отжимают между листами фильтровальной бумаги и сушат на воздухе.
Полученный продукт не вполне чист и содержит небольшие количества динитронафталина и непрореагировавшего нафталина. Для получения чистого препарата его кристаллизуют из метилового спирта: он выпадает в виде желтых игл с темп. пл. 61,5°.
Фенол нитруется очень легко уже на холоду под действием разбавленной азотной кислоты. В соответствии с ориентирующим влиянием OH-группы как заместителя 1-го рода при этом получается о - и п -нитрофенол:
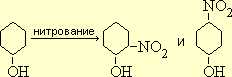
Разделение этих изомеров основано на том, что о -нитрофенол, в отличии от п -нитрофенола, перегоняется с водяным паром.
При нитровании фенола нужно избегать повышения температуры реакционной смеси во избежание образования ди- и тринитрофенола.
Реактивы:
Фенол. 28,2 г (0,3 моля)
Азотная кислота. 185 мл (0,6 моля)
Метиловый спирт; едкий натр; активный уголь; соляная кислота
К фенолу прибавляют 5 мл воды, нагревают до плавления, и смесь постепенно при перемешивании вносят в азотную кислоту. Колбу с азотной кислотой охлаждают водой, наблюдая за тем, чтобы температура реакционной смеси все время была ниже 20°. Смесь, принимающую темную окраску, оставляют стоять в течение нескольких часов в холодной воде, периодически взбалтывая.
По окончании реакции тщательно сливают кислоту, промывают несколько раз водой оставшуюся в колбе маслянистую, частично осмолившуюся массу и подвергают ее перегонке с водяным паром (прибор собирают, как показано на рис. 18). В приемник в виде желтого быстро кристаллизующегося масла переходит о -нитрофенол. Если о -нитрофенол начинает кристаллизоваться в холодильнике, то на некоторое время прекращают подачу в него воды; горячий конденсат расплавляет кристаллы о -нитрофенола, и он переходит в приемник.
Выпавший в приемнике о -нитрофенол отфильтровывают на воронке Бюхнера, отжимают между листами фильтровальной бумаги и высушивают на воздухе.
Если полученный продукт плавится при более низкой температуре, его перекристаллизовывают из метилового спирта.
Для выделения п -нитрофенола оставшуюся в колбе смолистую массу кипятят с 170 мл 10%-ного раствора едкого натра и небольшим количеством активного угля и фильтруют.
Еще горячий темный фильтрат упаривают до тех пор, пока капля раствора по охлаждении не будет застывать. Раствор охлаждают, выделившийся п -нитрофенолят отсасывают, промывают несколько раз небольшими порциями 10%-ного раствора едкого натра и хорошо отжимают на фильтре.
Полученную соль переносят в стакан и при нагревании разлагают 10%-ной соляной кислотой. Выделившийся нитрофенол по охлаждении застывает. Водный слой сливают и перекристаллизовывают нитрофенол из горячей 1-2%-ной соляной кислоты.
Свободный анилин при нитровании легко подвергается окислению и осмолению. Для предохранения аминогруппы от окисления анилин сначала подвергают ацетилированию. Полученный ацетанилид нитруется с образованием преимущественно п -нитроацетанилида:
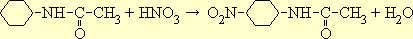
Если нитрование ведется при низкой температуре, то изомерный о -нитроацетанилид образуется лишь в весьма небольших количествах; повышенная же температура благоприятствует его образованию.
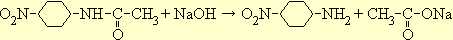
Реактивы:
Ацетанилид. 13,5 г (0,1 моля)
Азотная кислота уд. веса 1,38. 8 мл (0,11 моля)
Серная кислота конц.; углекислый натрий; спирт; едкий натр
Тонко измельченный сухой ацетанилид вносят в 30 мл концентрированной серной кислоты и перемешивают до тех пор, пока не получится вполне прозрачный раствор. Температура при этом не должна подниматься выше 25° во избежание омыления ацетанилида.
Раствор охлаждают до 0° в смеси льда и соли, и постепенно приливают смесь 8 мл азотной кислоты и 5 мл концентрированной серной кислоты. Температура во время нитрования не должна превышать 2-3° во избежание образования значительных количеств о -нитросоединения. После того как прибавлена вся кислота, продолжают перемешивание еще в течение получаса и смесь оставляют стоять на холоду в течение ночи.
На следующий день вливают раствор в смесь 35 мл воды и 35 г толченого льда; тотчас выпадает нитроацетанилид. Через полчаса осадок отфильтровывают, хорошо промывают водой, переносят в стакан с 50 мл воды, прибавляют углекислый натрий до щелочной реакции (по лакмусу) и нагревают до кипения. При этой обработке о -нитроацетанилид омыляется, а п -нитроацетанилид остается без изменения. Охлаждают раствор до 50°, отфильтровывают кристаллы п -нитроацетанилида, хорошо промывают водой и высушивают на воздухе.
Для получения п -нитроанилина сырой п -нитроацетанилид смешивают с 20 мл воды, приливают 12 мл 35%-ного раствора едкого натра и кипятят до тех пор, пока капля раствора, внесенная в 10%-ную соляную кислоту, не будет растворяться без осадка.
Обычно омыление заканчивается через 2,5-3 часа. Нужно следить, чтобы во время кипячения реакция все время оставалась щелочной. Смеси дают охладиться до 40°, отфильтровывают осадок, тщательно промывают холодной водой и высушивают.
*1 Остающийся в делительной воронке водный слой, содержащий серную и азотную кислоты (а также аналогичные ему растворы), нельзя непосредственно выливать в канализационную раковину; предварительно его необходимо нейтрализовать известковым молоком или известью.
Читайте также:

