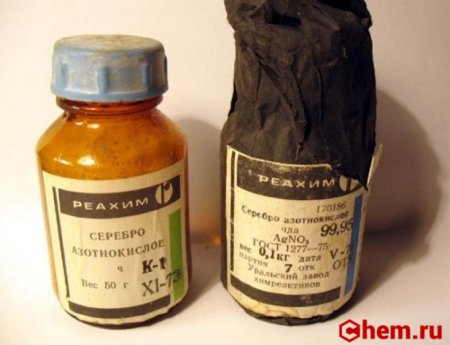
Как сделать нитрат серебра
Обновлено: 07.07.2024
То есть как разделить AgNO3 и KNO3 ?
Ничего простого в голову не приходить, тока выделить серебро, а потом растворить его в азотке, типа
раствор AgNO3 и KNO3 + NaCl -> AgCl в осадок
AgCl+Na2CO3 под флюсом (бурой) (в печь при температуре 900 С) = Ag + NaCl
Ag+HNO3 титровать до нейтральной реакции = AgNO3.
Так это он и есть!
Ляпис -- нитрат серебра впервые применили врачи-алхимики голландец Ян-Баптист ван Гельмонт (1579--1644) и немец Франциск де ла Бое Сильвий (1614--1672), которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. При этом протекает реакция:
Ag + 2HNO3 = AgNO3 + NO2 + H2O.
Тогда-то и было обнаружено, что прикосновение к кристаллам полученной серебряной соли не проходит бесследно: на коже остаются черные пятна, а при длительном контакте -- глубокие ожоги. Нитрат серебра -- бесцветный (белый) порошок, хорошо растворимый в воде, на свету он чернеет с выделением металлического серебра. Медицинский ляпис, строго говоря, не чистый нитрат серебра, а его сплав с нитратом калия, иногда отлитый в виде палочек -- ляписного карандаша. Ляпис оказывает прижигающее действие и применяется с давних пор. Однако пользоваться им надо очень аккуратно: нитрат серебра может вызвать отравления и сильные ожоги. Хранить ляпис следует в местах, недоступных детям! Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов; в небольших концентрациях он действует как противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани. Раньше ляпис применяли для удаления мозолей и бородавок, прижигания угрей. Да и теперь, если нет возможности прибегнуть к криотерапии (прижиганию сухим льдом или жидким азотом) , пользуются ляписом.
Можно с нитритом натрия осадить малорастворимый нитрит серебра, а затем обработать его азотной кислотой.
Компонент эликсира бессмертия. Ян Батист Ван-Гельмонт утверждал, что создал чудесный напиток еще в 16-ом веке. Основой эликсира стало азотнокислое серебро. Собственно, Ян Батист его и получил.
Что такое азотнокислое серебро?
Формула азотнокислого серебра: — ArNO3. NO3 здесь – остаток азотной кислоты . Ее формула — HNO3. Поэтому серебро и названо азотнокислым. Соединение сохраняет разъедающую способность кислоты .
Формула азотнокислого серебра
Попадая на тело, нитрат окрашивает его в черный цвет. Спустя некоторое время потемневшая кожа разлагается, образуются язвы. Собственно, поэтому азотнокислое серебро и назвали адским камнем. Если же следовать терминологии химиков, соединение относится к солям азотной кислоты .
Свойства азотнокислого серебра
У ромбических кристаллов героя статьи высокая плотность – 4,3 грамма на кубический сантиметр. Для сравнения, у большинства минералов показатель не доходит до 4-ех, держась в диапазоне 2,4-3,6 граммов на кубический сантиметр.
Из героя статьи легко получить раствор азотнокислого серебра. В воде нитрат диссоциирует на 100% уже при 20-ти градусах тепла, то есть, в обычных условиях. В 100-та миллилитрах жидкости можно растворить 222 грамма соли .
Диссоциирует она и в этаноле, метаноле, но в меньших масштабах. В 100 граммах метанола растворяются лишь 3,6 грамма нитрата. В этаноле распадаются 2,2 грамма азотнокислого соединения.
При нагреве до 209-ти по шкале Цельсия нитрат серебра начинает плавиться. Повысив температуру еще на 90 градусов можно увидеть разложение соли. Впрочем, при нагреве распадаются все нитраты.
Внешний вид азотнокислого серебра
Что же касается разложения ими кожи, оно может пойти во благо. В малых количествах и в малой концентрации азотнокислое серебро не разъедает покровы, а лишь обеззараживает, убивая болезнетворные бактерии.
В химии нитрат серебра используют в качественной реакции определения соляной кислоты . Соединяясь с ней, герой статьи дает творожистый осадок. Это хлорид серебра . Второй продукт реакции – азотная кислота .
Кстати, герой статьи является реактивом не только для хлора , но всей второй группы анионов, то есть йода , сульфура и брома. С ними ионы серебра тоже сцепляются в нерастворимые осадки. Это бромид, сульфид и йодит.
Из нитрата серебра можно получить и чистый металл. Драгоценность выделяется электролизом. В раствор азотнокислого металла помещают катод и анод.
Первый под воздействием пропускаемого через жидкость тока притянет положительно заряженные частицы серебра . Останется слить раствор. Реакцию важно проводить в фарфоровой , керамической или пластиковой ванночках. Металлическая посуда не подходит.
Получение азотнокислого серебра
Ван Батист Ван-Гельмонт получил нитрат, растворяя серебро в концентрате азотной кислоты. Метод актуален по сей день. Однако, в процессе выпадают токсичные окислы азота .
Исключает метод и нагревание. Температура повышается за счет экзотермической реакции. Всем изменениям стандартное взаимодействие нитрата с азотной кислотой обязано введению в раствор кислорода .
Он поступает в виде озона с формулой О3 или перекиси водорода с записью H2O2. Они не загрязняют раствор, а лишь снижают расход кислоты . Сразу получается концентрат, пригодный для кристаллизации.
Применение азотнокислого серебра
Купить азотнокислое серебро стремятся стоматологи. Они лечат героем статьи детский кариес. Это позволяет избежать пломбирования. Реагентом обрабатывают молочные зубы .
Соль серебра блокирует развитие кариеса. Появляется возможность дождаться появления коренных зубов, не рассверливая их предшественников. Минус метода состоит в цвете азотнокислого серебра . Оно чернит эмаль не хуже самого кариеса. Поэтому, для лечения коренных зубов реагент не используют.
Блокировка героем статьи развития кариеса связана с антибактериальными свойствами серебра. Его ионы убивают более 650-ти видов болезнетворных микроорганизмов, в том числе и разрушающие твердые ткани – кости , эмаль . Концентрированный нитрат прижигает, подобно йоду. Поэтому, азотнокислое серебро применяют при лечении эрозий и прочих язв, ранок.
Малая процентовка героя статьи в растворе позволяет использовать жидкость как вяжущее средство. Его действие направлено на коагуляциею белков на поверхности клеток.
Образуются плотные альбуминаты, то есть пленки из простых, растворимых в воде белков. Стенки из них прикрывают нервные окончания. Не получая импульсов, последние не передают в мозг сигналы о болях.
Азотнокислое серебро в аптеке покупали раньше в качестве средства от болей при гастрите. Современные врачи перестали выписывать рецепт, поскольку появились более действенные и при этом щадящие препараты.
Их, как и нитрат серебра , применяют за 15-20 минут до еды. Остальные препараты с солью серебра наружные, максимум, рассчитаны для слизистых горла, носа. Выпускают мази, карандаши, растворы.
У него, кстати, нет противопоказаний кроме аллергических реакций и возраста до 3-ех лет. Если купить нитрат в виде карандаша и долго держать в руке , можно заработать химический ожог.
Относительным минусом препаратов с азотнокислым серебром становится их краткий срок хранения. Как правило, через месяц после распаковки, лекарства теряют силу.
Производители пользуются этим, делая лишь большие упаковки. Приходиться покупать, переплачивая, но использовать лишь частично. Пока потребители выкидывают просроченные лекарства, фармацевты считают прибыль.
Похоже на ситуацию с некоторыми антибиотиками в форме суспензии. Продают 500-миллиметровую банку, а ее содержимое портится через 3-5 суток после открытия.
Вне медицинской сферы нитрат серебра – компонент красителей для тканей и кожи . Помните, что и человеческую кожу соль чернит? К тому же, раствор нитрата предотвращает расплывание других красителей. Это относится не только к тканям, но и полиграфии.
Азотнокислое серебро чернит кожу
Добавляют азотнокислое серебро и в фотоэмульсии. Они обеспечивают четкость снимков. Действие реагента основано на светочувствительности всех галогенидов серебра.
Правда, приходиться сенсибилизировать вещества, то есть заставлять чувствовать лучи любых спектров. До процедуры нитрат воспринимает лишь голубой свет и ультрафиолет.
Порой, найти нитрат серебра можно на предприятиях по производству стеклопакетов. Там герой статьи служит реагентом при выявлении содержания оксида кальция в молекулярном сите.
В химической промышленности азотнокислое серебро – катализатор и окислитель в ряде реакций. Раздел, к которому они относятся, именуют аналитической химией. В лабораториях, как правило, азотнокислое серебро изготавливают самостоятельно. Промышленники же часто закупают уже готовый нитрат. Узнаем, почем.
Цена азотнокислого серебра
Фирмы ставят ограничения на отпуск азотнокислого серебра физическим и юридическим лицам. Первые получают в одни руки разово не более 100-та граммов соли. Учитывается степень опасности соединения. Для предприятий рамок нет.

Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 4.1 Использование в медицине
![Нитрат серебра I]()
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
![Нитрат серебра I]()
Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г ; растворимость в метиловом спирте — 3,6 г/100 г ; в этиловом спирте — 2,12 г/100 г ; в ацетоне — 0,44 г/100 г ; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
![Нитрат серебра I]()
2 AgNO3 → 350∘C 2 Ag + 2 NO2 + O2 Реагирует с щелочью с образованием оксида: 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O в этаноле, при -50 градусах, образуется гидроксид серебра AgNO3 + NaOH → C2H5OH−50 AgOH ↓ + KNO3 ↓
Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине
![Нитрат серебра I]()
![Нитрат серебра I]()
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
![Нитрат серебра I]()
Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Галерея
![Нитрат серебра I]()
![Нитрат серебра I]()
- Серебро (Ag)
- Азид серебра (AgN3) Тринитрид серебра
- Амид серебра (AgNH2)
- Антимонид серебра I (Ag3Sb)
- Арсенат серебра I (Ag3AsO4) Арсенат серебра
- Арсенид серебра I (Ag3As) Арсенид трисеребра
- Ацетат серебра (AgC2H3O2) Серебро уксуснокислое
- Ацетиленид серебра (Ag2C2)
- Бензоат серебра (AgC7H5O2) Серебро бензойнокислое
- Бромат серебра I (AgBrO3) Серебро бромноватокислое
- Бромид серебра I (AgBr) Серебро бромистое
- Вольфрамат серебра (Ag2WO4) Серебро вольфрамовокислое
- Гексафторогерманат серебра (Ag2[GeF6])
- Гидроксид серебра (AgOH) Гидроокись серебра
- Гидрофосфат серебра (Ag2HPO4) Фосфорнокислое серебро кислое
- Гипонитрит серебра (Ag2N2O2) Серебро азотноватистокислый
- Диборид серебра (AgB2) Серебро бористое
- Дигидрофосфат серебра (AgH2PO4)
- Дихромат серебра (Ag2Cr2O7) Бихромат серебра (Серебро двухромовокислое)
- Йодат серебра (AgIO3) Серебро йодноватокислое
- Йодид серебра I (AgI) Серебро йодистое
- Карбонат серебра I (Ag2CO3) Серебро углекислое
- Лактат серебра (AgC3H5O3) Серебро молочнокислое
- Лаурат серебра (AgC12H23O2) Серебро лауриновокислое
- Метафосфат серебра (AgPO3) Серебро фосфорнокислое
- Молибдат серебра (Ag2MoO4) Серебро молибденовокислое
- Нитрат серебра I (AgNO3) Серебро азотнокислое (Ляпис или адский камень)
- Нитрат серебра II (Ag(NO3)2) Азотнокислое серебро
- Нитрид серебра I (Ag3N)Серебро азотистое
- Нитрит серебра I (AgNO2) Серебро азотистокислое
- Оксалат серебра (Ag2C2O4) Серебро щавелевокислое
- Оксид серебра I (Ag2O) Окись серебра
- Оксид серебра III (Ag2O3)
- Оксид серебра I,III (Ag2O2) Серебро окись
- Ортоарсенит серебра I (Ag3AsO3) Арсенит серебра
- Ортофосфат серебра I (Ag3PO4)
- Пальмитат серебра (AgC16H31O2) Серебро пальмитиновокислое
- Периодат серебра (AgIO4) Серебро йоднокислое
- Перманганат серебра (AgMnO4) Серебро марганцовокислое
- Перренат серебра (AgReO4) Серебро рениевокислое
- Перхлорат серебра (AgClO4) Серебро хлорнокислое
- Пирофосфат серебра (Ag4P2O7) Дифосфат серебра
- Пропионат серебра (AgC3H5O2) Серебро пропионовокислое
- Реактив Толленса ([Ag(NH3)2]ОН)
- Селенат серебра (Ag2SeO4) Серебро селеновокислое
- Селенид дисеребра (Ag2Se) Серебро селенистое
- Селенит серебра (Ag2SeO3) Серебро селенистокислое
- Субфторид серебра (Ag2F) Гемифторид серебра
- Сульфат серебра (Ag2SO4) Серебро сернокислое
- Сульфид серебра I (Ag2S) Серебро сернистое
- Сульфид серебра II (AgS) Сернистое серебро
- Сульфит серебра (Ag2SO3) Серебро сернистокислое
- Тартрат серебра (Ag2C4H4O6) Серебро виннокислое
- Теллурид серебра (AgTe) Серебро теллуристое
- Теллурид серебра I (Ag2Te) Теллурид дисеребра
- Теллурит серебра (Ag2TeO3) Серебро теллуристокислое
- Тетрафтороборат серебра (Ag[BF4]) Тетрафторобориат серебра
- Тиоантимонит серебра (Ag3SbS3) Серебро тиосурьмянистокислое
- Тиосульфат серебра (Ag2S2O3) Серебро тиосернокислое
- Тиоцианат серебра I (AgSCN) Серебро роданистое
- Фосфид серебра (Ag3P) Серебро фосфористое
- Фторид серебра I (AgF) Серебро фтористое
- Фторид серебра II (AgF2) Фтористое серебро
- Фульминат серебра (AgONC) Гремучее серебро
- Хлорат серебра (AgClO3) Серебро хлорноватокислое
- Хромат серебра (Ag2CrO4) Серебро хромовокислое
- Хлорид серебра I (AgCl) Серебро хлористое
- Хлорит серебра (AgClO2) Серебро хлористокислое
- Цианамид серебра (Ag2CN2)
- Цианат серебра (AgOCN) Серебро циановокислое
- Цианид серебра I (AgCN) Серебро цианистое
- Цитрат серебра (Ag3C6H5O7) Серебро лимоннокислое
© 2000-2020 Все права защищены.
Любое копирование, в т.ч. отдельных частей текстов или изображений, публикация и републикация, перепечатка или любое другое распространение информации, в какой бы форме и каким бы техническим способом оно не осуществлялось, строго запрещается без предварительного письменного согласия со стороны редакции. Во время цитирования информации подписчиками ссылки обязательны. Допускается цитирование материалов сайта без получения предварительного согласия, но в объеме не более одного абзаца и с обязательной прямой, открытой для поисковых систем гиперссылкой на сайт.
Нитрат серебра (азотнокислое серебро, адский камень, ляпис) – соль металла серебра и азотной кислоты.
![]()
Химическая формула –
Молярная масса равна г/моль.
![20^<\circ></p>
<p>Физические свойства – это твёрдое вещество, представляющее из себя бесцветные ромбические кристаллы, с плотностью 4,352 г/см , хорошо растворяется в воде 222,5 г/100 г ( C]()
).Растворимость в метаноле и этаноле равно соответственно 3,6 г/100 г и 2,12 г/100, температура плавления C" width="69" height="18" />
, выше C" width="51" height="14" />
разлагается.Химические свойства нитрата серебра
![\[ 2AgNO_3 + Fe = Fe(NO_3)_2 + 2Ag \downarrow \]]()
![\[ AgNO_3 + NaOH = Ag_2O \downarrow + H_2O + NaNO_3 \]]()
![\[ AgNO_3 + HCl = AgCl \downarrow + HNO_3 \]]()
![\[ AgNO_3 + NaCl = AgCl \downarrow + NaNO_3 \]]()
![\[ AgNO_3 + KCN = AgCN \downarrow + KNO_3 \]]()
![\[ AgNO_3 + 2KCN = K[Ag(CN)_2] + KNO_3 \]]()
![\[ 2AgNO_3 + 3NH_4OH + HCHO = 2Ag \downarrow + HCOONH_4 + 2NH_4NO_3 + 2H_2O \]]()
![\[ 2AgNO_3 = 2Ag + 2NO_2 \uparrow + O_2 \uparrow \]]()
Получение
Нитрат серебра получают растворением металлического серебра в концентрированной азотной кислоте:
![\[ Ag + 2HNO_3 = AgNO_3 + NO_2 \uparrow + H_2O \]]()
Качественная реакция
Качественной реакцией на нитрат-ион является образование тёмно-бурого раствора сульфата нитрозожелеза (II) при взаимодействии с в сильно кислой среде:
![\[ 2NO_3^- + 6FeSO_4 + 4H_2SO_4 = 2NO + 3Fe_2(SO_4)_3 + SO_4^<2-></p>
<p> + 4H_2O \]]()
![\[ FeSO_4 + NO = [FeNO]SO_4 \]]()
Качественной реакцией на ионы серебра является образование белого творожистого осадка хлорида серебра при добавлении к раствору или :
![\[ AgNO_3 + HCl = AgCl \downarrow + HNO_3 \]]()
Применение
Нитрат серебра применяется в медицине для прижигания небольших ран и бородавок.
В малых концентрациях он используется в качестве противовоспалительного и вяжущего средства.
Также используется в изготовлении зеркал.
Примеры решения задач
Задание Рассчитайте эффективную степень диссоциации в воде при моляльности раствора моль/кг, если понижение температуры замерзания этого раствора равно град. Решение На первом шаге вычислим изотонический коэффициент, который показывает формальное число частиц, на которое продиссоциировало соединение: ![\[ \Delta T = i \cdot K \cdot C_m \Rightarrow i = \frac<\Delta T></p>
<p> = \frac = 1,89 \]]()
— криоскопическая постоянная воды
Рассчитаем степень диссоциации :
![\alpha = \frac<i - 1></p>
<p> = \frac = 0,89]()
или— число ионов, на которые диссоциирует .
Задание Рассчитайте концентрацию ионов серебра в насыщенном растворе метанола при ![20^<\circ>C]()
для .Решение в является слабым электролитом, поэтому запишем диссоциацию через константу равновесия: Равновесные концентрации частиц:
Здесь — исходная концентрация нитрата серебра, — убыль концентрации .
![\[ K = \frac<[Ag^+] \cdot [NO_3^-]></p>
<p> = \frac \]]()
![\[ K = 10^<-1,77></p>
<p> = 0,017 \]]()
моль/л — молярность насыщенного раствора
![\[ K \cdot C - K \cdot x = x^2 \Rightarrow x^2 + K \cdot x - K \cdot C = 0 \]]()
![[Ag^+] = x = \frac<-K + \sqrt<K^2 + 4 \cdot K \cdot C></p>
<p>> = \frac> = 0,1126]()
моль/лЧитайте также: