Как сделать мазок крови на стекле
Добавил пользователь Владимир З. Обновлено: 04.10.2024
Кровь берут из пальца, предварительно протертого спиртом, уколов его стерильной иглой. Для приготовления тонкого мазка хорошо обезжиренное предметное стекло прикладывают к месту укола на пальце и получают небольшую каплю крови .
К переднему краю капли ставят шлифованное предметное стекло под углом 45 градусов. После того как кровь растечется по краю стекла, его продвигают вперед так, чтобы на предметном стекле получился равномерный тонкий мазок. Мазки крови вначале высушивают на воздухе, а затем фиксируют метиловым спиртом или смесью Никифорова.
Приготовление мазков из испражнений
Таким же способом готовят мазок и из жидкого калового стула.
Мазок из оформленного или густого кашицеобразного стула готовится следующим образом: в капле физиологического раствора, предварительно нанесенной на предметное стекло, ополаскивают конец тонко заостренной деревянной палочки, предварительно погруженной в кал. Полученная взвесь накрывается покровным стеклом и производится просмотр при помощи микроскопа для первоначальной ориентировки. Точное определение паразитов осуществляется в фиксированных и окрашенных препаратах.
Исследование не окрашенных и окрашенных препаратов начинают с просмотра мазков при помощи малого увеличения. Малое увеличение дает возможность охватить большее поле зрения, и, следовательно, быстрее могут быть обнаружены паразиты. Детальное же изучение паразита проводится при помощи иммерсионного объектива.
Приготовление микропрепаратов из мокроты,
мочи и спинномозговой жидкости
Для исследования мокроты ее выливают в чашку Петри из емкости, в которой она находится. Бактериологической петлей выбирают гнойные комочки и размазывают их тонким слоем по поверхности предметного стекла.
При исследовании мочи ее собирают в сосуд. Дают ей отстояться на холоду или центрифугируют. Из полученного осадка готовят микропрепараты.
При микроскопическом исследовании спинномозговой жидкости микропрепараты готовят из фибринозного сгустка или из осадка, полученного при отстаивании или центрифугировании жидкости.
Препараты следует готовить с большой осторожностью. После того как препараты высохнут, их фиксируют и окрашивают.
Необходимость приготовления мазка – отпечатка из селезенки, печени, костного мозга, лимфоидной ткани возникает по разным причинам: определить первостепенность обсеменения того или иного органа в зависимости от пути и времени проникновения возбудителя в макроорганизм, активности ответной реакции иммунокомпетентных органов, вирулентных особенностей возбудителя (отношение к капсулообразованию) и пр.
Для приготовления мазка – отпечатка необходимо стерильно сделать горизонтальный срез органа и на свежий срез быстро и аккуратно без приложения усилий накладывается стерильное обезжиренное предметное стекло. И также быстро поднимается вертикально вверх, без смещения в какую – либо сторону.
Препарат высушивается на воздухе, фиксируется в жидком фиксаторе, промывается осторожно проточной водой, высушивается, окрашивается и микроскопируется.
Мазки готовятся на предметных стеклах. Ввиду того что от качества стекла зависит и качество мазка, необходимо хорошо промывать его и обезжиривать.
Рис. Техника приготовления мазка.
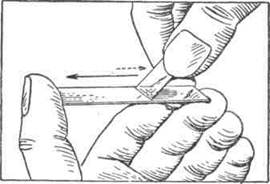
Стекло нужно хорошо промыть в проточной воде, а стекла, бывшие в употреблении, прокипятить в соде или еще лучше, по нашим наблюдениям,— в зольном щелоке. Прокипяченные в зольном щелоке стекла затем хорошо промывают в проточной воде, вытирают чистой сухой тряпочкой и помещают в смеси спирта с эфиром (в равных частях). Перед работой стекла вынимают с помощью пинцета и насухо вытирают чистым полотенцем. Лучшими стеклами являются приготовленные из фотопластинок, так как они не имеют пузырьков и поверхность их ровная и чистая.
В случае нужды можно использовать и старые стекла, бывшие в употреблении. После просмотра и браковки негодных стекол их подвергают тщательной обработке и очистке и после этого хранят в смеси спирта с эфиром.
Первую каплю крови удаляют ваткой, а из второй капли изготовляется мазок. Кровь необходимо использовать возможно быстрее, пока она не претерпела изменений И не потеряла своих фи-зических свойств. Быстронаступающее свертывание крови делает приготовление мазка совершенно невозможным.
Мазок крови нужно делать возможно быстрее и увереннее. При этом условии мазки получаются ровными, однородными и не имеют прерывистых линий (гармошка). При приготовлении мазка предметное стекло зажимается между большим и средним пальцами левой руки. В правой руке находится шлифованное покровное стекло. Капля крови снимается прикосновением поверхности предметного стекла. У беспокойных животных каплю крови можно снять углом покровного стекла, а затем перенести ее на предметное стекло. Для получения мазков хорошего качества необходимо брать небольшие капли крови.
Приготовленный мазок необходимо сейчас же высушить. Летом это можно сделать, положив его в перевернутом виде на спичку. Переворачивание стекла мазком вниз необходимо делать потому, что летом мазки очень часто портятся мухами. При работе в сыром и холодном помещении мазки можно высушивать на руке, а затем убирать в боковой карман, прикрыв его предварительно чистым стеклом с целью сохранения мазка от повреждения.
Если изготовление мазков производится на морозе 10—15°, то для предотвращения гемолиза, когда они внесены в помещение, их нужно сразу же опустить в кювету с метиловым спиртом и в таком виде нести в теплое помещение.
После фиксации в спирте в течение 5—10 минут мазки окрашиваются обычным методом. Обработанные таким образом мазки ничем не отличаются от сделанных в сухом и теплом помещении и могут быть использованы для самых тонких гематологических исследований.
Просушивание мазков на пламени горелки не рекомендуется, так как форменные элементы крови деформируются и мазки становятся непригодными для исследования. Когда мазок высох, на нем пишется порядковый номер, кличка животного или номер, а также дата приготовления мазка.
Для окраски и исследования отбираются лучшие мазки. Хороший мазок должен отвечать следующим требованиям.
1. Он должен быть уже и короче стекла, т. е. должен иметь свободные края по длине и зазубренный край по ширине в конце мазка.
2. Края мазка должны быть ровными.
3. Мазок должен быть тонким, гомогенным, без просветов и прерываю щих линий, с нежной поверхностью и без следов гемолиза.
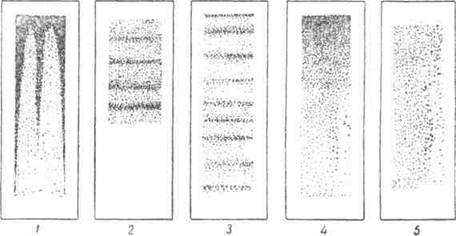
Рис. Правильно и неправильно приготовленные мазки: 1 — мазок на плохо обезжиренном стекле; 2 —слишком короткий мазок; 3 — слишком длинный неравномерный мазок; 4—слишком толстый мазок; 5—Правильный мазок, тонкий, равномерный и достаточно длинный.
При дальнейшем хранении препаратов необходимо оберегать их от насекомых, влаги, действия кислот и щелочей, дыма и различных газов. Плохо сохраняемые мазки становятся иногда совершенно непригодными для исследования, несмотря на качественное приготовление их вначале.
Фиксация мазков. Фиксация мазков преследует цель закрепить клетки крови в таком виде, чтобы форма и внутренняя структура их не изменялась. Большинство артефактов, обнаруживаемых при исследовании мазка крови, зависит от плохой фиксации. Лучшим фиксатором мазков является абсолютный метиловый спирт.
Спирт можно наслаивать непосредственно на мазок высоким слоем. Препарат в этом случае должен лежать горизонтально. Можно также опускать препарат в спирт, налитый в кюветы. В этом случае весь препарат погружается в спирт. Чтобы предотвратить улетучивание спирта, кювета закрывается крышкой или пробкой.
Фиксация метиловым спиртом производится в течение 3—5 минут. Спирт можно использовать для фиксации препаратов вторично, если он не загрязнен. Способ фиксации в кюветах удобен тем, что позволяет фиксировать одновременно четыре препарата.
Кроме метилового спирта, могут использоваться и другие фиксаторы:
1) абсолютный этиловый спирт. . 20 минут
5) осиева кислота (1%-ный водный раствор)] . . . 1/2—1 час
Неооходимо учитывать, что денатурированный спирт и 96° спирт дают очень много артефактов.
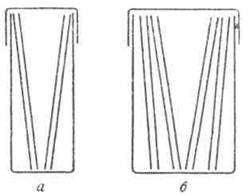
Рис. 90. Кюветы для фиксации мазков: А — узкая; Б—широкая.
Специальной фиксации мазков не делают только в тех случаях, когда фиксирующие вещества входят в состав красок, например, при окраске по Май-Грюнвальду и Лейшману.
Коммуникативный педагогический тренинг: способы взаимодействия с разными категориями учащихся
Сертификат и скидка на обучение каждому участнику

ОБЕСПЕЧЕНИЕ КАЧЕСТВА
ПРИГОТОВЛЕНИЯ ПРЕПАРАТА КРОВИ ДЛЯ ПОДСЧЕТА
ЛЕЙКОЦИТАРНОЙ ФОРМУЛЫ
Обеспечение качества клинических лабораторных исследований
Обеспечение качества клинических лабораторных исследований осуществляются в двух взаимосвязанных формах:
– на уровне системы здравоохранения России – внешняя оценка качества осуществляется Федеральной системой внешней оценки качества;
– на уровне клинико-диагностической лаборатории – внутрилабораторный контроль качества.
Контроль качества клинических лабораторных исследований на уровне системы здравоохранения России осуществляется Федеральной системой внешней оценки качества. Целью внешней оценки качества исследований является оценка соответствия их установленным нормам аналитической точности.
Обеспечение качества клинических лабораторных исследований на уровне клинико-диагностической лаборатории состоит в разработке и осуществлении мер, предупреждающих отрицательное влияние факторов преаналитического, аналитического и постаналитического этапов лабораторного исследования.
Внутрилабораторный контроль и участие в мероприятиях Федеральной системы внешней оценки качества является обязательным для лабораторий учреждений здравоохранения всех форм собственности и учитывается при их аккредитации и лицензировании.
Система контроля качества основана на принципах стандартизации всех этапов лабораторного исследования и анализе результатов внутрилабораторного контроля качества и внешней оценки качества.
Достоверность результатов лабораторных исследований характеризуется величинами погрешностей: систематической и случайной. Наиболее сложным и трудоемким. Для выявления и оценки систематических и случайных погрешностей результатов измерений, производимых в лаборатории, осуществляют внутрилабораторный и межлабораторный контроль качества лабораторных исследований.
Погрешность измерения – отклонение результата измерения от истинного значения измеряемой величины.
Систематическая погрешность измерения – погрешность, остающаяся постоянной или закономерно изменяющаяся при повторных измерениях одной и той же величины.
Случайная погрешность измерения – погрешность, изменяющаяся случайным образом при повторных измерениях одной и той же величины;
Межлабораторный контроль – это сравнительный контроль качества результатов исследований, полученных в ряде лабораторий при использовании единого контрольного материала.
Контрольный материал – однородный стабильный материал, результаты исследования которого используют для оценки погрешности выполняемых аналитических измерений.
Этапы лабораторного исследования
Внутрилабораторный контроль качества проводится на всех этапах лабораторных исследований.
Проведение клинических лабораторных исследований подразделяют на три этапа:
Преаналитический этап включает подготовку больного, взятие, хранение и транспортировку биологического материала в лабораторию.
На преаналитической стадии предусмотрен контроль:
- соответствия лабораторных приборов и оборудования планируемым видам исследований;
- оптимизации приготовления реактивов и процедур выполнения анализа;
- соответствия применяемых аналитических процедур рекомендованным методам исследований.
Лабораторный (аналитический) этап включает регистрацию поступившего в лабораторию биоматериала, проведение исследования и оформление результата анализа.
На аналитическом этапе контролируют:
- идентичность свойств контрольных образцов и исследуемых проб;
- стабильность условий, в которых оцениваются базовые характеристики (точность и отклонение) данного метода анализа;
- идентичность обработки контрольных образцов и исследуемых проб на всех этапах исследования;
- корректность оформления результатов внутрилабораторного контроля качества;
наличие четких критериев браковки, контрольных правил результатов анализа.
Постаналитический этап – включает интерпретацию результата анализа, знания врача границ нормы и патологии, критических значений показателей, единиц измерения.
Ошибки, приводящие к искажению результата анализа, возможны на каждом этапе лабораторного исследования. Известно, что наибольший процент ошибок допускается на преаналитическом этапе, который неизбежно приводит к искажению окончательных результатов лабораторных исследований. Самый эффективный путь устранения лабораторных ошибок, в том числе и на преаналитическом этапе – это разработка стандартов как на уровне ЛПУ, так и на уровне организации лабораторно-диагностического процесса в целом.
Алгоритм взятия капиллярной крови из пальца
ГОСТ Р 52623.4-2015 Технологии выполнения простых медицинских услуг инвазивных вмешательств.
1. Обработать кожу пальца пациента стерильным тампоном, смоченным 70% спиртом или другим раствором для дезинфекции кожи, заранее приготовленным в соответствии с рекомендациями производителя.
2. Захватить с боков ногтевую фалангу безымянного пальца левой руки пациента и слегка сдавить подушечку пальца для повышения упругости кожи и уменьшения болевых ощущений.
3. Стерильным скарификатором (или специальным устройством для прокалывания пальца) уколоть подушечку пальца сбоку на глубину 2 - 3 мм. Кровь из ранки должна вытекать свободно, без сильного надавливания на палец, так как при сильном надавливании возможно перемешивание тканевой жидкости.
3. Удалить первую выступившую каплю стерильным тампоном, так как состав крови в ней может быть изменена вследствие некоторого разрушения тканей в результате укола.
Техника приготовления мазка крови
1. Поместить каплю цельной крови диаметром 2-3 мм на предметное стекло.
2. Расположить шлифованное стекло на предметное под углом 45 градусов перед каплей, затем сдвинуть его назад, так чтобы оно коснулось крови, и капля растеклась по краю шлифованного стекла.
3. Сделать мазок быстрым, уверенным, легким движением, равномерно распределяя кровь от начала до конца предметного стекла.
Мазок должен иметь ровные боковые края, начало и располагаться на расстоянии 3-5 мм от края широких сторон стекла.
4. Высохший на воздухе мазок крови промаркировать простым карандашом, указывая фамилию, инициалы пациента и дату на неиспользуемой для исследования начальной части мазка.
Критерии оценки качества препарата крови
МУК 3.2.987-00 Паразитологическая диагностика малярии.
Необходимой предпосылкой для правильной оценки морфологических особенностей клеток крови является удачно приготовленный и хорошо окрашенный мазок крови. Невыполнение одного из этих условий ведет к неправильному распределению клеток крови или плохому выявлению их морфологических особенностей.
Критерии оценки качества мазка крови согласно Приказу № 545 МЗ СССР от 23.04.1985г.
1. Мазок должен начинаться на 1-1,5 см от узкого края предметного стекла и заканчиваться в 2 - 3 см от его другого края. Общая длина мазка должна охватывать 0,5-0,75 площади стекла.
3. Мазок должен быть "свободным с края". Другими словами, слой крови не должен достигать длинного края стекла, а между ним и краем должно оставаться расстояние в несколько миллиметров.
Мазки, превышающие 3/4 общей длины предметного стекла, очень толсты. Эритроциты в большей части такого препарата прижаты один к другому или ложатся монетными столбиками. Это мешает правильно исследовать их морфологию.
Мазки, размером меньше 1/2 предметного стекла, очень тонки. Лейкоциты отделены друг от друга, сильно деформированы и неправильно распределяются.
Отсутствие свободных от крови краев означает, что использованное при приготовлении мазка шлифовальное стекло касалось края предметного стекла. В таких случаях большие клетки перемещаются к краю мазка, и это вызывает неправильное распределение клеток.
В неравномерном (волнообразном) мазке распределение клеток крайне неудовлетворительно. Толстые участки содержат больше лимфоцитов, тонкие – больше моноцитов и сегментоядерных клеток.
Окраска препаратов крови
Инструкция по применению красителя азур-эозин по Романовскому
Диахим-гемистейн-Р Протокол №7 от 30.09.2002г.
Для достоверного исследования морфологии клеток большое значение имеет правильная его фиксация и окраска.
Окрашивание мазков крови требует внимания и опыта со стороны исследователя. Прекрасно приготовленный мазок может быть испорчен плохим окрашиванием. Причинами неудачного окрашивания может быть плохое качество краски или же несоблюдение правил окрашивания.
В настоящее время мазки крови окрашивают по методу Паппенгейма, согласно инструкции по применению раствора красителя азур-эозина по Романовскому.
Подготовка к анализу:
Перед началом окраски мазков крови необходимо приготовить рабочий раствор краски.
Рабочий раствор красителя готовят непосредственно перед окраской: смешать краситель с буферной водой в соотношении 1:20.
Полученный рабочий раствор красителя можно использовать в течение 6 часов.
Алгоритм окраски мазков крови:
1. Мазки крови фиксировать в фиксатор – красителе Май-Грюнвальда в течение 3-5 минут.
2.Промыть дистиллированной водой.
3.Фиксированные мазки окрасить рабочим раствором краски Романовского-Гимзе в течение 15-20 минут.
4. После окраски мазки промыть дистиллированной водой, высушить на воздухе и микроскопировать.
Результат окраски :
Окраска форменных элементов крови должна быть следующей:
– эритроциты окрашиваются в розовый или розовый с серым оттенком цвет;
– цитоплазма лимфоцитов окрашивается в голубой цвет;
– цитоплазма моноцитов окрашивается в серовато-голубой цвет;
– ядра лейкоцитов, молодых форм клеток эритроидного ряда окрашивается в вишнево-фиолетовый цвет;
– тромбоциты окрашиваются в вишнево-фиолетовый цвет;
– зернистость базофилов окрашивается в темно-лиловый цвет;
– зернистость эозинофилов окрашивается в оранжевый, или желто-оранжевый, или оранжево-красный цвет;
– зернистость нейтрофилов окрашивается в светло-фиолетовый цвет.
Только корректно приготовленный и окрашенный препарат крови должен быть использован для исследования морфологии клеток крови и определения лейкоцитарной формулы.
Вы не можете посетить текущую страницу по причине:
- просроченная закладка/избранное
- поисковый механизм, у которого просрочен список для этого сайта
- пропущен адрес
- у вас нет права доступа на эту страницу
- Запрашиваемый ресурс не найден.
- В процессе обработки вашего запроса произошла ошибка.
Пожалуйста, перейдите на одну из следующих страниц:
Если проблемы продолжатся, пожалуйста, обратитесь к системному администратору сайта и сообщите об ошибке, описание которой приведено ниже..
Читайте также:

