Как сделать магнетит
Добавил пользователь Алексей Ф. Обновлено: 05.10.2024
Но у компасов есть один большой недостаток: они работают только в Верхнем Мире. Те же самые загадочные физики Minecraft, которые заставляют блоки оставаться в воздухе в подвешенном состоянии, сбивают наши компасы в Нижнем Мире и Крае.
И, чтобы обхитрить этих вредителей, в последнем обновлении были добавлены новые блоки — магнетиты, позволяющие изменять место, на которое будут указывать компасы. Преимущество магнетитов в том, что они работают во всех трех измерениях. Так что теперь Вы можете брать компас и смело отправляться в любое место, главное не забудьте магнетиты! Магнетиты в Майнкрафте Бедрок часто встречаются в сундуках в развалинах бастиона, но если Вы не хотите искать, сделайте их самостоятельно. Для этого Вам понадобится незеритовый слиток, который нужно поместить в центр решетки крафта, а вокруг него расположить резные каменные кирпичи. Чтобы сделать незерит, нужно взять золото и осколки незерита, которые, в свою очередь, выплавляются из древних обломков. Еще Вам понадобится алмазная кирка для сбора древних обломков.

Большинство магнетитов на самом деле не являются магнитными , и даже если Вы намагнитите их, они не останутся таковыми надолго. Но иногда в их кристаллической структуре есть примеси, которые позволяют им оставаться намагниченными более длительный период. Это наводит на вопрос о том, как они становятся намагниченными с самого начала? У науки пока что нет четкого ответа на этот вопрос. Основная теория заключается в том, что магнетиты улавливают экстремальные магнитные поля, возникающие при ударе молнии в землю. Эта теория подтверждается тем фактом, что магнетиты встречаются только на поверхности Земли, и в более глубоких слоях их нет.
Также были найдены магнетитовые артефакты, созданные ольмеками на территории нынешней Мексики, которые, вероятно, использовались несколько тысяч лет назад. Нет определенных данных, для чего они были нужны, но одна из теорий — ориентация в храмах, жилищах и гробницах.
Теперь мы можем расширить совет по компасам в мире Minecraft Bedrock! Итак, в дальнейших своих путешествиях обязательно берите с собой не только компас, но еще и блок магнетита, чтобы успешно вернуться домой даже из Нижнего Мира и Края!
Изобретение может быть использовано в лакокрасочной и других отраслях промышленности. Способ получения магнетита включает образование гидроксида железа (II) с последующим его окислением. При этом частичное окисление гидроксида железа (II) проводят 0,4-6,0% раствором CuSO4, после чего осуществляют промывку полученного осадка с использованием магнитного поля. Изобретение позволяет упростить процесс получения магнетита, сократить его продолжительность и снизить энергозатраты. 1 з.п. ф-лы.
Изобретение относится к способам получения магнитных материалов, которые могут найти применение в самых различных отраслях народного хозяйства, даже не связанных с их магнитными свойствами, например в качестве пигментов в лакокрасочной промышленности.
Общими признаками известного и предлагаемого способов являются использование сернокислого железа (II) и аммиачной воды для получения суспензии гидроксида железа Fe(OH)2 и последующее окисление полученной суспензии до образования магнетита.
Недостатками известного способа являются длительность процесса, высокие энергетические затраты, использование дополнительных реактивов, сложность регулирования процесса получения образцов с заданными магнитными характеристиками.
Общими признаками известного и предлагаемого способов являются использование растворов сульфата двухвалентного железа и щелочи (NaOH) для получения гидроксида железа Fe(ОН)2, а также окисление Fe(OH)2 до образования магнетита.
Недостатками известного способа получения магнетита являются использование дополнительного материала - лепидокрокита, что приводит к удорожанию процесса в целом, высокие энергетические затраты на поддержание температуры в реакторе, перемешивание, подачу воздуха на продувку суспензии, а также длительность проведения процесса.
Наиболее близким к заявляемому является способ получения магнетита из сульфата двухвалентного железа, который в наибольшей степени пригоден для осуществления его в промышленном масштабе (патент Великобритании №1487008, М.кл. 3 C01G 49/08, C01G 49/06, приоритет 24.02.1975). На первой стадии к раствору сернокислого железа (II) при перемешивании добавляют водный раствор щелочи (NaOH или NH4OH) в количестве, необходимом для осаждения 2/3 железа в виде Fe(OH)2. Эту операцию проводят при температуре 15-40°С и полученную суспензию продувают воздухом 5-15 л/л реактора × час. В этих условиях должен образовываться гетит по уравнению:
Процесс контролируется значениями рН и redox потенциала в суспензии. При этом требуется обеспечить соотношение Fe(II)/Fe(III), близкое к 0,5. Затем к суспензии добавляют щелочь для осаждения оставшегося двухвалентного железа в виде Fe(OH)2. Суспензию нагревают при перемешивании до 70-100°С (преимущественно до 90°С). На этой стадии образуется магнетит по уравнению:
Общим признаком известного и предлагаемого способов является наличие стадии образования гидроксида железа (II) и стадии окисления гидроксида железа (II).
Недостатками известного способа следует считать его многостадийность, большие энергетические затраты, сложность контроля за процессом получения магнетита.
Техническая задача заключается в упрощении процесса получения магнетита, снижении энергозатрат и снижении продолжительности процесса.
Поставленная задача достигается тем, что в способе получения магнетита, включающем образование гидроксида железа (II) с последующим его окислением, частичное окисление гидроксида железа (II) проводят раствором CuSO4, после чего осуществляют промывку полученного осадка с использованием магнитного поля.
Кроме того, частичное окисление гидроксида железа (II) проводят 0,4-6,0% раствором CuSO4.
Заявляемая совокупность признаков позволяет резко повысить эффективность процесса получения магнетита, снизить энергетические затраты и продолжительность процесса, а соблюдение требуемого соотношения окислителя к количеству Fe(II) в гидроксиде железа (II) или исходном растворе исключает необходимость контроля за отдельными стадиями процесса образования магнетита. Если продолжительность процесса получения магнетита, описанного в прототипе, длится многие часы, то в предлагаемом способе процесс его получения заканчивается в считанные минуты.
Предлагаемый способ получения магнетита осуществляют следующим образом. В реакторе емкостью, достаточной для получения заданного количества магнетита, растворяют соль двухвалентного железа, например FeSO4. После завершения процесса растворения в реактор добавляют раствор щелочи, в результате чего образуется гидроксид железа (II). В качестве щелочи могут быть использованы NaOH, KOH или NH4OH.
Процесс образования магнетита можно условно разделить на две стадии: частичное окисление гидроксида железа (II) до железа (III) раствором CuSO4 и последующая стадия образования магнетита, заключающаяся во взаимодействии гидроксидов железа (II) и железа (III). Скорость образования магнетита может определяться скоростью любой из стадий, а качество магнетита зависит от соотношения скоростей этих стадий.
Высокая скорость процесса окисления Fe(ОН)2 по предлагаемому способу обеспечивает и высокую скорость образования магнетита. В предлагаемом способе получение магнетита (предположительно) протекает по следующим уравнениям:
На процесс окисления гидроксида Fe 2+ раствором CuSO4 большое значение оказывает концентрация CuSO4. Наилучшие результаты получены при использовании 0,4-6,0% раствора CuSO4.
После добавления окислителя к гидроксиду железа (II) полученную суспензию перемешивают еще несколько (до 5 минут), после чего включают магнитную систему, в результате чего образовавшиеся частицы магнетита быстро оседают на стенках сосуда (реактора) в зонах максимальной индукции магнитного поля, а не на дне аппарата. Маточный раствор сливают и аппарат заполняют дистиллированной водой. Выключают магнитную систему, и магнитные частицы при перемешивании хорошо омываются дистиллированной водой. Операцию промывки проводят 2-3 раза, после чего суспензию магнетита отфильтровывают и высушивают. Магнитная система, удерживающая частицы магнетита на стенках реактора, может быть самой различной конструкции. Использование магнитного поля при промывке частиц магнетита позволяет сократить число и продолжительность промывок, т.к. при обычной промывке с декантацией маточного раствора скорость осаждения частиц резко уменьшается при снижении рН маточного раствора, что приводит к увеличению числа промывок и продолжительности промывки магнетита.
Все операции по получению частиц магнетита следует проводить при комнатной температуре, не прибегая к нагреву суспензии гидроксида железа (II) и исходного раствора железа (II).
Пример 1. В 2 л дистиллированной воды растворяют 172,5 г FeSO4. К раствору приливают 320 мл раствора NH4OH 25% концентрации. К образовавшемуся гидроксиду Fe 2+ добавляют при перемешивании 1,5 л раствора, содержащего 99,1 г CuSO4. Перемешивание продолжают еще 5 минут, после чего дают возможность осесть образовавшимся частицам магнетита. Промывку осадка от солей ведут с использованием магнитного поля, которое удерживает частицы магнетита при сливе маточного раствора. После двукратной промывки частиц магнетита осадок высушивают. Получено 94,6 г магнетита с намагниченностью насыщения 86,3 А·м 2 /кг, что позволяет сделать вывод об отсутствии немагнитных включений.
Пример 2. Готовят раствор FeSO4·7H2O, в котором в 1,2 л воды содержится 86,3 г соли. Раствор смешивают с заранее приготовленным раствором KOH, в который добавлено 54,3 г CuSO4. Количество КОН в растворе составляет 43,5 г. После смешения растворов перемешивание продолжают еще 5 минут. Суспензию выдерживают в течение 35 минут для осаждения образовавшихся частиц магнетита. Промывку осадка проводят 3 раза, причем в дистиллированную воду для промывки осадка добавляют по 10 мл аммиачной воды для полного удаления ионов меди. Получено 46,9 г магнетита с намагниченностью 83,9 А·м 2 /кг.
Пример 3. Исходные реактивы (соли железа и меди) в тех же количествах, что и в примере 5. Основное отличие заключается в том, что к раствору двухвалентного железа FeSO4 добавляют раствор сернокислой меди CuSO4 и потом добавляют раствор NH4OH в количестве 160 мл. Перемешивание продолжают еще 5 минут. После осаждения осадка его промывают три раза дистиллированной водой с использованием магнитного поля без добавления в нее аммиака. Промытый осадок высушивают и взвешивают. Магнетит, полученный в количестве 45,7 г, имеет намагниченность насыщения 86,8 А·м 2 /кг.
Таким образом, предлагаемый способ позволяет упростить процесс получения магнетита, снизить энергетические затраты, сократить продолжительность процесса.
1. Способ получения магнетита, включающий образование гидроксида железа (II) с последующим его окислением, отличающийся тем, что частичное окисление гидроксида железа (II) проводят раствором CuSO4, после чего осуществляют промывку полученного осадка с использованием магнитного поля.
2. Способ по п.1, отличающийся тем, что частичное окисление гидроксида железа (II) проводят 0,4-6,0%-ным раствором CuSO4.
Изобретение относится к области получения магнитных жидкостей, представляющих собой коллоидные растворы, содержащие высокодисперсные частицы ферро- или ферримагнитных материалов, стабилизированные жирными кислотами, для использования при разделении немагнитных материалов по плотности, в контрольно-измерительных приборах, в медицине и др.
Изобретение относится к созданию коллоидных систем и может быть использовано в различных областях техники. .
Изобретение относится к области получения жидких намагничивающихся сред на различных основах с частицами магнетита или ферритов и может быть использовано в уплотнительных устройствах, в дефектоскопии, в приборах контроля, при разделении немагнитных материалов по плотности.
Самым распространенным способом получения магнитных жидкостей на сегодняшний день является метод химической конденсации. Чтобы синтез магнетита прошел успешно, необходимо четкое соблюдение пропорций реактивов и технологии работы с ними. Изложим его основные технологические операции.
Исходные реактивы для получения нанодисперсного магнетита — это водные растворы солей железа: FeCl3 • 6Н2О и FeS04 х х 7Н2О. В расчете на 25 г магнетита требуется 138 мл раствора FeCl3 • 6Н2О, приготовленного растворением 0,8 кг соли в литре дистиллированной воды. Раствор можно использовать в течение 1 месяца со дня приготовления. Для приготовления необходимого количества раствора FeS04 • 7НгО следует 38 г соли полностью растворить в 75 мл воды при постоянном перемешивании. При растворении раствор нельзя нагревать во избежание перехода двухвалентного железа в трехвалентное состояние. Полученные таким образом растворы солей железа сливают в общую колбу, куда при постоянном перемешивании приливают 180 мл 25%-го водного раствора NH4OH.
Получение магнетита происходит методом химической конденсации по реакции

т. е. соосаждением солей 2- и 3-валентного железа (FeCl3 • 6Н2О, FeSC>4 • 7Н2О) избытком 25 %-го водного раствора гидроксида аммония (NH4OH). Одно из условий получения магнетита коллоидной степени дисперсности — интенсивное перемешивание растворов с целью ограничения роста частиц.
Для отделения магнетита колбу с водной суспензией магнетита и продуктами реакции переносят на магнит, где магнетит отделяется от маточного раствора (продуктов реакции) путем магнитной сепарации. При этом водная суспензия магнетита в виде осадка находится внизу, что позволяет декантацией слить маточный раствор. (Под декантацией в химической лабораторной практике и химической технологии понимается механическое отделение твердой фазы дисперсной системы (суспензии) от жидкой путем сливания раствора над осадком.) Процесс промывания суспензии следует повторить несколько раз. По окончании последней промывки колбу снова ставят на магнит с целью концентрирования водной суспензии магнетита и максимального удаления из нее воды.
Пептизация магнетита, приготовленного соосаждением солей, является следующим важным этапом приготовления магнитной жидкости. Под пептизацией понимается стабилизация магнетита для получения концентрата магнитной жидкости в водной среде. Для этого при нагревании до 50-60 °С готовят смесь олеиновой кислоты в трансформаторном масле с соотношением компонентов 1:1 (10 мл трансформаторного масла и 10 мл олеиновой кислоты). Затем при постоянном ручном перемешивании и нагревании на электрической плитке к водной суспензии магнетита при 75-80° приливают смесь олеиновой кислоты и трансформаторного масла. Процесс длится 3-5 мин.
Чтобы полученная магнитная жидкость была стабильной и не расслаивалась с течением времени, необходимо обезвоживание концентрата МЖ (пасты). Для этого при 75-80°С пасту промывают этиловым спиртом до тех пор, пока спирт не станет прозрачным (примерно 150 мл на 25 г магнетита). Процесс проводят при интенсивном перемешивании вручную, с подогревом смеси пасты и этилового спирта до 60-70 °С. При этом происходит окончательное обезвоживание пасты.
Для диспергирования концентрата МЖ к нему приливают небольшими порциями (по ~20 мл) трансформаторное масло. Предварительное перемешивание производят вручную (палочкой с фторопластовым наконечником), затем стакан с технической МЖ ставят на плитку, где при 80-85 °С в течение 1-2 ч продолжается диспергирование при перемешивании МЖ автоматической мешалкой. Получившуюся МЖ — однородный, черный с характерным блеском продукт — охлаждают затем до комнатной температуры, продолжая перемешивание на автоматической мешалке.
Приготовление МЖ завершается ее центрифугированием. Для этого техническую МЖ разливают в пластмассовые стаканы и центрифугируют с фактором разделения 6000 g в течение 1 ч.
По окончании процесса можно приступать к измерению параметров (намагниченности насыщения, плотности, вязкости и т. д.).
В работе представлены результаты по разработке оптимального способа получения однородных по химическому составу и размерам наночастиц магнетита в атмосфере инертного газа на основе метода химического соосаждения. Исследованы структура и химический состав полученных наночастиц методами просвечивающей электронной микроскопии (ПЭМ), электронной дифракции с селекторной диафрагмой (SAED) и рентгенофазового анализа. Впервые обнаружено, что при проведении синтеза в инертной атмосфере и температуре 70 °С при значениях рН исходной смеси в диапазоне 6,5–2,0 наблюдается наличие примеси наностержней (гоэтит). Показано, что при проведении синтеза в атмосфере азота при рН 1,8–1,9 и температуре 70 °С полученные наночастицы являются магнетитом и не содержат примеси наностержней. Средний диаметр полученных наночастиц составил 12 ± 4 нм. Обсуждается механизм образования наностержней.



1. Pankhurst Q.A., Thanh N.T.K. et al. Progress in applications of magnetic nanoparticles in biomedicine // Journal of Physics D: Applied Physics. – 2009. – Т. 42, № 22. – С. 224001.
2. Брусенцов Н.А., Байбуртский Ф.С., Комиссарова Л.Х., Филиппов В.И. и др. Технологии получения и применения полифункциональных магнитоуправляемых супермагнитных препаратов (обзор) // Химико-фармацевтический журнал. – 2002. – Т. 36, № 4. – С. 32–40.
3. Lu A.H., Salabas E.L., Schuth F. Magnetic nanoparticles: synthesis, protection, functionalization, and application // Angewandte Chemie International Edition. – 2007. – Т. 46, № 8. – С. 1222–1244.
4. RuizMoreno R.G., Martinezet A.I. et al. Synthesis and Characterization of Citrate Coated Magnetite Nanoparticles. // J.of Superconductivity and Novel Magnetism. – 2013. – V. 26, № 3. – P. 709–712.
6. Sun J., Zhou S., Hou P. et al. Synthesis and characterization of biocompatible Fe3O4 nanoparticles // Journal of biomedical materials research Part A. – 2007. – Т. 80, № 2. – С. 333–341.
7. Комиссарова Л.Х., Татиколов А.С., Марнаутов Н.А. и др. Оптимизация метода массарта для получения биосовместимых наночастиц магнетита с заданными размерами // Актуальные вопросы биологической физики и химии. – 2016. – № 1–2. – С. 44–47.
8. Marino-Fernandez R., Masunaga S. H., et al. Goethite ( -FeOOH) nanorods as suitable antiferromagnetic substrates // The Journal of Physical Chemistry C. – 2011. – Т. 115, № 29. – С. 13991–13999.
9. Нгуен А.Т. Механизм формирования наночастиц LaFeO3, полученных золь—гель методом // Всероссийский журнал научных публикаций. – 2011. – № 6. – С. 80–82.
10. Dousma J., Den Ottelander D., De Bruyn P. L. The influence of sulfate ions on the formation of iron (III) oxides // Journal of Inorganic and Nuclear Chemistry. – 1979. – Т. 41, № 11. – С. 1565–1568.
11. Назаренко В.А. Гидролиз ионов металлов в разбавленных растворах / В.А. Назаренко, В.Н. Антонович, Е.М. Невская. – М.: Атомиздат, 1979. – С. 139–149.
С каждым годом магнитные наночастицы находят все более широкое применение в биомедицине, они применяются для гипертермии опухолей и адресной доставки лекарственных средств, на их основе создаются МРТ-контрастирующие агенты и высокоточные биосенсоры [1, 2]. Наибольшее распространение среди магнитных наночастиц в области биомедицины находят наночастицы магнетита. Наноразмерный магнетит может быть получен различными способами, такими как гидротермальный синтез, высокотемпературное разложение органических солей железа, а также методом соосаждения [3, 4]. Метод соосаждения является наиболее доступным способом получения наночастиц магнетита, т.к. в отличие от других методов он не требует высоких температур, экологически безопасен и сравнительно прост в реализации. Тем не менее, несмотря на его распространенность и простоту реализации, не существует единой методики его проведения: варьируют физико-химические условия синтеза, что отражается на характеристиках получаемых наночастиц. Обычно наибольшая неоднозначность в методике получения наноразмерного магнетита по методу соосаждения двух- и трехвалентных солей железа из водного раствора аммиака заключается в вопросе использования инертной атмосферы. Ряд авторов проводят реакцию в присутствии кислорода воздуха [4, 5], в то время как, по мнению других авторов [6, 7], необходимо использовать инертную атмосферу. Присутствие кислорода воздуха создает опасность окисления двухвалентного железа до трехвалентного, в результате чего вместо магнетита (Fe3O4), обладающего сильными ферромагнитными свойствами, может образоваться маггемит (γ-Fe2O3), магнитные свойства которого выражены значительно слабее, или α-Fe2O3, который ими вообще не обладает. Наш собственный опыт показывает, что желательно проводить реакцию в инертной атмосфере, это позволяет получать наиболее воспроизводимые результаты. Однако, даже используя инертную атмосферу, можно наблюдать довольно необычные результаты при получении наноразмерного магнетита.
Цель исследования
Разработка оптимального способа получения однородных по химическому составу и размерам наночастиц магнетита в инертной атмосфере на основе метода соосаждения путем подбора физико-химических условий синтеза наночастиц для их использования в биологии и медицине.
Материалы и методы исследования
Методика получения наночастиц магнетита
Реакция проводится в атмосфере азота в трехгорлой колбе на магнитной мешалке с использованием масляной бани. Навески сульфата железа (II) и хлорида железа (III) в мольном соотношении 2:1 растворяют в дистиллированной воде. В опытах № 1–3 дистиллированная вода предварительно кипятилась в атмосфере инертного газа. В опытах № 4–6 прокипяченная дистиллированная вода дополнительно подкислялась до pH 2,1–2,2 раствором соляной кислоты. В опытах № 7–10 прокипяченная дистиллированная вода подкислялась раствором соляной кислоты до pH 1,8–1,9. В результате образуется водный раствор, содержащий смесь хлоридов железа (II) и (III) с концентрацией 2мас. %. Полученный раствор нагревают до 70 °C при постоянном перемешивании в токе азота. После чего приливают аммиачный раствор (4 объем. %) со скоростью 240 мл/мин. Затем реакционная смесь выдерживается при постоянном перемешивании в токе азота при температуре 70 °C в течение 30 минут. Полученные наночастицы осаждают путем магнитной сепарации на постоянном неодимовом магните, с индукцией на поверхности 3 mTl, супернантант отбрасывают, осадок промывают дистиллированной водой, процедуру повторяют многократно, до достижения значения pH 7,0 в промывных водах. После отмывки наночастицы осаждают на магните и ресуспендируют в дистиллированной воде, предварительно прокипяченной в атмосфере инертного газа. Образовавшуюся суспензию переносят в емкость, предварительно продутую азотом, и хранят в герметичной емкости при температуре 2–4 °C. Для определения концентрации полученной суспензии из суспензии после тщательного перемешивания отбирают пять аликвот по 1 мл, которые сушат до постоянного веса в сушильном шкафу при температуре 120 °C.
Результаты исследования и их обсуждение
При проведении первой серии опытов (опыты № 1–3) были получены наночастицы магнетита с примесью наностержней. На рис. 1, а представлена микрофотография частиц, полученных в опыте № 1, на данной микрофотографии отчетливо видны наностержни длиной от 20 до 400 нм и толщиной порядка 2 нм. Наностержни являются побочным продуктом реакции и их наличие нежелательно. Рис. 1, б представляет собой микрофотографию тех же частиц в темном поле. На микрофотографии частиц в темном поле наиболее отчетливо видны вещества, обладающие кристаллической решеткой, в то время как аморфные вещества будут слабо различимы, поэтому можно заключить, что данные стержни имеют кристаллическую решетку и, скорее всего, являются монокристаллами.



Рис. 1. Электронные микрофотографии наночастиц, синтезированных в первой серии опытов: а) в светлом поле; б) в темном поле; в) электронная дифракция (SAED)
Согласно спектру SAED (рис. 1, В), можно утверждать, что данные наностержни имеют состав отличный от магнетита, т.к. на спектре, помимо колец характерных для магнетита наблюдаются кольца ему не соответствующие. Не характерные для магнетита кольца очень слабо выражены, что указывает на то, что наностержни являются примесью. Из-за слабой выраженности нехарактерных колец, а также из-за их наложения на кольца магнетита охарактеризовать их и однозначно определить химический состав наностержней довольно затруднительно. Основываясь на литературных данных, можно предположить, что по химическому составу наностержни представляют собой гоэтит (α-FeOOH). Так, в работе Rosalia Marino-Fernandez и коллег был синтезирован гоэтит по методу аналогичному методу соосаждения [8]. Из анализа электронных микрофотографий, приведенных в этой работе, видно, что наноразмерный гоэтит представляет собой наностержни, похожие на те, что были получены нами. Наиболее вероятной причиной образования наностержней является гидролиз трехвалентного железа с образованием нерастворимых соединений, предшествующий гидролизу двухвалентного железа. Осаждение нерастворимых гидроокисей трехвалентного железа наблюдается уже при pH 2,2, тогда как для образования нерастворимых гидроокисей двухвалентного железа требуется pH не меньше 7,0, а для их полного осаждения требуется pH 9,0–14,0 [9–11]. Таким образом, возможна ситуация, когда гидролиз трехвалентного железа с образованием нерастворимых соединений уже начался, а гидролиз двухвалентного железа еще не происходит. В этом случае образование магнетита становится невозможным, так как для его получения требуется одновременное соосаждение как Fe 2+ , так и Fe 3+ . В результате преждевременного гидролиза Fe 3+ образуется гидроксид железа, который затем переходит в ферригидриты переменного состава: 5Fe2O3 х 9H2O или Fe2O3•xH2O (x = 1÷5). В результате старения полученные ферригидриты переходят в оксигидроксид трехвалентного железа (III) FeO(OH). Избежать преждевременного осаждения трехвалентного железа можно путем подкисления исходного раствора до pH, при котором не будет наблюдаться гидролиз Fe 3+ . Затем к подкисленному раствору необходимо быстрое прибавление раствора аммиака до достижения значений pH 9,0–14,0, при которых будет протекать одновременный гидролиз Fe 3+ и Fe 2+ с образованием магнетита. Для того, чтобы предотвратить преждевременное осаждение Fe 3+ , во второй серии опытов (опыты № 6–8), раствор солей железа предварительно подкислялся до pH 2,0–2,3. В остальном опыт был аналогичен опыту № 1. При подкислении количество и размер образовавшихся наностержней значительно уменьшились. Тем не менее, все равно можно было наблюдать их незначительное присутствие, что видно на рис. 2, а.
Спектры SAED, полученные во второй серии опытов, имели схожий вид со спектром SAED, полученным в опыте № 1, и на них также присутствовали кольца не характерные для магнетита.
а) б)
Рис. 2. Электронные микрофотографии наночастиц: а) синтезированных во второй серии опытов; б) синтезированных в третьей серии опытов
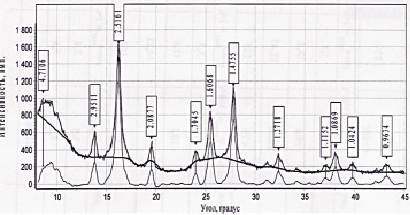
Рис. 3. Рентгенограмма образца, синтезированного в третьей серии опытов
Для того, чтобы полностью предотвратить образование наностержней, была проведена третья серия опытов, в них исходный раствор солей железа был подкислен еще сильнее до pH 1,8–1,9, в остальном способ проведения реакции остался неизменным. Благодаря подкислению исходной реакционной смеси удалось полностью избавиться от нежелательной примеси. На рис. 2, а представлена микрофотография наночастиц, синтезированных из маточного раствора, подкисленного до pH 1,8–1,9. На данной микрофотографии отчетливо видно, что в ходе реакции образовались только наночастицы магнетита. Химический состав полученных наночастиц соответствует магнетиту (Fe3O4) и подтвержден с помощью рентгенофазового анализа (рис. 3) и электронной дифракции (рис. 2, б). Отсутствие примесей в конечном продукте, подтверждается как химическим составом конечного продукта, так и отсутствием наностержней.
Основываясь на анализе данных, полученных с помощью электронной микрофотографии (рис. 2, а), электронной дифракции (SAED) и данных рентгенограммы наночастиц (рис. 3), можно утверждать, что наночастицы, полученные в третьей серии опытов, являются наночастицами магнетита со средним диаметром частиц 12 ± 4 нм.
Заключение
Таким образом, на основе анализа и подбора физико-химических условий синтеза наночастиц магнетита методом соосаждения разработан оптимальный способ получения однородных по химическому составу и размерам наночастиц магнетита в атмосфере инертного газа (азот) при температуре 70 °С. Методами просвечивающей электронной микроскопии, электронной дифракции с селекторной диафрагмой SAED и рентгенофазового анализа показано, что при проведении синтеза в атмосфере азота при рН 1,8–1,9 и температуре 70 °С полученные наночастицы являются магнетитом со средним диаметром частиц 12 ± 4 нм без примесей других соединений железа (гоэтит). Полученные наночастицы магнетита могут быть использованы для биомедицинских целей.
Исследование выполнено при финансовой поддержке фонда РФФИ, проект № 16-03-00735.
Читайте также:

