Как сделать латунирование металла
Добавил пользователь Валентин П. Обновлено: 04.10.2024
Покрытие латунью стали и алюминия в домашних условиях. Рецепт базового электролита. Ссылка на покрытие алюминия .
Готовим два электролита латунирования и покрываем металл латунью. Никелирование в домашних условиях .
Фатеев Алексей Михайлович, МХТИ им. Д.И.Менделеева,1975-1981гг. Гальваническое покрытие латунью из электролита .
Как сделать покрытие под золото на металлах. Простые технологии для домашнего использования. НЕ химическая .
Есть очень простой способ покрыть латунью железные детали. В этом видео я расскажу, как в домашних условиях простое .
Самое дешевое никелирование в домашних условиях, сделай сам. Секреты домашней химии для мастерской . Ржавчины .
IMBA ENERGY DRINK - l.imba.energy/tt1 Промокод - THOISOI Составы электролитов и доп. информация о золочении: .
Как покрыть латунью (латунировать) металлические детали в домашних условиях. Пошаговое описание процесса.
Уникальный электролит золочения, который не содержит золота. Что бы добавить золото в электролит, нужно лишь .
Как хромировать в домашних условиях, электролит на основе хромового ангидрида. Покрываю хромом корпуса часов .
Приветствую на канале "Лёха Технарь" В этом видео, я расскажу про самодельное покрытие медью в домашних условиях.
Фатеев Алексей Михайлович, МХТИ им. Д.И.Менделеева,1975-1981гг. Разработан новый электролит латунирования: .
Простой способ серебрения в домашних условиях. Заказать реставрацию или химию для реставрации можно на сайте .
Как сделать меднение ,в гараже не используя электрические девайсы .Хитрая идея своими руками. Мало кто знает этот .
Приветствую на канале "Лёха Технарь" В этом видео, я покажу хитрости старых мастеров как в домашних условиях, .
Как сделать меднение своими руками в домашних условиях? Очень просто - с помощью "ТУАЛЕТНОГО УТЕНКА"и медной .
Гальванопластика - техника электролитического осаждения металлов на поверхности различных предметов (матриц) с .
Гальванотехника - раздел прикладной электрохимии, описывающий физические и электрохимические процессы, .
Я вам покажу процесс хромированные в домашних условиях это легко и просто не нужно никакого оборудования при .
Как защитить металл от коррозии своими руками? Делаю оцинковку в гараже, без применения электричества, .
Как сделать электролит никелирования и покрывать металл никелем в домашних условиях. Состав на 1 литр электролита .
Чернение (патинирование) латуни в домашних условиях средством Brass Black Birchwood Casey. Патинирование .
Всем привет на моем канале сегодня вам хочу показать химическое никелирование латуни то есть кот корпус я буду не .
Приветствую на канале "Лёха Технарь" в этом видео покажу как своими руками в домашних условиях анодировать .
Как идеально отполировать латунь? Разбирались с этим вопросом в прямом эфире. В режиме онлайн полировали латунь, .
Ваша добровольная финансовая помощь поможет мне внедрить и представить в открытый доступ еще больше новых .
Как сделать патину на латунь и медь? патина латуни ,и меди своими руками. гвальтовка латуни. спасибо что подписаны и .
Дошли наконец-то руки до патинирования мехов. Попробовал разные варианты - и банальные "соль аммиак", .
Если видео было полезным, не забывайте ставить лайки, подписываться и оставлять комментарии. Другие полезные .
Простой способ сделать омеднение металлических деталей в домашних условиях. Рецепт электролита: на 100 мл. воды .
Андрей Левицкий был одним из многочисленных львовских рестораторов, как вдруг ему понадобилась хорошая пряжка для .
Плавлю латунь в опоку. С виду расплавить латунь просто, но вот отлить её в опоку по готовой модели - здесь нужно набить .
Наибольшее распространение имеют покрытия из сплавов меди с цинком и оловом. Электроосаждение медноцинковых сплавов (латунирование) было разработано Б. С. Якоби еще в середине XIX столетия и с тех пор осуществляется практически только из цианистых электролитов. Раньше латунирование широко практиковали для нанесения промежуточного слоя на сталь перед никелированием. В настоящее время этот процесс преимущественно используют для обеспечения прочного сцепления между стальными и алюминиевыми изделиями с резиной при горячем прессовании.
Медь и цинк сильно различаются по электрохимическим свойствам: разность их стационарных и катодных потенциалов (в растворах простых солей) превышает 1 В. Сближение их стационарных и катодных потенциалов возможно в присутствии таких комплексообразователей, которые уменьшают активность ионов меди в несравненно большей степени, чем активность ионов цинка. Кроме того, необходимо, чтобы разряд ионов меди протекал с большей поляризацией, чем разряд ионов цинка. Хотя для совместного осаждения меди и цинка на катоде предложен ряд комплексных растворов, на практике преимущественно применяются цианистые электролиты. В этих электролитах достигаются минимальная разность равновесных потенциалов и еще меньшая разность катодных потенциалов; при плотности тока 0,5 А/дм2 потенциал разряда ионов меди электроотрицательнее потенциала разряда ионов цинка.
Катодная поляризация меди в цианистых электролитах особенно при низких плотностях тока, значительно превосходит катодную поляризацию цинка (рис. 89). Руководствуясь этим основным положением и используя различные факторы, определяющие относительное положение поляризационных кривых меди и цинка в цианистых электролитах, можно с достаточным приближением регулировать состав латунных покрытий.
Рис. 89. Катодная поляризация при электроосаждении меди, цинка и медноцинкового сплава из цианистых электролитов при температуре 30° С: 1 — 30 г/л Cu, 10 г/л NaCNсвоб: 2 — 30 г/л Zn, 10 г/л NaCN; 3 — 30 г/л Cu, 30 г/л Zn, 10 г/л NaCNсвоб
Было установлено, что лишь при очень значительном изменении отношений меди к цинку в электролите заметно меняется состав латунных осадков. Так, при увеличении в электролите отношения Cu: Zn в 256 раз содержание меди в катодном осадке повышается примерно в 2 раза. В пределах изменений отношений Cu: Zn от 2:1 до 1:1 процентное содержание меди в сплаве снижается на 2,6%.
На рис. 90 видно также, что повышение температуры электролита способствует увеличению содержания меди в сплаве, что можно объяснить большим снижением поляризации меди по сравнению с поляризацией цинка при одинаковом повышении температуры.
Рис. 90. Влияние плотности тока на содержание меди в латунном осадке при температуре 30, 40, 50 и 60° С. Ось абсцисс: плотность тока, А/дм2; ось ординат — содержание меди в катодном осадке, %
Несравненно большее влияние на состав сплава и на выход по току оказывает концентрация свободного цианида. Чем выше концентрация свободного цианида, тем меньше содержание меди в катодном осадке. Не следует говорить о содержании свободного цианида в латунных электролитах в том смысле, как в медных, серебряных, золотых, кадмиевых цианистых электролитах. Дело в том, что в латунных электролитах присутствуют не только цианистые цинковые комплексы, но и щелочные, которые находятся между собой в подвижном равновесии: Na2Zn(CN)4 + 4NaOH ↔ Na2ZnO2 + 4NaCN + 2H2O.
С увеличением щелочности электролита равновесие сдвигается вправо в сторону образования щелочных (цинкатных) комплексов, из которых цинк выделяется на катоде при менее электроотрицательном потенциале, и катодные осадки сильно обогащаются цинком. По этой причине необходимо время от времени определять значения рН в электролите. При большой щелочности электролита не удается получать латунные осадки желтого цвета, они по внешнему виду напоминают цинковые; при недостаточной щелочности осадки по внешнему виду напоминают медные.
С повышением концентрации свободного цианида в электролите уменьшается содержание меди в катодном осадке и соответственно повышается содержание цинка в нем. Это можно объяснить тем, что с повышением содержания свободного цианида катодная поляризация меди возрастает в несравненно большей степени, чем катодная поляризация цинка.
Концентрация свободного цианида влияет не только на состав катодных осадков, но и на выход по току. С повышением концентрации свободного цианида резко снижается катодный выход по току и повышается анодный выход. Анодный выход может быть повышен также в результате понижения анодной плотности тока, т. е. с увеличением поверхности анодов.
С повышением плотности тока резко снижается выход по току. Чаще поддерживают плотность тока в пределах 0,3—0,5 А/дм2.
Температура электролита оказывает заметное влияние на внешний вид покрытий, их состав и выход по току. Влияние температуры противоположно влиянию плотности тока. С повышением температуры повышаются содержание меди в осадке и суммарный выход по току.
Прочность сцепления стали и алюминия с резиной при горячем прессовании зависит от состава латуни и мало зависит от ее внешнего вида, что иллюстрируется данными табл. 37.
Из данных табл. 37 следует, что по внешнему виду не всегда можно судить о составе латунных покрытий и прочности сцепления с ними резины. Необходимо стремиться к получению α-латунных покрытий примерного состава 70% Cu и 30% Zn с допустимыми отклонениями в обе стороны в пределах 3—3,5%. Толщина латунных покрытий в пределах 1—5 мкм на прочность сцепления существенного влияния не оказывает.
Ниже приводятся составы, г/л, наиболее широко применяемых электролитов для латунирования и режим: Cu (в виде CuCN)……….20 Zn (в виде ZnO)…… 7,5 NaCN своб …. 10,0 Na2SO3….. 10,0 NH4OH (25%-ный) … 0,25 Плотность тока, А/дм2 … 0,3—0,5 Температура, °С … 30—40 рН……. 11
Поверхность латунных анодов должна быть в 2—3 раза больше поверхности катодов.
Состав латунных анодов, %: 75±2Cu, 25±2Zn; никель, мышьяк, олово, свинец, сурьма могут присутствовать в количестве, не превышающем 0,005%; железо ≤0,01%.
Было установлено, что для ускорения процесса латунирования (повышения выходов по току и допустимых плотностей тока) в электролите необходимо поддерживать высокие концентрации цианида натрия и меди; кроме того, следует вводить цинк в виде окиси и значительное количество едкого натра для повышения электропроводности и уменьшения активности ионов цинка.
Ниже приводятся состав такого электролита, г/л, и его режим:
* Под избытком NaCN следует понимать тот, который не входит в состав медноцианистого комплекса. Предполагается, что в данном электролите цинк находится в виде цинката.
Содержание меди в катодном осадке колеблется в пределах 75—83% (остальное цинк); он имеет удовлетворительный внешний вид. Аноды должны быть высокой чистоты и содержать примерно 75% Cu и 25% Zn. Хотя и в этом электролите выход по току несколько понижается по мере повышения плотности тока и увеличения содержания свободного цианида, однако абсолютные значения выходов по току и допустимые плотности тока несравненно выше, чем в обычно применяемых электролитах (рис. 91).
Рис. 91. Влияние плотности тока на выход по току в ванне скоростного латунирования при температурах 93 , 82, 74 и 66° С
Латунирование — старейший процесс, практически применяющийся более 100 лет. Для его осуществления предложено много составов и режимов. Мы приведем важнейшие из них, заслуживающие особого внимания (табл. 38).
- Электролитическое осаждение сплава медь — олово
Способы и средства чистки латуни
Для того чтобы придать первоначальный вид изделию, необходимо знать, как и чем почистить латунь в домашних условиях. Выбирая покупное средство для очистки, обязательно обращайте внимание на состав и кислоты, содержащиеся в нем. Любая из кислот взаимодействует с металлами по-разному, поэтому вероятность погубить защитный слой вместе с окислением довольно велика.
Что не рекомендуется использовать
Во избежание порчи и разрушения защитного покрытия необходимо знать о средствах, которые не рекомендуется использовать при очистке латуни. Поэтому для начала перечислим вещества, опасные для латуни:
Очень осторожными необходимо быть и с химическими магазинными средствами. Предварительная очистка, конечно, нужна. Но прежде чем начинать процесс, требуется обязательно ознакомиться с компонентами средства. Сильнодействующая химия способна не только разъесть и уничтожить верхний слой, но и изменить его структуру. Наблюдайте за латунью и не оставляйте ее надолго в химическом средстве, если решились на очистку с помощью химии.
Латунирование (покрытие латунью или под латунь)
оказывает самый полный спектр услуг по латунарованию (покрытию латунью) и покрытию под латунь в г. Санкт-Петербурге. Мы можем нанести как техническое, так и декоративное латунирование на любые изделия. Наша производственно-технологическая база позволяет наносить 20 базовых оттенков латуни. Также, в зависимости от запросов заказчика, мы наносим покрытие латунью с подбором оттенка латуни под образец заказчика.
Латунирование осуществляется одним из трех методов, в зависимости от технического задания, материала изделия и задачи, поставленной заказчиком:
Помимо латунирования оказывает услиги по художественной обработке латунного покрытия:
Так как покрытие латунью (как и сама латунь) окисляется от содержащейся в воздухе влаги (даже в помещениях с нормальной влажностью), после нанесения покрытия латунью на изделие наносится слой защитного лака.
Мы наносим три варианта лака на выбор:
- 100% глянцевый защитный лак (глянец)
- 35% глянцевый защитный лак (полуматовый)
- Матовый защитный лак
Защитный лак обладает отличной адгезией к латунному покрытию. Стоимость покрытия лаком включена в стоимость латунрования изделий.
Стоимость покрытия каждого изделия определяется индивидуально. Для определения стоимости покрытия свяжитесь с менеджером по телефону или заполните форму обратной связи на сайте.
Напоминаем вам, что для всех клиентов действует БЕСПЛАТНЫЙ ЗАБОР И ДОСТАВКА ИЗДЕЛИЙ в пределах КАД вне зависимости от объема заказа.
Ниже приведены фото примеров работ по нанесению латуни.
Посмотреть все услуги
Приготовление электролита латунирования в домашних условиях
Часто бывают ситуации, когда изделие из того или иного материала по художественному замыслу должно выглядеть как латунное с характерным зеленовато-желтым или золотистым цветом. В этом случае на помощь приходит гальваническое покрытие латунью.
Латунь в самом общем смысле — сплав меди с цинком с содержанием последнего до 40 %. Для получения латунных осадков я применяю пирофосфатный электролит следующего состава:
- сульфат меди 6 г/л;
- сульфат цинка 6 г/л;
- пирофосфат натрия 60 г/л;
- щавелевая кислота 10 г/л;
- борная кислота 5 г/л.
Почему для латунирования применяется именно пирофосфатный электролит? Потому что из простых сернокислых электролитов латунь не осаждается ввиду различных стандартных потенциалов меди и цинка, поэтому, чтобы и медь и цинк осаждались на один и тот же катод, их потенциалы должны быть примерно равны. Это достигается в пирофосфатном электролите, где ионы меди и цинка связаны в комплексы с молекулами комплексообразователя. В нашем случае комплексообразователем является пирофосфат натрия. Если в сернокислом электролите металл перемещается от анода к катоду в виде ионов, то в пирофосфатном электролите металлы перемещаются в связанном комплексе с молекулой комплексообразователя.
Ниже я расскажу, как правильно приготовить пирофосфатный электролит латунирования. В моем примере получится 0,5 л готового электролита.
Взвешиваем на весах 3 г сульфата меди, 3 г сульфата цинка, 30 г пирофосфата натрия, 5 г щавелевой кислоты и 2 г борной кислоты:
Добавляем немного раствора пирофосфата натрия в раствор сульфата меди — должен образовываться густой осадок. Удобно пользоваться обычным шприцом на 10 мл. Пирофосфат нужно добавлять в таком количестве, чтобы весь сульфат меди прореагировал и полученная жидкость представляла собой массу из бледно-голубого осадка. Я добавил приблизительно 25 мл раствора пирофосфата натрия. Если продолжить добавление пирофосфата, то осадок начнет растворяться и раствор снова станет голубого цвета — это растворяется пирофосфат меди в пирофосфате натрия. Этого делать не нужно, так как осадок еще предстоит промыть водой. На фото видно как пирофосфат натрия реагирует с сульфатом меди — на дне емкости образуется осадок.
В раствор сульфата цинка добавляем примерно такое же количество раствора пирофосфата натрия. Сразу же начинает выпадать густой белый осадок.
После добавления по 25 мл пирофосфата натрия в растворы сульфатов меди и цинка получаем такую картину:
Оставляем оба раствора на несколько часов. За это время растворы должны отстояться.
Осадки необходимо промыть чистой водой — это делается для того, чтобы удалить сульфат-ионы из растворов, так как в пирофосфатном электролите они не нужны. После отстаивания осторожно при помощи шприца отделяем прозрачную часть растворов и оставляем только осадки.
Добавляем немного воды и опять ждем.
В этот раз осадок отделяется гораздо быстрее — всего за двадцать минут:
Отделяем прозрачную часть растворов и опять добавляем чистой воды к осадкам. Повторяем эту процедуру с промывкой два-три раза, после чего смешиваем отмытые осадки с раствором пирофосфата натрия, добавляем щавелевую и борную кислоты и доливаем воды до 0,5 л. Готовый электролит должен светло-синим и прозрачным как на фото:
В следующей статье мы попробуем покрыть образец латунью при помощи этого электролита.
Всем удачи и успехов!
Латунирование
Латунирование
Латунные покрытия применяются в основном для защитно-декоративной отделки различных изделий. Кроме того, их используют для покрытия стальных деталей, подлежащих обклейке резиной, поскольку они улучшают сцепление резины со сталью.
Основными составляющими латуни являются медь и цинк в разных сочетаниях, но в принципе преобладает медь. Типичная латунь, содержащая — 60 % Си, имеет золотистый цвет. Полированные латунные покрытия украшают изделия, благодаря чему используются для отделки галантереи, окантовки мебели, конторского оборудования и т. д.
Латунирование производят в электролитах, содержащих комплексные соли меди и цинка и позволяющих совместное осаждение этих двух металлов. Общепринятый состав электролитически осаждаемой латуни содержит около 60-70% меди и 30-40% цинка. Осаждение латуни ведут в основном из цианистых электролитов. Составы цианистых электролитов латунирования приведены в табл. Электролит 1 предназначен для латунирования тонким слоем. В него добавляется также одна из следующих блескообразующих присадок: 0,001-0,01 г/л трехокиси мышьяка, растворенного в едком натре; 0,01 г/л Декстрина, растворенного в горячей воде; 0,3-0,5 г/л фенола, растворенного в едком натре; 0,5-1,0 г/л кре- золсульсроната натрия.
Таблица. Составы цианистых электролитов латунирования:

Рабочая температура 22-28 °С, плотность тока 0,1-0,8 А/дм2, рН = 10-11,5. Отношение площадей анода и катода от 2 :1 до 3 : 2. Электролит 2 предназначен для быстрого латунирования. Рабочая температура 45-55 °С, плотность тока 0,5-6 А/дмг, рН = 11,5-12,5. Отношение площадей анода и катода 3:1. С помощью электролита 3 производится белое латунирование. Осажденный слой белой латуни содержит 20-30 % меди и 80-70 % цинка. Он имеет неплохие механические свойства (большую твердость и стойкость к истиранию). Рабочая температура электролита 20-30 °С, плотность тока 1-3 А/дм2. Для осаждения специальных томпаковых покрытий (сплавов меди с цинком, содержащих более 80 % меди), которые применяются главным образом как декоративное покрытие предметов, применяется электролит 4. Электролит используется при комнатной температуре. Плотность тока 0,1-0,2 А/дм2. Отношение площадей анода (из томпака) и катода 2:1. Электролит 5 универсален. Для нанесения тонких слоев, например, перед никелированием, можно применять разбавленную ванну с сохранением указанных пропорций. Температура ванны 25-35 °С, плотность тока 0,3-0,5 А/дм3, аноды из латуни. К этому электролиту можно добавлять блескообразователи, такие же, как к электролиту 1.
Широкую популярность в последнее время получило латунирование на основе блестящего никеля. Тонкий слой латуни сохраняет блеск никеля, благодаря чему достигается эффект блестящей латуни. Электролит 6 применяют для декоративного латунирования с подслоем блестящего никеля при 20-27 °С, плотности тока 2 А/дм2. Аноды латунные. Изделия с нанесенным 10-мкм слоем никеля латунируют в электролите б около 1 мин, причем латунное покрытие должно получиться с блеском никеля. После латунирования необходима очень тщательная промывка в горячей и холодной воде попеременно несколько раз, а затем их пассивируют 10 с в растворе, содержащем хромовый ангидрид (3 г/л), концентрированную азотную кислоту (1 см3/л) и оксид цинка (0,8 г/л) при комнатной температуре. После промывки изделия нужно сразу же сушить сжатым воздухом или в сушилке. Можно также воспользоваться старым, но хорошим методом сушки в опилках. С целью сохранения декоративного вида латунных покрытий их лакируют методом погружения или напыления прозрачных, бесцветных лаков. Для составления цианидных электролитов запасную промытую ванну заполняют на ~ 2/3 водой и после ее нагрева до 60 °С растворяют в ней цианид натрия. Добавив затем цианиды меди и цинка, раствор перемешивают до их полного растворения. После остывания раствора в него добавляют остальные компоненты и оставляют ванну на сутки, а затем отфильтровывают раствор в рабочую ванну и дополняют до нормы. Емкости с раствором для цианидного латунирования должны быть облицованы твердой резиной.
В связи с тем, что ванна содержит два металлических компонента, ее эксплуатация связана с определенными трудностями. Сильное газовыделение на поверхности изделий, находящихся в ванне, свидетельствует об избыточной концентрации свободного цианида. В крайних случаях может произойти полная задержка осаждения покрытия. В этом случае может помочь добавка, малыми порциями, цианидов обоих металлов.
Если содержание свободного цианида очень мало, то аноды покрываются бело-зеленым шламом. В этом случае следует добавить цианид натрия (3 г/л), а если не поможет, повторить добавку. Когда содержание свободного цианида соответствует рецептуре, а скорость осаждения покрытия недостаточна, это свидетельствует об очень малом содержании металла в ванне. Тогда отливают часть раствора ванны в малую ванну и добавляют цианиды • натрия (6 г/л), меди (4 г/л) и цинка (2 г/л). После полного растворения этих добавок раствор отфильтровывают в рабочую ванну.
Наибольшие трудности возникают при получении покрытия требуемого цвета. Отметим, что красный цвет покрытия может быть вызван очень малой плотностью тока, очень высокой температурой ванны и избыточной концентрацией меди в ванне; светло-желтый цвет покрытия может быть вызван низкой температурой ванны, очень высокой плотностью тока и большой концентрацией цинка в ванне. В ванне, эксплуатируемой многие месяцы, постепенно накапливаются карбонаты, кристаллы которых оседают на анодах и стенках ванны. Избыток карбонатов удаляют методом охлаждения ванны. Если аноды покрываются белой коркой, то необ-ходи-мо в ванну добавить хлорид аммония (1,5-2,0 г/л). Шероховатость покрытий свидетельствует о загрязнении ванны механическими частицами. В этом случае необходима фильтрация ванны.
Продолжаем знакомство с этой невероятной технологией, начатое здесь.

Я раздобыл большой кусок латуни (которая, как известно, представляет собой сплав Cu и Zn) толщиной около 1.5 миллиметров и сначала не был уверен, сможет ли он быть мишенью из-за своей небольшой толщины. Не промнется ли он внутрь банки, закоротив установку и поразив меня градом осколков и искр? К счастью этого не произошло.

Кусок латуни был при этом довольно кривым сам по себе. Это привело к тому, что вся установка приподнялась над медной опорой и несколько отдалилась от магнитов. Кольцо при это стало расплывчатее и тусклее. Пришлось подложить под магниты пластину из конструктора, чтобы приподнять их. В результате они уперлись в медь, что было ошибкой - к концу статьи они перегреются и ослабеют.

Несмотря на довольно большую мощность и время работы установки, на слюду почти ничего не нанеслось. Да и на мишени след ионы оставили не очень серьезный. Вряд ли дело тут опять в нитридах? Но тогда в чем?

Почему-то мне пришло в голову вырезать из латуни небольшой кусочек (по размеру плазменного кольца) и поместить его прямо на поверхность медной мишени. Результат оказался для меня совершенно неожиданным. По краям кружок как раз касался плазменного кольца. Так вот в этих местах он быстро разогрелся до оранжевого каления и стеклянная подложка стремительно (как минимум на порядок быстрее, чем при напылении меди) стала темнеть, покрываясь блестящим (и, как оказалось, хорошо проводящим) металлическим слоем!

Итак, технология напыления латуни была освоена. Но почему в виде кольца она напылялась так хорошо? Нужны были дальнейшие эксперименты.
Я трижды попробовал напылить латунь на слюдяные пленки, и получил хорошие покрытия. Но они своим видом всё больше напоминали.. цинк!

А со стороны слюды обнаружилось видно странное явление - какие-то. желтки.

По-видимому, в начале, когда латунный кусок холоден, напыления нет. Ионная бомбардировка начинает его разогревать (ведь он касается медной основы лишь в нескольких точках, а значит, имеет очень плохой теплоотвод). В небольшом интервале температур распыляется латунь в виде красивого ярко-желтого сплава, но при превышение некой критической температуры происходит плавление или еще какой-то подобный переход, и латунь начинает разделяться - атомы цинка цинк уходят в вакуум, а меди - остаются на месте.
На месте ли? Да, на своем месте. Посмотрите, во что превратилась латунь на поверхности распыляемого кусочка. Да это же медь!

Так, незаметно для себя мы вступили в область другой технологии, известной под названием ионно-плазменного распыления. Недостаток ее нам уже известен: материалы сложного состава разделяются на фракции. Википедия объясняет это разницей в давлениях паров компонентов. Действительно, в литературе приводятся графики скоростей испарения металлов в вакууме при разных температурах, из которых следует, что цинк испаряется на много порядков быстрее меди.
Получается, если нам важно сохранить состав сплава, то технология магнетронного распыления - лучше. Нагрева металла при этом надо всячески избегать. Вот почему мишени для магнетронного распыления в профессиональных установках предусматривают водяное охлаждение. И подложки тоже порой охлаждают водой.
Но есть у нового метода и достоинство - и еще какое - невероятно высокая скорость распыления. Причем оно как бы лавинообразно самоускоряется. Чуть только войдет в этот режим и уже через секунды нарастает сплошное покрытие. И значительно возрастает ток - потому что начинает дымиться МОТ. Что же происходит при этом? Какова природа этого загадочного явления?
Я предположил, что дело обстоит примерно так. При разогреве близких к плазменному кольцу участков мишени из них начинается испарение металла, в нашем случае - цинка. Однако, попав в кольцо, пары цинка претерпевают ионизацию и сами становятся положительными ионами. Как следствие - ускоряются и бомбардируют поверхность мишени, вызывая ее дополнительный разогрев и выбивая при этом дополнительные атомы.

Но что произойдет, если атом цинка попадет не в латунную маленькую мишень, а в большую, медную и холодную? Он, наверное, увязнет в ней. Обратите внимание на фотографии выше (где латунь потеряла цинк) - как много осело цинка на медную большую мишень. Причем осело так хорошо, что не особенно удалось соскрести даже наждачной бумагой.

А латунная (или уже бывшая латунная?) маленькая мишень после ряда распылений приобрела вот такой вид (справа - перевернутая). Собственно, она расплавилась в каплю.

Что ж, раз мы смогли извлечь цинк из латуни, почему бы не напылить цинк в чистом виде? Насыплем гранулы на место, где обычно присутствует плазменное кольцо. И вокруг насыплем на всякий случай - не жалко.

Плазменное кольцо пронизало промежутки между гранулами сверху и снизу, однако. не проявило к ним особенного интереса. Хотя мощность была не меньше той, которая расплавила латунь (на целых 500 К более тугоплавкую!).

В результате гранулы едва спеклись, на них напылилось немножко меди. На подложке осело немножко неведомо чего, а мишень превратилась в загадочный инопланетный ландшафт.

Тут я вроде бы начал смекать, в чем дело. Ведь закругленные поверхности имеют плохие эмиссионные свойства (и хороший теплоотвод). Помните, в школьном курсе электростатики проходили что заряд скапливается на остриях и стекает с них? Должно быть, для эффективного распыления поверхности мишени, она должна иметь острые края, которые разогреваются (а потом уже всё тело мишени). Тогда я взял и зубилом отрубил кусок цинковой пластины толщиной около 2 мм по размеру латунной капли. Края получились весьма острыми.

Эта идея оказалась плодотворной. Цинк распылился, да ещё как! И держатель и банка оказались быстро покрыты добротным слоем цинка.

Ну а медная мишень вообще оцинковалась на славу. Даже то что было под цинком. Ну а почему бы и нет? Там ведь происходит почти всё то же самое, что и сверху, только в перевернутом виде.

Покрытие цинка на подложке получилось великолепным. И проводящим электричество не намного хуже медного.


Теперь и на бумагу мы можем наносить не только медь, но, значит, и цинк. А это значит, что мы уже практически можем создавать ну очень маленькие, а также гибкие и плоские батарейки. На этот раз я взял не офисную, а глянцевую бумагу (от рекламной листовки), что благоприятно сказалось на внешнем виде покрытий.

Цинк нанёсся каким-то матовым образом. Только в левом нижнем углу получился блестящий участок. Видимо, он находился в каком-то правильно удаленном месте камеры. А остальная поверхность, наверное, как бы забрызгалась микро (нано?) частицами от чрезмерно активного распыления. Несмотря на матовый вид, под микроскопом покрытие выглядит весьма ровным и однородным.

Более того - если потереть цинковое покрытие тряпочкой, матовость счищается, а блестящее покрытие остается.

Раз острые края благоприятны для ионно-плазменного напыления, то с фольгой оно должно происходить просто замечательно. Почему нет? У меня как раз давно лежит без дела некоторое количество никелевой фольги. Скомкал я из нее нечто по размеру латунной капли (ставшей неофициальным эталоном размера маленьких мишеней). В этом опыте я поднял подложку несколько повыше, чтобы не получилось матового покрытия как с цинком. Может быть, крупные микрокапельки до подложки не долетят.

Ярко - оранжевые края маленькой мишени и темнеющая подложка - верный признак, что что-нибудь интересное мы да получим!

И вот оно - прекрасное ровное зеркальное покрытие с характерным для никеля благородным блеском! Это самый красивый из металлов, которые я напылял. Никаких матовостей, окислений и прочих дефектов ни с какой стороны.

На просвет никель значительно отличается от меди. Ну так ведь, на то он и никель.

А ещё он обладает примечательными магнитным свойствами. Такими, что полупрозрачная пленочка никеля может в поле не самого еще мощного магнита поднять вес не только свой, но и всей слюдяной подложки.
Напыление оловянно-свинцового припоя
Вдохновившись цинком и никелем я решил попробовать напылить другой доступный мне материал - оловянно-свинцовый припой. Для этого я обвел маркером на омедненном текстолите внутреннюю окружность силиконовой прокладки и напаял туда изрядное количество припоя.

Эта гибридная мишень находилась в плазме до тех пока я не почувствовал то, что рано или поздно и должен был почувствовать - а именно, запах перегретого текстолита. Тогда я прекратил эксперимент и стал смотреть, что получилось.
Во-первых, медь в рабочей зоне очевидно нагрелась, что вызвало какие-то испарения из текстолита, которые вспучили медную фольгу пузырем в направлении вакуума. Это, в принципе, можно было и предсказать.

Во-вторых, сам припой явно претерпел переплавку. Ну другого мы от него и не ждали. Посередине застывшей капли остался след от какого-то всплеска.

В-третьих, на подложке осело нечто невразумительное, тёмное и непроводящее.

В-четвертых, на краю этой подложки видны микроскопические шарики припоя. Что всё это значит?

Вот как выглядят эти шарики под микроскопом.

Позже я прочел, что такие явления типичны при дуговом распылении легкоплавких сплавов. Для борьбы с этим применяют специальной конструкции фильтры, не допускающие крупные частицы материала до подложки.
Так, что ещё у нас есть? Ага, свинец.

Результат такой же, как и с припоем - непроводящее бурое покрытие на подложке, подплавленные гранулы маленькой мишени. Ну и немного меди напылилось на свинец.

Ещё у меня был висмут. Так как поверхность медной мишени уже содержала значительный участок таблицы Менделеева, я взял для чистоты эксперимента алюминиевую мишень - алюминий-то уж точно напыляться на нашу подложку не станет.

Продолговатые гранулы висмута выглядят как дрова в костре. А вокруг бушует плазма!

Гранулы, конечно, расплавились, а на подложке снова образовалось бурое непроводящее покрытие, о составе которого можно только догадываться.

Впрочем, между висмутом, свинцом и оловом много общего. Может, потому они и ведут себя одинаково. Может быть, эти темные покрытия состоят из изолированных микрошариков, за счет поверхностного натяжения склонных скорее образовать видимые невооруженным глазом шары, чем пребывать в тонкопленочном состоянии. А легкоплавкость не дает им пребывать в твердом состоянии, которое бы защитило их от этого. Может и так. По крайней мере, действительно, прослеживается тенденция - чем более тугоплавки металл, тем выше качество его напыленной поверхности. Наверное, я тоже приду со временем к водоохлаждаемым подложкам.
Найдя таблицу поверхностного натяжения металлов, я увидел, что у меди и никеля оно даже выше, чем у "капризных" легкоплавких металлов. Значит, дело всё-таки, скорее всего, в легкоплавкости и отсутствии охлаждения.
Ионно-плазменное распыление алюминия
Тогда я решил вернуться к проблеме нанесения пленок алюминия с учетом новых знаний по части ионно-плазменного распыления. Я отрезал кусочек тонкого алюминиевого листа наподобие цинкового и загнул вверх четыре его острых уголка "для пущей эмиссии".

Однако упрямый металл расплавился, но не распылился.

Но и я не собирался сдаваться. Я сложил тонкую алюминиевую фольгу в пачку и сделал ножницами надрезы со многих сторон, придав ей форму снежинки.

Я положил это на кусок алюминиевого листа и выкрутил ручку ЛАТРа на такое напряжение, при котором еще можно было надеяться, что МОТ вот-вот не вспыхнет. Но тщетно. Алюминий немного подплавился и забронировался в своей оксидно-нитридной пленке. Никакого напыления и на этот раз не произошло.

Оставив алюминий в покое до тех пор пока не удастся добыть аргон, я взялся за сталь. Подобрал соответствующего размера шайбу и слегка обработал ее шкуркой.

Стальная шайба, в отличие от остальных ранее напыляемых материалов, существенно изменила конфигурацию магнитного поля в установке. Кольцо окружило шайбу по внешнему контуру. А при повышении напряжения появилось второе кольцо на контуре внутреннем.

В результате, поверхность шайбы приобрела характерную ободранность, а на подложке появилось интересное радужное покрытие с синеватым оттенком. Сталь это или остатки антикоррозионного покрытия с шайбы - сказать трудно. По крайней мере, оно не притягивается магнитом.
Как известно, стальные и другие металлические изделия покрывают золотом, как с декоративной, так и с технологической целью – золотое покрытие весьма прочно и обладает очень высокой коррозионной стойкостью. В домашних условиях позолоту проще всего осуществлять контактным и горячим методами, поскольку они не требуют особого специфического оборудования и достаточно безопасны.
Контактный способ – электролитическое золочение без внешнего источника тока – позволяет получить равномер-ные и очень плотные покрытия, достаточно плотно держащиеся на поверхности металла. Так как в данном случае процесс “электролиза” осуществляется в результате разности потенциалов детали и электролита, то качественно позолотить удается лишь латунные детали или детали из других металлов, предварительно покрытых тонким слоем латуни.
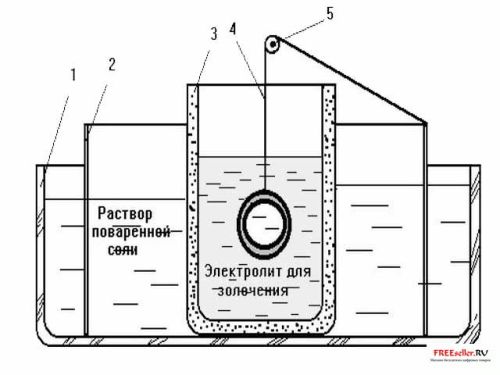
Рис.1. Устройство ванны для электролитического нанесения слоя позолоты контактным способом:
1 – стеклянный сосуд, 2 – кольцевой электрод из цинка, 3 – стакан из пористой керамики, 4 – медная проволока – подвеска, 5 – опоры подвески – изолятор.
Перед нанесением слоя латуни на поверхность изделия из стали, изделие шлифуют, полируют, после чего его поверхность обезжиривают и протравливают, то есть подвергают химической обработке. Первые три операции не требуют особых пояснений. Травление же стальных изделий проводят в щелочном растворе, содержащем 20 – 30 г/л гидрата окиси калия (или гидрата окиси натрия) и нагретом до 75 – 85 гр. С. Время травления изделия в горячем растворе составляет при-мерно полчаса, при комнатной температуре изделие держат в щелочи не менее 1 ч. После тщательной промывки в проточной воде деталь погружают на 1 минуту в 0,5%-ный раствор соляной кислоты, чтобы удалить с поверхности металла следы окислов железа. Из раствора соляной кислоты (опять же после тщательной промывки) деталь помещают в ванну для электролитического латунирования, причем, чем скорее влажная деталь очутится в ванне, тем лучше будет покрытие.
Состав электролита (гальванической ванны) для латунирования приведен ниже (в г/л):
– ционид меди 30 – 35;
– ционид цинка 8 – 12;
– ционид натрия 20 – 25;
– карбонат натрия 6 – 8;
– бикарбонат натрия 8 – 12;
– гидроокись аммония 3 – 5.
Компоненты электролита растворяют в дистиллированной воде. Латунирование ведут при температуре раствора 25 – 35 градусов С и плотности тока 0,3 – 0,5 А/кв.дм. В качестве источника тока подойдут гальванические элементы типа 373. Понадобится также реостат для регулирования тока.
Анодом служит пластина из латуни марки М70. Для получения более однородного по толщине покрытия деталь в процессе электролиза необходимо поворачивать. Так как слой латуни служит подслоем для последующего слоя золота, требуется нарастить слой латуни толщиной не менее 1 мкм, для чего потребуется примерно 15 – 20 минут. Учтите, что поверхностный слой свежеосажденной латуни получается весьма непрочным, и касаться его нельзя.
В тех случаях, когда слой латуни выполняет роль декоративного покрытия, его рекомендуется обработать раствором какого-либо пассиватора для повышения прочности и атмосферостойкости. В нашем же случае латунный слой – промежуточный “продукт”, так что его незапассированная поверхность только способствует взаимной диффузии латуни и золота, приводя к упрочнению соединения слоев. Поэтому после тщательной промывки в горячей воде отлатунированную деталь сразу переносят в ванну для золочения. Некоторые составы ванн для контактного золочения приведены в таблице.
Компоненты, г/л электролит I электролит II электролит III
Хлорное золото 0,4 3,5 1,5
Бикарбонат калия 50 – 100
Хлористый натрий – 2 –
Сульфид натрия (кристаллический) – 30 –
Железосинесодержащий калий – 3 –
Температура раствора в процессе золочения – 70-80 гр., время для получения слоя золота толщиной около 0,1 мкм составляет: для ванны I – 3-5 минут; для ванны II и III – 5-10 минут. Значительно увеличивать время пребывания изделия в ванне не имеет смысла – при достижении указанной выше толщины слоя золота процесс практически прекращается и утолщения слоя позолоты получить не удается.
Контактное золочение осуществляется в электролитической установке, разрез которой показан на рис. Как видно из рисунка, в стеклянной емкости размещен цилиндрический электрод (анод) из цинка, погруженный во вспомогательный электролит – раствор хлористого натрия (концентрация раствора 30 г/л). Внутри стакана из пористой керамики на медной проволоке подвешивают деталь, которую требуется позолотить. Проволока удерживается в центре стакана с помощью опоры (например, трубки) из изолирующего материала, которую крепят на стакане. Таким образом, проволока не контачит со стаканом, но электрически соединена с цинковым анодом.
В данной установке стакан из пористой керамики играет роль полупроницаемой диафрагмы, разделяющей растворы двух электролитов и препятствующих их смешению, но не создаю-щей преград для процесса электронно-ионной проводимости. Если такого стакана у Вас нет, в качестве полупроницаемой перегородки подойдут брезент, фильтрованная и даже непроклеенная бумага. Только учтите, что при замене материала перегородки придется экспериментально определить время электролиза и откорректировать состав ванны. После золочения деталь тщательно промывают и высушивают на воздухе. Несмотря на небольшую толщину слоя золота, покрытие получается достаточно плотным, прочным и блестящим.
Характерной особенностью данного способа золочения является высокая прочность сцепления слоя позолоты с основным металлом, но этот показатель, как уже говорилось ранее, в большой степени зависит от качества предварительной подготовки поверхности металла под латунирование.
В тех же случаях, когда не требуется высокая прочность сцепления покрытия, и слой позолоты предназначен для чисто декоративных целей, лучше воспользоваться так называемым горячим способом золочения – методом менее трудоемким и более безопасным.
Для горячего золочения готовят раствор следующего состава (в г):
– кислота азотная (плотность 1,36 г/куб.см) 20;
– кислота соляная (плотность 1,18 г/куб.см) 20;
– золото 1;
– сурьма хлористая 1;
– олово 1;
– борная кислота (насыщенный раствор) 20.
Раствор готовят следующим образом. В стеклянной посуде смешивают азотную и соляную кислоту и в получившей-ся “царской водке” растворяют золото, после чего добавляют хлористую сурьму и олово. Далее посуду ставят на водяную баню и после полного растворения олова в раствор добавляют борную кислоту. Работать с раствором надо с соблюдением всех необходимых предосторожностей – жидкость весьма агрессивна, так что попадание ее кожные покровы опасно, а пары жидкости – ядовиты (содержат окислы азота и хлор).
Изделие, предназначенное для золочения, предварительно шлифуют, полируют, обезжиривают, а также протравливают, прокипятив в щелочи. После чего “золотой” раствор наносят на промытую подготовленную поверхность изделия мягкой кистью. Когда раствор подсохнет, изделие прогревают в пламени спиртовки или на костре из древесного угля. В результате образуется позолота, не требующая дополнительной обработки, но сцепление слоя позолоты с основным ме-таллом не обладает высокой прочностью.
Покрытие металла латунью – декоративная обработка поверхности, имитирующая натуральную состаренную латунь. Мы наносим такое покрытие на изделия из любых металлов. Чаще всего это сталь и алюминий. Латунирование металла производится, как правило, для того, чтобы придать изделию вид, идентичный другим предметам интерьера. Это наиболее простой и удобный способ.
Декорирование производится в покрасочном цехе нашей мастерской. Покраска металла под латунь может быть прозрачной и непрозрачной. В первом случае производится тонирование, имитирующее патину. Тонировочный лак наносится на тонкий слой усилителя адгезии. Такая имитация металла под латунь выглядит весьма реалистично, так как сквозь тонировку просматривается структура натурального металла. Это вариант особенно актуален, если нужно получить эффект направленной шлифовки патины. Во втором случае металлическая поверхность полностью покрывается грунтовкой и уже на грунтовку наносится слой металлизированной краски, а далее осуществляется декоративная обработка поверхности под шлифованную патину или с эффектом затертости.
Сегодня очень часто можно встретить в сети сайты, рассказывающие о хромировании в домашних условиях. Хочу высказать свое скромное мнение на этот счет не только как специалиста, создавшего гальваническое предприятие, но и как эколога, в первую очередь.
Начнем с того, что многим гальваника кажется делом легким и дешевым. Бытует мнение, мол, макнул бампер в раствор – вот тебе и идеально блестящее, прочное покрытие. А так как не у многих найдется лишняя сотня квадратных метров бесхозной площади, то первым в очереди на заселение становится гараж. Оттого домашнюю гальванику называют еще "гаражной".
Сейчас не проблема найти мало-мальски профессиональную литературу по электрохимическим покрытиям в интернете. Однако мало знать технологию. Тем более, многое, что написано в книгах зачастую вообще не работает. Какие же проблемы сразу должны насторожить Вас?
1. Кроме непосредственно покрытия (возьмем пример более известного в широких массах хромирования по стали) требуется большое число подготовительных операций. Качественное декоративное покрытие невозможно получить без полировки поверхности. Легко ли отполировать до блеска автомобильный диск? Даже для обработки того же бампера требуется умение. После мехобработки потребуется обезжиривание, затем травление (после всех операций придется делать минимум 3 промывных ванны), которое не всегда проводится в серной кислоте. Положим, что аккумуляторную кислоту достать можно. С соляной и азотной кислотой дело обстоит сложнее, как и со всеми последующими реактивами по той простой причине, что легально реактивы могут продаваться ТОЛЬКО ЮРИДИЧЕСКИМ ЛИЦАМ или на худой конец ИП. И уж точно никто в здравом уме не продаст левому человеку хромовый ангидрид, являющийся основным компонентом ванны хромирования. А серная кислота в этой ванне потребуется уже не аккумуляторная, техническая, а чистая, определенной квалификации. Даже приготовление электролита – сложная задача, которая включает в себя проработку током в нужном режиме
2. Электролит хромирования требует определенной температуры, соотношения ангидрид/кислота и плотности тока. Для такой ванны необходим высоковольтный, по сравнению с обычной гальваникой, выпрямитель тока большой мощности. Посчитайте площадь поверхности покрываемого диска (всю, так как нормально заизолировать ненужные части не удастся – выделяющийся на катоде водород сорвет любой лак или пленку) – плотность тока для хромирования может достигать 30 А/дм 2 . Теперь умножьте площадь в дм 2 на эту величину. Это потребный для покрытия ток. Если умножить этот ток на напряжение для хромирования, то Вы получите мощность выпрямителя и она окажется немаленькой. Скорее всего, выпрямитель будет трехфазным, а такая сеть есть не во всех гаражах.
3. Теперь – ванны. На все операции может потребоваться до 12 ванн, если используется 1 ванна хромирования. В электролизной ванне придется ставить свинцовые аноды и медные штанги большого сечения. Эти вещи тоже нелегко достать, так как нужно их относительно немного, а продавать их поштучно почему-то не хотят. В основном – мелкий опт. В каждой ванне нужна будет дистиллированная вода. Если принять примерный объем одно ванны 250 л, то, умножив эту цифру на 12 ванн, получим 3 кубометра дистиллированной воды. Это 3000 л. Согласитесь, покупать 3000 бутылок дистиллята в автомагазине – не лучшая идея. Дистиллятор же потребует много денег и обязательно наличия холодного водоснабжения, которое есть не во всех гаражах.
4. Хромовый электролит не предусматривает использования расходуемых анодов. Это означает, что концентрации компонентов в нем постоянно меняются. Добавим сюда низкий выход по току и получим, что корректировка электролита потребует целой аналитической лаборатории. А там – приборы и специфические реактивы. И навыки. Без опытного технолога будет очень непросто обойтись.
5. Отдельно поговорим про экологию. Помним, что хромовый ангидрид – сильнейший яд и канцероген. Промывную воду после хромирования придется менять часто. Куда девать весь этот объем стоков? Слив на улицу – последнее, что должно придти в голову, за это можно загреметь по уголовному делу и сильно, не говоря про штрафы. Вывозить за город – не навывозишься. А если электролит выйдет из строя? За выброс такого количества канцерогенов в окружающую среду можно смело приписывать статью "терроризм". И это на самом деле так – это тяжелейшее преступление против тех, кому в питьевую воду потом попадет этот источник рака.
Из всего этого заключу, что организация гальваники в домашних условиях – дело не только сложное, рискованное, малорентабельное, но и НЕЛЕГАЛЬНОЕ и УГОЛОВНО НАКАЗУЕМОЕ. Затрат придется внести куда больше, чем кажется, проблем – не оберешься. И если даже что-то получится, конкурировать с профессиональной гальваникой "гаражная" вряд ли сможет. Стоит ли браться? Решайте сами. В конце концов, если Вы решили зарабатывать, то можно найти много более выгодных способов вложения денег, а если вам нужен конкретный продукт – обратитесь к профессионалам. Только имейте в виду, что кроме гальванического хромирования есть еще другие виды: мета-хром, напыление, трибо-гальваника. Все они НЕ ДАЮТ КАЧЕСТВЕННО СЦЕПЛЕННОГО покрытия и ваш блестящий повод для гордости на копытах железного коня очень скоро может стать поводом для покупки колпаков, чтобы закрыть обсыпавшееся и прокорродировавшее непотребство. И это на стальном диске. А если диск алюминиевый или титановый? Такие материалы даже гальванически ЧРЕЗВЫЧАЙНО сложны для покрытия и требуют куда более сложной обработки. Из чего вытекает, что качественное хромирование будет по карману далеко не каждому.
Читайте также:

