Как сделать кривую охлаждения
Обновлено: 07.07.2024
Правило фаз (закон фаз, закон Гиббса) - соотношение термодинамики, согласно которому для любой равновесной системы сумма числа фаз f и вариантности (числа степеней свободы) с равна числу компонентов k, увеличенному на число параметров n, определяющих равновесное состояние системы:
При этом параметры состояния (температура Т, давление р, напряжённость электрического и магнитного полей и др.) должны быть одинаковыми во всех фазах. Если состояние системы может изменяться лишь под действием температуры и давления, причём размеры фаз таковы, что можно пренебречь величиной их поверхностной энергии, то правило фаз выражается формулой
Для конденсированных систем (например, сплавов металлов), где р либо постоянно, либо изменяется так незначительно, что не влияет на состояние равновесия, правило фаз принимает вид:
конденсированный железоуглеродистый сплав охлаждение
Именно в таком виде правило фаз используется для построения кривых охлаждения железоуглеродистых сплавов (Fe - Fe3C) и анализа превращений.
Формирование фаз или структур в сплавах можно изучить, рассматривая по диаграмме процессы, происходящие в них при охлаждении или нагреве.
В качестве примера проследим за формированием структур сплава с содержанием углерода 1,3 % при медленном охлаждении от 1600 °C (рисунок 1).
Сплав до температуры 1480 °C (точка 1) находится в жидком состоянии. Кристаллизация его начинается при 1480 °C с выделением из жидкого раствора кристаллов аустенита. По мере охлаждения сплава концентрация компонентов в аустените изменяется согласно линии JE от точки 1' к точке n, а в жидкости - согласно линии ВС от точки 1 к точке k, что можно записать следующим образом:

Составы и количество фаз в этой области диаграммы (точка m) можно определить по правилу отрезков (коноды).

Рисунок 1 - Схема для изучения превращений, происходящих в сплаве I с содержанием углерода 1,3 % при охлаждении
Химический состав жидкой фазы сплава I при температуре, равной температуре точки m, определяется проекцией на ось концентраций точки k, а химический состав аустенита - проекцией на ось концентраций точки n. Количество аустенита А находится по формуле

а количество жидкой фазы Ж - по формуле

где kn - длина коноды;
km, mn - отрезки, противолежащие определяемой фазе.
Кристаллизация сплава заканчивается в точке 2 (1340 °C). В интервале температур 1340…980 °C (точки 2, 3) сплав охлаждается, не претерпевая никаких изменений. При охлаждении сплава ниже 980 °C (точка 3) аустенит с концентрацией углерода 1,3 % становится пересыщенным. Избыточный углерод из зерен аустенита диффундирует к их границам и выделяется в виде цементита вторичного. Концентрация углерода в аустените при охлаждении сплава от 980 до 727 °С изменяется согласно линии ES от точки 3 к точке S:

При температуре 727 °C (точка 4) в сплаве происходит эвтектоидное превращение. Аустенит (0,8 % С) распадается на ферритно-цементитную смесь - перлит:

С понижением температуры сплава ниже 727 °C растворимость углерода в феррите уменьшается (линия PQ). В связи с этим избыточный углерод из феррита выделяется в виде цементита третичного:

Однако выделяющийся цементит третичный в структуре стали металлографически не различается, так как сливается с цементитом эвтектоида. В структуре сплава с концентрацией углерода 1,3 % при комнатной температуре наблюдаются зерна перлита, окаймленные тонкой сеткой цементита вторичного.
На рисунках 2 - 8 приведены примеры построения кривых охлаждения железоуглеродистых сплавов с различным содержанием углерода.

Рисунок 2 - Схема для изучения превращений, происходящих в сплаве I с содержанием углерода 0,005 % при охлаждении

Рисунок 3 - Схема для изучения превращений, происходящих в сплаве I с содержанием углерода 0,01 % при охлаждении

Рисунок 4 - Схема для изучения превращений, происходящих в сплаве I с содержанием углерода 0,6 % при охлаждении

Рисунок 5 - Схема для изучения превращений, происходящих в сплаве I с содержанием углерода 0,8 % при охлаждении

Рисунок 6 - Схема для изучения превращений, происходящих в сплаве I с содержанием углерода 3,0 % при охлаждении

Рисунок 7 - Схема для изучения превращений, происходящих в сплаве I с содержанием углерода 4,3 % при охлаждении

Рисунок 8 - Схема для изучения превращений, происходящих в сплаве I с содержанием углерода 5,5 % при охлаждении
Метод кривых время-температура является наиболее ценным методом термического анализа, т.к. применим к любым системам, и позволяет исследовать системы при любых температурах. В этом методе используется тот факт, что пока в охлаждаемой системе не происходит никаких превращений, температура падает практически с постоянной скоростью. Появление кристаллов в расплаве указывает на начало некоторого превращения. На основании кривых охлаждения ряда растворов различной концентрации строится диаграмма состояния изучаемой системы. Составы, отвечающие фигуративным точкам остывают с постоянной скоростью до точек в которых кривые охлаждения испытывают перелом, поэтому на кривых охлаждения наблюдается изменение наклона кривой; горизонтальный же участок появляется, когда начинается кристаллизация эвтектической смеси или чистого компонента. Диаграмма кривых охлаждения, всех возможных типов в данной системе приведена в Приложении 2.
Кривая охлаждения 1 соответствует точке В, где наблюдается температура плавления чистого вещества KF при его стопроцентном содержании в системе. При достижении этой точки на кривой охлаждения появляется горизонтальный участок, что связано с выделением кристаллов чистого вещества KF и теплоты кристаллизации; здесь приостанавливается падение температуры, пока всё вещество не затвердеет. Далее продолжается охлаждение уже твёрдого вещества KF. В точке В наблюдается нонвариантное равновесие двух фаз одинакового состава (С=1+1-2=0). Аналогичный процесс описывает кривая охлаждения 11.
Рассмотрим ход кристаллизации расплава для кривой охлаждения 2.
Пока фигуративная точка 2’ находится в гомогенной области (над линией ликвидуса), никакие фазовые превращения не происходят, в системе имеет место дивариантное равновесие (С = 1 + 2 – 1 = 2), можно менять и температуру, и соотношение компонентов без изменения числа фаз. При понижении температуры до точки а1 (точнее до температуры немного ниже точки а1) начинается выпадение первых кристаллов вещества В. На кривой охлаждения наблюдается излом. При этом расплав обогащается компонентом АВ4 (состав расплава изменяется по линии ликвидуса к точке Е). В системе по линии ликвидуса и в двухфазной области (между линиями солидуса и ликвидуса) имеет место моновариантное равновесие, то есть изменение температуры в указанном интервале не приводит к изменению числа фаз (С = 1 + 2 – 2 = 1). Как только мы достигнем температуры эвтектики (точка а2), расплав окажется насыщенным относительно компонента АВ4, и тогда оба компонента, В и АВ4, выделяются в виде механической мелкодисперсной смеси кристаллов с постоянным составом до полной кристаллизации. Этот расплав называется эвтектическим. Состав расплава не изменяется, температура тоже постоянна, и в равновесии находятся три фазы: одна жидкая и две твердые.. Следовательно, в эвтектической точке имеет место нонвариантное равновесие (С = 1 + 2 – 3 = 0). На кривой охлаждения горизонтальный участок.
Рассмотрим ход кристаллизации расплава эвтектического состава (кривая 3). Если расплав имеет эвтектический состав, то охлаждение протекает приблизительно с постоянной скоростью до тех пор, пока не будет достигнута эвтектическая температура (точка Е), затем наступает длинная эвтектическая остановка, пока весь расплав не затвердеет (горизонтальный участок на кривой охлаждения 3). Когда расплав станет твёрдым охлаждение продолжится.
Ход кристаллизации расплава для кривой охлаждения 4 аналогичен процессу кристаллизации для кривой 2 и 10.
Кривая охлаждения железа (рис. 1.16) имеет четыре горизонтальных участка, соответствующих температурам кристаллизации и аллотропических превращений.
Горизонтальный участок при температуре 1539 °С — кристаллизация, переход железа из жидкого состояния в твердую высокотемпературную разновидность ОЦК. Эту модификацию железа принято обозначать Fe§.
При 1392 °С Feg превращается в Fey (ГЦК). Эту температуру принято обозначать Л4. При дальнейшем охлаждении до температуры 911 °С происходит обратное превращение в ОЦК (точка Л3). Эту модификацию железа принято обозначать Fea.
Как показал рентгеноструктурный анализ, остановка при 768 °С (точка Л2) связана не с аллотропическим превращением, а с магнитным. При этой температуре парамагнитное железо переходит в фер-

Рис. 1.16. Кривая охлаждения железа:
А2 — точка Кюри; Л3,Л4 — точки превращения
ромагнитное. Поэтому часто модификацию железа между точками А3 и Л2 обозначают Fep.
Температуры аллотропических превращений железа, полученные при нагреве и охлаждении, не одинаковы. Например, при нагреве температура превращения Fea в Fey равна 911°, а при охлаждении — 898 °С. При очень медленном охлаждении и нагреве температуры превращений совпадают. Разницу в температурах аллотропических превращений при нагреве и охлаждении называют температурным гистерезисом. С повышением скорости нагрева или охлаждения температурный гистерезис увеличивается, что имеет большое значение при термической обработке стали.
Температуры, при которых в железе происходят аллотропические превращения, называют критическими температурами или критическими точками. Их обозначают буквой А. Чтобы отличить критические точки, полученные при нагреве, от критических точек, полученных при охлаждении (что необходимо сделать в связи с явлением температурного гистерезиса), к букве А добавляют букву — при нагреве — с, при охлаждении — г.
Таким образом, критические точки, соответствующие превращению Fea в Fey при нагреве, обозначают ЛСз, превращению Fey в Fe8 — ЛС4, а эти же критические точки при охлаждении — АГз и А^.
Коммуникативный педагогический тренинг: способы взаимодействия с разными категориями учащихся
Сертификат и скидка на обучение каждому участнику

Практическое занятие №3
Тема: Построение кривых охлаждения сплава..
1. Цель: ознакомление с принципами построения кривых охлаждения сплава, приобретение навыков построения кривых охлаждения сплавов с разной концентрацией компонентов.
2. Инструктаж на рабочем месте проводится согласно инструкции по охране труда при работе в лаборатории материаловедения №30 ИОТ – 030 2017.
3. Перечень средств обучения: диаграммы состояния сплавов, чертежные принадлежности, калькулятор.
4. Теоретическая часть.
Диаграмма состояния показывает изменение состояния сплавов в зависимости от температуры и концентрации.
Если в системе имеется два компонента, то диаграмма будет иметь два измерения: первое - температурная шкала, второе - концентрация сплава. Каждая точка на оси абсцисс соответствует определённому содержанию каждого компонента. Общее содержание компонентов в сплаве - 100%. Крайние ординаты на диаграмме соответствуют чистым компонентам, а ординаты между ними - двойным сплавам.
Каждая точка на диаграмме состояния показывает состояние сплава данной концентрации при данной температуре. Каждая вертикаль соответствует изменению температуры определенного сплава. Изменение фазового состояния сплава отмечается на диаграмме точкой.
Линии, соединяющие точки аналогичных превращений, разграничивают на диаграмме области аналогичных фазовых состояний. Вид диаграммы состояния зависит от того, как реагируют оба компонента друг с другом в твердом и жидком состоянии, то есть, растворимы ли они в жидком и твердом состоянии, образуют ли химические соединения и так далее.

Обычно диаграммы состояния строят, экспериментально используя термический анализ, то есть строят кривые охлаждения и по остановкам и перегибам на этих кривых, вызванным тепловым эффектом превращений, определяют температуры превращений. Эти температуры называют критическими точками. Температуру металлов измеряют обычно при помощи термопары. Имея достаточное количество сплавов, и определив в каждом сплаве температуры превращений, можно построить диаграмму состояния.
Диаграмма состояния показывает, какую структуру будет иметь медленно охлажденный сплав при любой температуре.
Наиболее широкое применение в современном машиностроении имеют железоуглеродистые сплавы — сталь и чугун. Поэтому очень важным является знание диаграммы состояния железо-углерод для анализа механических и технологических свойств в зависимости от содержания углерода в железе, назначения режимов термической обработки.
Принципиально важным для железо-углеродистых сплавов является то, что основной компонент - железо существует в двух аллотропических модификациях: объемноцентрированного куба (Feα) и гранецентрированного куба (Feγ). Из кривой охлаждения чистого железа (рис.1) видно, что Feα существует в двух интервалах температур : ниже 911°С и от 1392 до 1539°С.
Рисунок 1 - Кривая охлаждения чистого железа
Достигнув при охлаждении температуры 1392°С, Feα претерпевает аллотропическое превращение, в процессе которого кристаллическая решетка объемно-центрированного куба при постоянной температуре перестраивается в решетку гранецентрированного куба Feγ. Второе аллотропическое превращение в процессе охлаждения происходит при температуре 911°С, когда Feγ (решетка гранецентрированного куба) перестраивается в объемноцентрированную кубическую решетку Feα.
При температуре 768°С, называемой точкой Кюри, железо испытывает магнитное превращение: ниже 768°С железо становится магнитным. Магнитное превращение есть особый вид превращения и имеет ряд особенностей, отличающих его от аллотропического превращения.
Железо с углеродом образует твердые растворы внедрения и химические соединения. В зависимости от содержания углерода железо-углеродистые сплавы делятся на два класса: стали и чугуны.
Сталями называются сплавы, содержащие до 2,14% углерода. Чугуны имеют в своем составе от 2,14 до 6,67% углерода.
В зависимости от содержания углерода и структуры сталей различают:
- техническое железо - сплавы, содержащие до 0,02% углерода.
- доэвтектоидные стали - сплавы, содержащие от 0,02 до 0,8% углерода,
- эвтектоидные стали - сплавы, содержащие 0,8% углерода,
- заэвтектоидные стали - сплавы, содержащие от 0,8 до 2,14% углерода.
Первичная и вторичная кристаллизация стали.
При изучении превращений в железо-углеродистых сплавах в процессе медленного охлаждения и их микроструктуры в равновесном состоянии пользуются диаграммой состояния "железо-цементит" (рис.2).
Диаграмма состояния ''железо-цементит", как и другие диаграммы состояния для двухкомпонентных систем, построена в координатах "температура-концентрация углерода в %”. Максимальная концентрация углерода на диаграмме состояния составляет 6,67 %, что соответствует 100% цементита.
Первичная кристаллизация - это переход металла из жидкого состояния в твердое, т.е. процесс образования твердых кристаллов непосредственно из жидкого расплава.
Для углеродистых сталей этот процесс начинается при охлаждении, когда температура достигает значений, соответствующих линии АВС, и заканчивается на линии HJE . После окончания первичной кристаллизации и достижения температуры, соответствующей линии HJE, сталь, независимо от содержания в ней углерода, имеет полиэдрическую структуру аустенита, который при дальнейшем медленном охлаждении сохраняется до линии GS — в доэвтектоидных сталях и до линии SE - в заэвтектоидных.
В отличие от первичной кристаллизации процесс выделения вторичных кристаллов из твердой фазы носит название вторичной кристаллизации.
Сущность вторичной кристаллизации для углеродистых сталей состоит в распаде аустенита при охлаждении стали и образовании новых фаз: феррита и цементита.
Вторичная кристаллизация в доэвтектоидных сталях начинается выделением феррита при достижении уровня температур при охлаждении, соответствующих линии GS. Из диаграммы состояния видно, что температура начала вторичной кристаллизации не постоянна. В доэвтектоидных сталях она понижается с увеличением содержания углерода.
В области GSP структура состоит из двух фаз: ауcтенита и феррита. По мере охлаждения от линии GS к линии PS количество феррита постепенно увеличивается, а количество аустенита уменьшается; при этом в оставшемся аустените концентрация углерода увеличивается по линии GS в направлении к точке S и достигнет 0,8 % при 727°С (линия PS ).
При охлаждении заэвтектоидных сталей из аустенита по линии ES начинает выделяться вторичный цементит. При дальнейшем охлаждении между линиями ES и SK структура стали состоит из аустенита и вторичного цементита, количество которого непрерывно возрастает. Охлаждаясь, аустенит обедняется углеродом и достигает эвтектоидного состава ( 0,8 %С ) при температуре 727° С ( линия SK ).

Рисунок 2 - Диаграмма состояния железо - цементит
Таким образом в доэвтектоидных, эвтектоидных и заэвтектоидных сталях при температуре 727°С аустенит содержит 0,8 %С и распадается при постоянной температуре на две фазы: феррит и цементит: А0,8%С → (Ф0,02%С + Ц6,67%С), а структура образующейся механической смеси называется перлитом.
5. Перечень контрольных вопросов:
1. Поясните аллотропические превращения железа.
2. Перечислите виды сталей в зависимости от содержания углерода.
3. Перечислите фазы на диаграме железо-цементит.
5. Опишите принцип построения диаграмм состояния сплавов.
6. Практические задания
1. Ознакомиться с теоретическими сведениями.
2. Построить диаграмму состояния железо – цементит.
3. Построить кривую охлаждения для железо-углеродистого сплава заданной концентрации, опишите процессы происходящие при охлаждении.
4. Построить кривую охлаждения для заданного двухкомпонентного сплава заданной концентрации, опишите процессы происходящие при охлаждении.
5. Сделать выводы и составить отчет по работе.
7.Требования к оформлению отчета:
Тема практического занятия.
2. Перечень средств обучения.
3. Краткое описание хода практического занятия. Расчеты, таблицы, графики.
Диаграмма состояния (рис. 1) представляет собой графическое изображение; состояния сплавов в зависимости от температуры и концентрации компонентов. Она позволяет определить агрегатное состояние сплавов в заданном диапазоне интервалов температур и химического состава, а также компоненты, фазы и структурные составляющие в количественном и качественном отношении.
Компоненты - это составляющие сплавов, имеющие свои физические и механические свойства. Компонентами черных металлов являются железо Fе и углерод С.
Фазой называется однородная часть системы (сплава), имеющая свои физические и механические свойства, отделенная от других частей поверхностью раздела, при переходе через которую химический состав или структура сплава изменяются скачкообразно.
Диаграмма состояния показывает устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. В соответствии с этим и изменения в состоянии, которые отражены на диаграмме, относятся к равновесным условиям, т.е. при отсутствии перегрева или переохлаждения. Однако равновесные превращения в действительности не могут совершаться, поэтому диаграмма состояния представляет собой теоретический случай, а в практике используется для рассмотрения превращений при малых скоростях нагрева или охлаждения.

Рис.1 Диаграмма состояния железо-углерод
Общие закономерности сосуществования устойчивых фаз, отвечавших теоретическим условиям равновесия, могут быть выражены в математической форме, именуемой правилом фаз, или законом Гиббса..
Правило фаз представляет собой математическое выражение условия равновесия системы, т.е. уравнение правила фаз показывает количественную зависимость между числом степеней свободы системы і и числом компонентов k и фаз f:
Следует знать, что под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, концентрация), которое можно менять без изменения числа фаз в системе.
Если число степеней свободы равно нулю (нонвариантная система), то, очевидно, нельзя изменять внешние и внутренние факторы системы без того, чтобы это не вызвало изменения числа фаз. Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах одного из перечисленных факторов, и это не вызовет уменьшения или увеличения числа фаз.
Пример: Определить число степеней свободы жидкого железоуглеродистого сплава, у которого при температуре ликвидус начали выпадать первичные кристаллы аустенита.
Число компонент в этом сплаве 2, т.е. железо и углерод. Число фаз тоже 2, т.е. жидкая фаза и твердая фаза кристаллов аустенита.
Т.о. число степеней свободы будет определено как:
Из ответа следует, что в данной системе существует одна степень свободы по температуре. Т.е. двухфазное состояние может существовать от температуры начала кристаллизации до температуры окончания кристаллизации.
СТРУКТУРНЫЕ СОСТАВЛЯЮЩИЕ ЖЕЛЕЗОУГЛЕРОДИСТЫХ СПЛАВОВ
Черные металлы представляют собой сплавы из двух компонентов железа и углерода (в данной работе не учитываются примеси и легирующие добавки), железо и углерод, неограниченно растворимые в жидком состоянии, в твердом образуют два типа твердых веществ - ограниченные твердые растворы внедрения углерода в железе и химическое соединение - карбид железа. При этом первичным процессом является образование твердых растворов; карбид железа или цементит образуют атомы углерода, не растворившиеся в железе. Аллотропия железа приводит к образованию двух типов твердых растворов: высокотемпературного (аустенит) и низкотемпературного (феррит).
ИЗУЧЕНИЕ ДИАГРАММЫ СОСТОЯНИЯ ЖЕЛЕЗОУГЛЕРОДИСТЫХ СПЛАВОВ
Характеристика и определение линий диаграммы состояния:
АВСД – линия ликвидус начало первичной кристаллизации;
АHIЕСF - линия солидус - окончание первичной кристаллизации;
GSE - начало вторичной кристаллизации (перекристаллизации);
PSK - окончание вторичной кристаллизации для сталей и перекристаллизации для чугунов, эвтектоидная горизонталь;
HIB – перитектическая горизонталь;
ECF– эвтектическая горизонталь;
HJB– перитектическая горизонталь;
SE– линия растворимости углерода в γ-железе;
PQ– линия растворимости углерода в α-железе.
Характеристика и определение основных точек диаграммы состояния:
Д – температура плавления цементита (1600 0 С);
A– температура плавления чистого железа (1539 0 С);
Е–характеризует предел растворимости углерода в аустените и разделяет диаграмму на стали (левее точки Е) и чугуны (правее точки Е);
S – эвтектоидная точка образования механической смеси феррита и вторичного цементита - перлита;
С – эвтектическая точка образования механической смеси аустенита и первичного цементита (ледебурита) из расплава;
I – перитектическая точка образования твердого раствора аустенита из феррита и жидкости;
G – температура перехода α-железа в γ-железо;
N – температура перехода γ-железа в δ-железо.
ПО ДИАГРАММЕ СОСТОЯНИЯ
Применение правила рычага(рис. 2) сводится к определению массовой концентрации какой-либо фазы при заданной температуре в двухфазной области диаграммы состояния. Для этого нужно через эту точку провести коноду в1в2, соединяющую линии ликвидус и солидус, и разделить длину отрезка коноды, противолежащего данной фазе, на общую длину коноды.

Рис. 2. Пример применения правила рычага (а).
Отрезки в1в0 и в0в2 – это отрезки, соответствующие массовым долям твердой и жидкой mL фаз. Чтобы найти массовую концентрацию твердой фазы, надо длину отрезка, противолежащего к твердой фазе, т.е длину отрезка в0в2, разделить на длину всей коноды в1в2 и умножить на 100%. Точно так же находится массовая концентрация жидкой фазы.
Вначале определим процентное содержание твердой и жидкой фаз.
= ; = 57,8 %. Тогда = 100% – 57,8% = 42,2 %.
Если масса сплава 1 кг, то = 578 г. Соответственно mL= 422 г.
Правила фаз гиббса
На диаграмме железо-углерод мысленно проводится вертикальная линия, и определяются температуры структурных и фазовых превращений.
Для построения кривой охлаждения какого-либо сплава нужно определить является ли эта температура температурой фазового превращения. Следовательно, для каждой температуры нужно посчитать число степеней свободы і. Если і = 0, то эта температура является температурой фазового превращения и на кривой охлаждения при этой температуре следует рисовать горизонтальное плато. Длина плато зависит от массы сплава и от концентрации углерода. Если і ≠ 0, значит это температура структурного превращения и на кривой охлаждения должен наблюдаться перегиб, т.е. при этой температуре меняется скорость охлаждения.
Например, построим кривую охлаждения для железоуглеродистого сплава с содержанием углерода 1%.
Мысленная вертикальная линия пересекает диаграмму железо-углерод в 4 местах: при температурах Т1=1480 , Т2=1330 , Т3=820 , Т4=727 .
Для каждой температуры посчитаем число степеней свободы і. Из правила фаз Гиббса і=k-f+1. Число компонент к = 2 (железо, углерод), 1- число внешних воздействий (температура). Следовательно, для каждой температуры нужно посчитать число фаз f, которые находятся в равновесии при этой температуре.
При Т1 в равновесии находятся жидкость и аустенит, который начал кристаллизоваться. Следовательно f=2, і=2-2+1=1 и на кривой охлаждения будет перегиб.
При Т2 в равновесии находятся аустенит и оставшаяся жидкость. Следовательно f=2, і=2-2+1=1 и на кривой охлаждения будет перегиб.
При Т3 в равновесии находятся аустенит и вторичный цементит, который начал выделяться при вторичной кристсллизации. Следовательно f=2, і=2-2+1=1 и на кривой охлаждения будет перегиб.
При Т4 в равновесии находятся аустенит и вторичный цементит, а также перлит (механическая смесь феррита и цементита), который перекристаллизовывается из оставшегося аустенита. Следовательно f=3, і=2-3+1=0 и на кривой охлаждения будет горизонтальное плато.
Теоретическая кривая охлаждения будет выглядеть следующим образом:
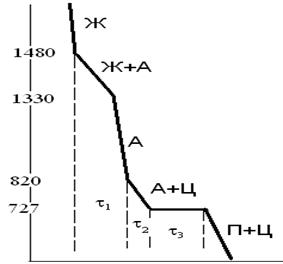
Рис. 5. Кривая охлаждения железоуглеродистого сплава с содержанием углерода 1%.
ПРАКТИЧЕСКАЯ ЧАСТЬ
· Зарисовать в тетради часть диаграммы железо-углерод, соответствующая варианту задания (таблица).
· Провести вертикальную линию на диаграмме при заданной концентрации углерода.
· Определить температуры структурного или фазового превращения сплава.
· Для каждой температуры посчитать число степеней свободы і.
· Построить кривую охлаждения данного сплава.
| Вариант | Содержание углерода, % | Температуры, о С. |
| 0,5 | 1000-25 | |
| 0,8 | 1700 - 25 | |
| 1000-25 | ||
| 1150-25 | ||
| 1700-1000 | ||
| 4,3 | 1700-25 | |
| 5,5 | 1700-1000 | |
| 6,67 | 1700-1000 | |
| 2,5 | 1000-25 | |
| 1000-25 | ||
| 0,1 | 1700-1000 | |
| 0,12 | 1700-1000 | |
| 0,16 | 1700-1000 | |
| 0,01 | 1700-1000 | |
| 0,03 | 1700-1000 | |
| 1000-25 | ||
| 4,5 | 1000-25 | |
| 1000-25 | ||
| 1000-25 | ||
| 0,02 | 1000-25 |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что представляет собой диаграмма железо-углерод?
2. Что называется фазой и компонентом системы?
3. Приведите математическую формулировку правила фаз и закона Гиббса.
4. Назовите основные структурные составляющие железоуглеродистых сплавов.
5. Перечислите основные операции при выполнении термического анализа.
6. Что называется критической точкой диаграммы?
7. В чем сущность перитектического, эвтектического и эвтектоидного превращений?
8. Укажите порядок расчета фаз и структур при использовании правила отрезков.
9. Как зависят механические свойства углеродистой стали от изменения содержания углерода?
10. Как должны отличаться практическая и теоретическая кривые охлаждения?
Контрольный тест
| № зада-ния | Наименование задания |
| Привести в соответствие название структурной составляющей железоуглеродистых сплавов с ее определением: | |
| А.Низкотемпературный феррит | A. Твердый раствор внедрения углерода в α-железо |
| В.Цементит | B. Механическая эвтектоидная смесь феррита и цементита |
| С.Перлит | C. Механическая эвтектическая смесь аустенита и цементита |
| D.Ледебурит | D. Химическое соединение Fe3C |
| E.Аустенит | T. Твердый раствор внедрения углерода в δ-железо |
| F. Твердый раствор внедрения углерода в γ-железо | |
| Привести в соответствие наименование фазового превращения диаграммы железо-углерод с его температурой (в 0 С): | |
| А. Температура плавления железа | A. 911 |
| В. Температура эвтектического превращения | B. 1539 |
| С. Температура перитектического превращения | C. 1499 |
| D. Температура плавления цементита | D. 1130 |
| E. Температура эвтектоидного превращения | E. 1600 |
| F. 727 | |
| Привести в соответствие критическую точку диаграммы железо-углерод с ее концентрацией: | |
| А. P | A. 0,1% |
| В. E | B. 0,006% |
| С. S | C. 0,8% |
| D. F | D. 6,67% |
| E. Q | E. 2,14% |
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПОСТРОЕНИЯ ДИАГРАММЫ СОСТОЯНИЯ ЖЕЛЕЗО-УГЛЕРОД
Диаграмма состояния (рис. 1) представляет собой графическое изображение; состояния сплавов в зависимости от температуры и концентрации компонентов. Она позволяет определить агрегатное состояние сплавов в заданном диапазоне интервалов температур и химического состава, а также компоненты, фазы и структурные составляющие в количественном и качественном отношении.
Компоненты - это составляющие сплавов, имеющие свои физические и механические свойства. Компонентами черных металлов являются железо Fе и углерод С.
Фазой называется однородная часть системы (сплава), имеющая свои физические и механические свойства, отделенная от других частей поверхностью раздела, при переходе через которую химический состав или структура сплава изменяются скачкообразно.
Диаграмма состояния показывает устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. В соответствии с этим и изменения в состоянии, которые отражены на диаграмме, относятся к равновесным условиям, т.е. при отсутствии перегрева или переохлаждения. Однако равновесные превращения в действительности не могут совершаться, поэтому диаграмма состояния представляет собой теоретический случай, а в практике используется для рассмотрения превращений при малых скоростях нагрева или охлаждения.

Рис.1 Диаграмма состояния железо-углерод
Общие закономерности сосуществования устойчивых фаз, отвечавших теоретическим условиям равновесия, могут быть выражены в математической форме, именуемой правилом фаз, или законом Гиббса..
Правило фаз представляет собой математическое выражение условия равновесия системы, т.е. уравнение правила фаз показывает количественную зависимость между числом степеней свободы системы і и числом компонентов k и фаз f:
Следует знать, что под числом степеней свободы (вариантностью) системы понимают число внешних и внутренних факторов (температура, концентрация), которое можно менять без изменения числа фаз в системе.
Если число степеней свободы равно нулю (нонвариантная система), то, очевидно, нельзя изменять внешние и внутренние факторы системы без того, чтобы это не вызвало изменения числа фаз. Если число степеней свободы равно единице (моновариантная система), то возможно изменение в некоторых пределах одного из перечисленных факторов, и это не вызовет уменьшения или увеличения числа фаз.
Пример: Определить число степеней свободы жидкого железоуглеродистого сплава, у которого при температуре ликвидус начали выпадать первичные кристаллы аустенита.
Число компонент в этом сплаве 2, т.е. железо и углерод. Число фаз тоже 2, т.е. жидкая фаза и твердая фаза кристаллов аустенита.
Т.о. число степеней свободы будет определено как:
Из ответа следует, что в данной системе существует одна степень свободы по температуре. Т.е. двухфазное состояние может существовать от температуры начала кристаллизации до температуры окончания кристаллизации.
Читайте также:

