Как сделать красный фосфор
Обновлено: 07.07.2024
В соответствие Это неметаллический элемент, который представлен химическим символом P и имеет атомный номер 15. Он имеет три основные аллотропные формы: белый, красный и черный фосфор. Белый фосфор фо
Содержание:
В соответствие Это неметаллический элемент, который представлен химическим символом P и имеет атомный номер 15. Он имеет три основные аллотропные формы: белый, красный и черный фосфор. Белый фосфор фосфоресцирует, самопроизвольно горит при контакте с воздухом, а также очень ядовит.
Белый фосфор при 250ºC становится красным фосфором; нерастворимая полимерная форма, не горящая на воздухе. При высоких температурах и давлениях, а также в присутствии или отсутствии катализаторов получается черный фосфор, напоминающий графит и являющийся хорошим проводником электричества.
Фосфор был впервые выделен Х. Брандом в 1669 году. Для этого он использовал мочу как источник этого элемента. В 1770 году В. Шееле обнаружил, что он также может выделять фосфор из костей.
Позже, в связи с созданием электропечи Дж. Берджессом Ридманом (1800 г.), фосфатные породы стали основным источником производства фосфора из присутствующего в них минерала фторапатита.
Фосфор является двенадцатым элементом земной коры по распространенности, составляя 0,1% от его веса. Более того, это шестой элемент в изобилии в человеческом теле; в основном сосредоточен в костях в виде гидроксилапатита.
Следовательно, он является важным элементом для живых существ и одним из трех основных питательных веществ растений. Фосфор входит в химическую структуру нуклеиновых кислот; соединений-накопителей энергии (АТФ), коферментов; и вообще соединений метаболизма.
История
- Открытие
В моче
Фосфор был выделен Хеннингом Брэндом в 1669 году, став первым человеком, выделившим элемент. Бранд был немецким алхимиком из Гамбурга, которому удалось получить соединение фосфора из мочи. Для этого он собрал мочу из 50 ведер и дал ей разложиться.
Бранд не публиковал свои экспериментальные результаты и продавал их различным алхимикам, включая Иоганна Крафта, Кункеля Ловенштерна и Вильгельма Лейбница. Вероятно, некоторые из них сообщили о работе Бранда в Парижской академии наук, тем самым распространив свои исследования.
Однако Бранд фактически выделил не фосфор, а фосфат аммиака-натрия [Na (NH4) PO4]. В 1680 году Роберт Бойль усовершенствовал процедуру Бранда, с помощью которой он смог получить аллотропную форму фосфора (P4).
В костях
Йохан Готтлиб Ган и Карл Вихельм Шееле в 1769 году установили, что в костях было обнаружено соединение фосфора - фосфат кальция. Обезжиренные кости подвергались процессу переваривания сильными кислотами, такими как серная кислота.
Затем продукт разложения нагревали в стальных емкостях с углем и углем, получая белый фосфор путем перегонки в ретортах. Кости были основным источником фосфора до 1840 года, когда они были заменены для этой цели гуано.
В гуано
Гуано представляет собой смесь птичьего помета и продуктов разложения птиц. Он использовался как источник фосфора и удобрений в 19 веке.
- Индустриальное развитие
Фосфатные породы начали использовать в 1850 году в качестве источника фосфора. Это, вместе с изобретением Джеймсом Берджессом Ридманом (1888 г.) электрической печи для обжига горных пород, сделало фосфатные породы основным сырьем для производства фосфора и удобрений.
В 1819 году были открыты спичечные фабрики, положившие начало промышленному освоению фосфора.
Физические и химические свойства
вид
В зависимости от аллотропной формы он может быть бесцветным, восково-белым, желтым, алым, красным, пурпурным или черным.
Атомный вес
Атомный номер (Z)
Температура плавления
Белый фосфор: 44,15 ºC
Красный фосфор: ~ 590 ºC
Точка кипения
Белый фосфор: 280,5 ºC
Плотность (комнатная температура)
Белый: 1,823 г / см 3
Красный: 2,2-2,34 г / см 3
Фиолетовый: 2,36 г / см 3
Черный: 2,69 г / см 3
Теплота плавления
Белый фосфор: 0,66 кДж / моль
Теплота испарения
Белый фосфор: 51,9 кДж / моль
Молярная калорийность
Белый фосфор: 23,824 Дж / (моль · К)
Состояния окисления
-3, -2, -1, +1, +2, +3, +4 и +5
В зависимости от электроотрицательности элементов, с которыми он сочетается, фосфор может иметь степень окисления +3 или -3. Фосфор, в отличие от азота, имеет тенденцию вступать в реакцию преимущественно со степенью окисления +5; таков случай пятиокиси фосфора (P2ИЛИ5 или P2 5+ ИЛИ5 2+ ).
Электроотрицательность
2,19 по шкале Полинга
Энергия ионизации
-Первый: 1101 кДж / моль
-Второй: 2190,7 кДж / моль
-Третий: 2914 кДж / моль
Теплопроводность
Белый фосфор: 0,236 Вт / (м · К)
Черный фосфор: 12,1 Вт / (м · К)
Выявлено, что черный фосфор проводит почти в шесть раз больше тепла, чем белый фосфор.
Магнитный заказ
Белый, красный, пурпурный и черный люминофор диамагнитны.
Изотопы
Фосфор состоит из 20 изотопов, основными из которых являются: 31 P, единственный стабильный изотоп с содержанием 100%; 32 P, β-излучающий изотоп – и с периодом полураспада 14,28 дня; Y 33 P, β-излучающий изотоп – и с периодом полураспада 25,3 дня.
Фосфоресценция
Белый люминофор фосфоресцирует и излучает в темноте зеленый свет.
Аллотропические изменения
Белый фосфор нестабилен и при температурах, близких к 250ºC, превращается в полимерную форму, известную как красный фосфор, цвет которой может варьироваться от оранжевого до фиолетового. Это аморфное вещество, но оно может становиться кристаллическим; он не светится в темноте и не горит на воздухе.
Белый фосфор при высоких температурах и давлениях или в присутствии катализаторов превращается в полимерную форму, отличную от красного фосфора: черный фосфор. Это черное кристаллическое вещество, инертное, похожее на графит и обладающее способностью проводить электричество.
Растворимость
Белый фосфор в чистом виде нерастворим в воде, но может растворяться в сероуглероде. Между тем красный и черный люминофор нерастворим в воде и менее летуч, чем белый фосфор.
Реактивность
Фосфор самопроизвольно горит на воздухе с образованием P2ИЛИ5, а это, в свою очередь, может реагировать с тремя молекулами воды с образованием ортофосфорной или фосфорной кислоты (H3PO4).
Под действием горячей воды фосфин (PH3) и фосфороксислоты.
Фосфорная кислота действует на фосфатные породы, вызывая дигидрофосфат кальция или суперфосфат [Ca (H2PO4)2].
Может реагировать с галогенами с образованием галогенидов PX3где X представляет собой F, Cl, Br или I; или галогениды формулы PX5, где X - F, Cl или Br.
Точно так же фосфор реагирует с металлами и металлоидами с образованием фосфидов, а с серой - с образованием различных сульфидов. С другой стороны, он связывается с кислородом с образованием сложных эфиров. Таким же образом он соединяется с углеродом с образованием фосфорных органических соединений.
Структура и электронная конфигурация
- Звенья и тетраэдрический блок
Атомы фосфора имеют следующую электронную конфигурацию:
Следовательно, он имеет пять валентных электронов, таких как азот и другие элементы группы 15. Поскольку это неметаллический элемент, его атомы должны образовывать ковалентные связи, пока не завершится октет валентности. Азот достигает этого, утвердившись в виде двухатомных молекул N2, с тройной связью, N≡N.
То же самое происходит с фосфором: два его атома P связаны тройной связью, образуя молекулу P.2, P≡P; то есть дифосфорный аллотроп. Однако фосфор имеет более высокую атомную массу, чем азот, и его 3p-орбитали, более диффузные, чем 2p азота, перекрываются менее эффективно; следовательно, P2 Он существует только в газообразном состоянии.
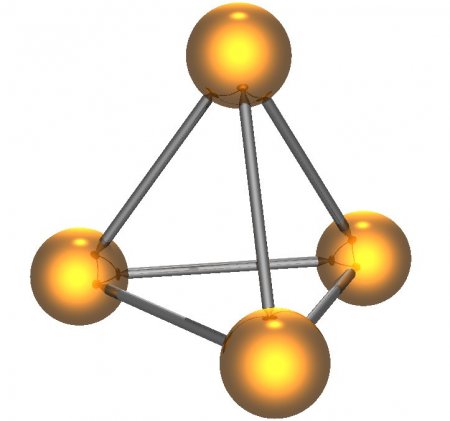
Вместо этого при комнатной температуре атомы P предпочитают ковалентно организовываться другим способом: в тетраэдрической молекуле P4:
Обратите внимание, что на изображении выше все атомы P имеют три одинарные связи вместо одной тройной связи. Таким образом, фосфор в P4 завершает свой октет валентности. Однако в P4 Связи P-P натянуты, так как их углы для невооруженного глаза далеки от 109,5 °.
- Аллотропы
Белый фосфор
То же изображение единиц P4 и его нестабильность объясняют, почему белый фосфор является наиболее нестабильным аллотропом этого элемента.
Единицы P4 они расположены в пространстве для определения ОЦК-кристалла (α-фазы) при нормальных условиях. При понижении температуры до -77,95 ºC кристалл ОЦК превращается в более плотный ГПУ (предположительно) (β-фаза). То есть единицы P4 они расположены в двух чередующихся слоях, A и B, чтобы установить последовательность ABAB .
Красный фосфор
Красный фосфор, однако, в большинстве случаев представляет собой аморфное твердое вещество, поэтому его структура нечеткая. Тогда полимерные цепи P4 Они будут располагаться без видимого рисунка, некоторые произвольно расположены выше, а другие ниже той же плоскости.
Обратите внимание, что это основное структурное различие между белым и красным фосфором: в первом P4 они индивидуальны, а во втором образуют цепочки. Это возможно, потому что одна из связей P-P внутри тетраэдра разорвана, чтобы соединиться с соседним тетраэдром. Таким образом, натяжение кольца уменьшается, и красный фосфор приобретает большую стабильность.
Когда есть смесь обоих аллотропов, она представляется глазу в виде желтого люминофора; смесь тетраэдров и аморфных цепей фосфора. Фактически, белый фосфор становится желтым под воздействием солнечных лучей, поскольку излучение способствует разрыву уже упомянутой связи P-P.
Фиолетовый или люминофор Hittorf
Фиолетовый фосфор - это последний этап образования красного фосфора. Как видно на изображении выше, он по-прежнему состоит из полимерной цепи; но теперь структуры более сложные. Кажется, что структурная единица больше не P4 но P2, расположенные таким образом, что образуют неправильные пятиугольные кольца.
Несмотря на то, насколько асимметричной выглядит структура, этим полимерным цепям удается упорядочиваться достаточно хорошо и с периодичностью, чтобы фиолетовый люминофор мог образовывать моноклинные кристаллы.
Черный фосфор
И, наконец, самый стабильный аллотроп фосфора - черный. Его получают нагреванием белого фосфора под давлением 12000 атм.
На верхнем изображении (ниже) можно увидеть, что его структура с более высокой плоскости имеет определенное сходство со структурой графита; это чистая сеть шестиугольных колец (хотя они кажутся квадратами).
В верхнем левом углу изображения лучше видно то, что только что было прокомментировано. Молекулярное окружение атомов P представляет собой тригональные пирамиды. Обратите внимание, что структура, если смотреть сбоку (верхний правый угол), расположена слоями, которые накладываются один на другой.
Структура черного фосфора довольно симметрична и упорядочена, что согласуется с его способностью утвердиться в виде орторомбических кристаллов. Сложение их полимерных слоев делает атомы P недоступными для многих химических реакций; и поэтому он значительно стабилен и не очень реактивен.
Хотя стоит упомянуть, что дисперсионные силы Лондона и молярные массы этих фосфорных твердых тел определяют некоторые из их физических свойств; в то время как его структуры и связи P-P определяют химические и другие свойства.
Где найти и получить
Апатит и фосфорит
Это двенадцатый элемент земной коры, составляющий 0,1% от ее веса. Существует около 550 минералов, содержащих фосфор, причем апатит является наиболее важным минералом для получения фосфора.
Апатит - это минерал фосфора и кальция, который может содержать различные количества фтора, хлорида и гидроксида, формула которого имеет следующий вид: [Ca10(PO4)6(F, Cl или OH)2)]. Помимо апатита, существуют и другие полезные ископаемые фосфора; так обстоит дело с вавелитом и вивианитой.
Фосфорит или фосфорит - главный источник фосфора. Это осадочная безобломочная порода с содержанием фосфора 15-20%. Фосфор обычно присутствует в виде Ca10(PO4)6F2 (фторапатит). Он также присутствует в виде гидроксиапатита, хотя и в меньшей степени.
Кроме того, фторапатит можно найти в составе магматических и метаморфических пород, а также известняков и сланцев.
Электротермическое восстановление фторапатита
Отобранные фосфатные породы передаются на очистные сооружения. Сначала их измельчают, чтобы получить обломки породы, которые затем измельчают в шаровых мельницах со скоростью 70 оборотов в минуту.
Затем продукт измельчения обломков породы просеивается, чтобы можно было их фракционировать. Фракции с содержанием фосфора 34% выбраны как пятиокись фосфора (P2ИЛИ5).
Белый фосфор (P4) получают в промышленности электротермическим восстановлением фторапатита углеродом при температуре 1500 ºC в присутствии оксида кремния:
Р4 В газообразном состоянии после конденсации он собирается и хранится в виде белого твердого вещества, погруженного в воду, чтобы предотвратить его реакцию с внешним воздухом.
Сплавы
Медный
Фосфорный бланкет изготавливается с различным процентным содержанием меди и фосфора: Cu 94% - P 6%; Cu 92% - P 8%; Cu 85% - P 15% и др. Сплав используется в качестве раскислителя, смачивающего агента в медной промышленности, а также в качестве зародыша в алюминиевой промышленности.
Бронза
Это сплавы меди, фосфора и олова, содержащие 0,5 - 11% фосфора и 0,01 - 0,35% олова. Олово повышает устойчивость к коррозии, а фосфор увеличивает износостойкость сплава и придает ему жесткость.
Он используется в производстве пружин, болтов и, в целом, в изделиях, требующих устойчивости к усталости, износу и химической коррозии. Его рекомендуется использовать в гребных винтах лодок.
Никелированная
Самый известный сплав - NiP.20С фосфорным никелем, который используется в припоях для повышения их устойчивости к химической эрозии, окислению и высоким температурам.
Сплав используется в деталях газовых турбин и реактивных двигателей, гальванике и производстве сварочных электродов.
Риски
Белый фосфор вызывает серьезные ожоги кожи и является мощным ядом, который может быть смертельным при дозах 50 мг. Фосфор подавляет клеточное окисление, препятствуя регулированию клеточного кислорода, что может привести к жировой дегенерации и гибели клеток.
Острое отравление фосфором вызывает боль в животе, жжение, дыхание с запахом чеснока, фосфоресцирующую рвоту, потоотделение, мышечные судороги и даже шоковое состояние в течение первых четырех дней приема пищи.
Позже желтуха, петехии, кровотечение, поражение миокарда с аритмией, нарушение центральной нервной системы и смерть на десятый день после приема внутрь.
Наиболее очевидным проявлением хронического отравления фосфором является повреждение костной структуры челюсти.
Повышение концентрации фосфора в плазме (гиперфосфатемия) обычно возникает у пациентов с почечной недостаточностью. Это вызывает аномальное отложение фосфатов в мягких тканях, что может привести к сосудистой дисфункции и сердечно-сосудистым заболеваниям.
Приложения
Фосфор - важный элемент для растений и животных. Это одно из трех основных питательных веществ растений, необходимое для их роста и потребности в энергии. Кроме того, он входит в состав нуклеиновых кислот, фосфолипидов, промежуточных продуктов обменных процессов и др.
У позвоночных фосфор присутствует в костях и зубах в форме гидроксилапатита.
- Элементный фосфор
Из фосфора изготавливается химическая эмаль, которая используется для подсветки вывесок на алюминии и его сплавах; а также в фосфорной меди и бронзе.
Из него также делают зажигательные бомбы, гранаты, дымовые шашки и трассирующие пули. Красный фосфор используется для изготовления спичек или спичек.
Белый фосфор используется для производства органофосфатов. Кроме того, он используется в производстве фосфорной кислоты.
Большое количество произведенного фосфора сжигается для производства тетраоксида фосфора (P4ИЛИ10), полученный в виде порошка или твердого вещества.
- Соединения
Фосфин
Это сырье для производства различных соединений фосфора. Он действует как допинг для электронных компонентов.
Фосфорная кислота
Он используется в производстве безалкогольных напитков из-за характерного вкуса, который он им придает. Он действует на фосфатные породы с образованием дигидрофосфата кальция [Ca (H2PO4)2], также известный как суперфосфат, который используется в качестве удобрения.
Органофосфаты
Фосфаторганические соединения имеют множество применений; такие как: антипирены, пестициды, экстракционные агенты, агенты нервно-паралитического действия и для очистки воды.
Дигидрат дигидрата фосфата кальция
Он используется в качестве удобрения, разрыхлителя, добавки к корму для животных и при изготовлении зубных паст.
Пятиокись фосфора
Он используется в химическом анализе как дегидратирующий агент и в органическом синтезе как конденсирующий агент. Состав в первую очередь предназначен для производства ортофосфорной кислоты.
Триполифосфат натрия
Он используется в моющих средствах и в качестве смягчителя воды, что улучшает действие моющих средств и помогает предотвратить коррозию труб.
Тринатрийфосфат
Используется как чистящее средство и смягчитель воды.
Фосфаты натрия
Двухосновный фосфат натрия (Na2HPO4) и одноосновный фосфат натрия (NaH2PO4) являются компонентами буферной системы pH, которая действует даже на живых существ; включая людей.

Фосфор (от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus ) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л . В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3 (F,Cl,OH), фосфорит (Сa3(PO4)2) и другие. Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Получение
- 4 Физические свойства
- 4.1 Белый фосфор
- 4.2 Жёлтый фосфор
- 4.3 Красный фосфор
- 4.4 Чёрный фосфор
- 4.5 Металлический фосфор
- 5.1 Взаимодействие с простыми веществами
- 5.2 Взаимодействие с водой
- 5.3 Взаимодействие со щелочами
- 5.4 Восстановительные свойства
- 7.1 Элементарный фосфор
- 7.2 Соединения фосфора в сельском хозяйстве
- 7.3 Соединения фосфора в промышленности
- 7.4 Фосфатные связующие
- 8.1 Токсикология элементарного фосфора
- 8.2 Токсикология соединений фосфора
История
![фосфор]()
Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Более усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Аморфную аллотропную модификацию фосфора — красный фосфор Pn — выделил, нагревая белый фосфор без доступа воздуха, А. Шрёттер в середине XIX в.
Происхождение названия
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
Физические свойства
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропических модификаций. Все существующие аллотропные модификации фосфора пока (2016 г.) до конца не изучены. Традиционно различают четыре его модификации: зеленовато-белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
![фосфор]()
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
![фосфор]()
Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде, но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой.
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г, а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде, а также под действием ионизирующего излучения белый фосфор превращается в красный фосфор.
Жёлтый фосфор
Так как фосфор реагирует с водой лишь при температуре свыше 500 °C, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твёрдое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
![фосфор]()
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других веществах, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2⋅10 9 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 1,8⋅10 6 Па.
Металлический фосфор
При 8,3⋅10 10 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25⋅10 11 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
4P + 5O2 → 2P2O5 (с избытком кислорода) 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — PH3
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Реакция взаимодействия красного фосфора и воды с образованием ортофосфорной кислоты и водорода. Реакция протекает при температуре 700—900 °C. Катализатором могут выступать: платина, медь, титан, цирконий.
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Изотопы
Известно более 20 изотопов фосфора (с массовым числом от 24 до 47). Природный изотоп 31 P стабилен. Из радиоактивных изотопов наиболее долгоживущие: 30 P (T1/2 = 2,5 мин), 32 P (T1/2 = 14,26 сут) и 33 P (T1/2 = 25,34 сут)..
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
![черный фосфор]()
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Ca3(PO4)2·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
- для взрослых 1,0—2,0 г
- для беременных и кормящих женщин 3—3,8 г
- для детей и подростков 1,5—2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5—2 раза.
Усвоение происходит эффективнее при приёме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
Продукт Содержание, мг/100 г Очищенное конопляное семя 1650 Семена тыквы (ядра) 1233 Семена подсолнечника (ядра) поджаренные 1158 Семена мака 870 Горчичный порошок 828 Кунжут (очищенный) 774 Семена дыни (ядра) 755 Какао-порошок 734 Твёрдый пармезан 694 Семена подсолнечника (ядра) сушёные 660 Сафлора семена (ядра) 644 Семена льна 642 Семена лотоса 626 Сыр швейцарский нежирный 605 Кешью сырые 593 Орехи пили 575 Амарантовая крупа 557 Сыр гауда 546 Овёс 523 Грецкий орех чёрный 513 Печень говяжья тушёная 497 Фисташки сырые 490 Миндаль 481 Киноа 457 Люпин, семена 440 Карп 415 Фасоль 407 Арахис 397 Сыр рокфор 392 Мука из цельного зерна 357 Печень куриная 297 Вырезка свиная 286 Желтоперый тунец 278 Сгущённое молоко 253 Яйцо 198 Говядина 188 Курица 178 Токсикология элементарного фосфора
- Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
- Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать поражённые участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Ввиду высокой (ЛД50 15-100 мг/кг) и чрезвычайно высокой ( Опасность для здоровья
Скорее всего около 900-1000°С.
Поначалу белый фосфор получали из мочи как раз при такой температуре. Якобы там восстанавливаются легкоплавкие фосфаты натрия и калия. В кач. усовершенствования метода добавляли поташ.
Вообще при такой температуре углём даже натрий из соды немного восстанавливается.
Промышленный способ - фосфат кальция с песком и углём - требует 1300-1600°С, иначе нет контакта. Фосфат плавится 1670, песок где-то там же, уголь вообще не плавится.
Если взять двойной суперфосфат, он сплавится в метафосфат кальция Ca(PO3)2. Так фосфор какое-то время тоже получали, температура была не очень высокая.
Можно ещё купить какой-нибудь калгон с полифосфатами натрия и с углём его прокаливать.
Только стекло эти расплавы не выдержит, они в него въедаются, потом оно трескается.Кстати фосфор запрещён к продаже не столько из-за огнеопасности и ядовитости,сколько из-за того, что торчки с его помощью готовят какой-то свой препарат.Используют даже спичичные коробки и хлопушки.
Красный фсфор не ядовит. Очень ядовит белый фосфор - он накапливается в организме и от него може т начаться некроз челюсти.
При получении белого фосфора выделяются очень ядовитые газы фосфин ( пахнет карбидом) и угарный газ.
Белый Фосфор надо собирать под водой.В орг. химии фосфором с HI восстанавливают спирты.
Наркоманы раньше варили с ним эфедрин, получали грязное варево со стимулирующим действием. У нас в доме жила парочка таких, потом они перешли на гераин, теперь их уже нет в этом мире.
Наркоманы, употребляющие аптечное варево живут очень не долго.
Сейчас ещё есть торчки, которые варят всякие таблетки. Колятся прям химическими отходами. Год-два кайфа, потом на тот свет.у нас весь город таких :ph34r:
кст. если я его достану(вы поняли гдеupps*&), то что с него могу получить?Ну, хлопушки из него. врядли кто делаеть будет.
Мне отец рассказывал, они мешали его с бертолеткой и песком и в пакетиках на дорогу клали. Типа, мины. Сейчас уже неинтересно - долго ждать, проще петарды кидать.С фосфора и бертолетки можно делать бертофоску - смесь очень чувствительная к удару, в больших количествах лучше её не готовить.
Также фосфор в воде горит.Если у когото есть другие рецепты,то выкладывайте.Заранее спасибо
вчера добавил к фосфору раство спиртового йода, смесь протряс, и поставил на сушку, образовался красный осадок на дне пробирки. Что это, и какой опасностью может этот осадок обладать ( зная реакцию NI3). Подскажите срочно, по возможности более точным ответом!
Вероятнее всего возможна реакция:
P+J2 -->PJ3 или PJ5
При н.у. присоединение такого галогена как иод к фосфору на вряд ли пойдет, но точно надо смотреть в литературе. Плюс у тебя присутствие спирта и KJ. Сейчас нет времени смотреть, собираюсь на работу. Когда приду тогда гляну и можно будет покумекать. А вообще заинтересовала меня эта штука.Вероятнее всего возможна реакция:
P+J2 -->PJ3 или PJ5
При н.у. присоединение такого галогена как иод к фосфору на вряд ли пойдет, но точно надо смотреть в литературе. Плюс у тебя присутствие спирта и KJ. Сейчас нет времени смотреть, собираюсь на работу. Когда приду тогда гляну и можно будет покумекать. А вообще заинтересовала меня эта штука.Да, вопрос в спирте. была бы вода , все было бы ясно. наркоманская реакция
Я слышал что соеденения йода с неметаллами в некой мере взрывоопасны, вот я думаю теперь че делать?
Я слышал что соеденения йода с неметаллами в некой мере взрывоопасны, вот я думаю теперь че делать?
А что делать, выташить из колбы милиграм 50, высушить , и поэксперементировать. Такое количество вряд ли чем навредит.
ПС поджигать каминными спичкамиВ иодной настойке же присутствует вода?Если да,то это не PJ3,потому что он гидролизуеться водой PJ3+H2O=H3PO3+HJ.Ето лаб.способ получения HJ.
В иодной настойке же присутствует вода?Если да,то это не PJ3,потому что он гидролизуеться водой PJ3+H2O=H3PO3+HJ.Ето лаб.способ получения HJ.
это не лаб.способ получения HJ это наркоманский способ присоединения водорода к эфу &)
Кароче так, я взял йодную настойку 5% добавил к ней (на глаз) равное кол-во фосфора, и получилась на дне пробирки, красная байда. Что это такое?
Кароче так, я взял йодную настойку 5% добавил к ней (на глаз) равное кол-во фосфора, и получилась на дне пробирки, красная байда. Что это такое?
1) что ты этим опытом хотел получить?
2) мешая реактивы наобум можно либо отравиться либо подорваться, смысл тратить достаточно редкий реактив, если ничего конкретного не хочеш получить.По теме, иодистый фосфор должен получиться, но нах он тебе? Если пропорции непрощитаны то еще + фосфор
Вот рецепт, взятый мною не помню уж с какого форума:
Фосфор делал 2 раза в своей жизни но делал его пол килограмма, нет не из спичечных коробков, хлопушек, ракетниц и так далее.
Ну вот если кому надо вот принцип:
Ca3(PO4)2+3SiO2=3CaSiO3+P2O5 далее
P2O5+5C=2P+5СO
Ну что понятно?)
Короче не буду умничать берёте что-то не железное и не стеклянное У меня был Горшок на 8 кг глиняной
Ставите туда фосфат+песок+Уголь(Лучше брать активированный Древесный) с ним реакция проходит гораздо быстрее!
Помнится мне я уголь покупал в нескольких аптеках ибо раскупал всё и все равно не хватало да он и копейки стойт..
Итак всё тусанули в горшок(лучше когда стенки горшка тонкие) теперь ставим родную крышку от горшка у меня была с пимпочкой такой наверху и небыло удобно переворачивать и я пимпочку оторвал и он замечательно стоял в перевёрнутом виде, в дне горшка отверстие приспосабливаем под него изогнутую трубку желательно из меди но если нету то можно и нержавейку. Итак трубка изогнутая(полукруг) второй конец длиннее и ставим его в банку 10 литровую с водой(любой я имею введу что необязательно применять дистиллированную воду)
и так всё установка готова - ещё раз убедитесь что горшок стоит плотно в перевёрнутом виде ах да совсем забыл отверстие где трубка ставим кусок цемента или глины кому как(это там где горшок а не там где бутыль) для того чтобы пары фосфора не уходили в атмосферу да и то отравитесь если не загерметизираванно хорошо
Берём первые 2 литра Бензина любого заливаем в паяльную лампу, качаем её поджигаем ставим пламя сильное и направляем на горшок. Идём тусуемся где-то часа 2 .
приходим заливаем ещё 2 литра бензина и опять же оставляем часа на 2 это зависит от того какое пламя не жалейте бензина один раз же делаете. После чего пламя потухло смотрим в банку на дне много много осадка прозрачного - это белый фосфор._Очень токсичное вещество!
слили аккуратно воду даём постоять чучуть дабы вода вся вышла - короче максимально отжимаем воду - Не трогайте эту бодягу руками.
Слили воду, бутыль закатываем и ставим на солнце где-то через недельку или 2 зависит от того как сильно солнце бьёт у вас дохуйще КРАСНОГО 100% чистого сыпучего . Если нету солнце не страшно ставим бутыль на комфорку электрическую ставим самый слабый огонь и оставляем на 1- 2 сутки тот же результат(чем больше воды останется тем больше создадутся давление в бутыле так что смотрите сами я на солнце всегда оставлял стрёмно было - ЖИТЬ то хочется!)
Ну вот вам вполне приличный на мой взгляд рецепт КРАСНОГО![Логотип]()
![Самоделки своими руками]()
Как сделать фосфор
- Вы не можете создать новую тему
- Вы не можете ответить в тему
Сегодня же многие из нас имеют высшее образование, но тот детский азарт еще не прошел и в сочетании с нашей любознательностью появляется желание сделать фосфор самостоятельно. Но вся беда в том, что подобными делами занимаются крупные предприятия, которые обладают специальным оборудованием. Получают его из фосфата кальция техническим путем.
Но после этих строчек вряд ли в человеческом сознании угаснет ярое желание сделать фосфор самостоятельно без прогулок на подобный завод. Что же, мы поможем вам в данном начинании, но будьте предельно осторожны в процессе его создания.
После этого вы достаете железную банку и устремляете взгляд на ее дно, где должен появиться белый осадок, который и является полноценным белым фосфором. Что же вы в дальнейшем собираетесь с ним делать — это ваше дело, но не забывайте, что он ядовит.Кроме того получить фосфор можно и другим способом. Но он, к сожалению, слишком тяжел в техническом плане выполнения. Фосфор можно получить из спичечных коробков, но в комплект к ним придется взять соляную кислоту, доступ к которой, имеется далеко не у каждого человека. А посему, если вам так не терпится создать фосфор самостоятельно, то возвращайтесь к простому способу. Желаем вам удачи!
Как-то в 2002-03 годах в Летней Школе показывали очень интересные опыты + естественно взрывы напоследок. Волшебные палочки из смеси кр. фосф. с бертолеткой, измазанной в растворителе или клее. Хочется воспроизвести. - друзей порадовать, девушку и т.п.
Defr писал(а): Как-то в 2002-03 годах в Летней Школе показывали очень интересные опыты + естественно взрывы напоследок. Волшебные палочки из смеси кр. фосф. с бертолеткой, измазанной в растворителе или клее. Хочется воспроизвести. - друзей порадовать, девушку и т.п.
Никто не даст\продаст. Так как под прицелом . Более скажу для таких целей не то чтобы P, даже С никто не даст.
С красным фосфором я знаю, как друзей радуют.
Вещество запрещено, прекурсор.Если для баловства, купи петарду и радуйся.
Не, гроб: вещество запрещено насмерть сразу по двум причинам, каждой из которых в отдельности было бы достаточно.
А то порадовал один такой в том году на Черкизовском.Купить в Москве - не получится.
А из своих старых запасов на всякую фигню никто не даст (а то Гелля-Фольгарда-Зелинского ставить не с чем будет)Читайте также: