Как сделать кетон
Добавил пользователь Дмитрий К. Обновлено: 04.10.2024
Кетон представляет собой органическое соединение , часть семейства карбонильных соединений , один из атомов углерода , из которых несет карбонильную группу.
В отличие от альдегидов (которые имеют только первичный углерод вокруг этой группы), это вторичный углерод (связанный ровно с двумя соседними атомами углерода), который несет карбонильную группу для кетонов.
Следовательно, кетон содержит последовательность R-CO-R 1 (изображение напротив), где R и R 1 представляют собой углеродные цепи, а не простые атомы водорода, связанные с центральным углеродом, несущим карбонильную функцию.
Резюме
Номенклатура
- Карбонильная функция присутствует в основной группе (самой длинной углеродной цепи ): название кетона получается добавлением суффикса-one к названию соответствующего углеводорода , указывающего место карбонильной связи в углеродной цепи.
- Карбонильная функция присутствует только во вторичной группе: добавляется приставкаоксо- , указывающая ее место в углеродной цепи вторичной группы.
Пример
Можно, например, упомянуть ацетон (стандартное название которого пропан-2-он) CH 3 -CO-CH 3 .
Основные кетоны
Свойства, реакционная способность
Они являются общими для альдегидов и кетонов, особенно в отношении их кето / енольного баланса. См. Общую статью о карбонильном соединении .
Обучение
Путем промышленного окисления
- Окисление O 2 воздуха. Катализатор может быть использован в качестве Fe 2 O 3 или MnO 3 до 400 ° C , или серебряного катализатора до 600 ° C .
- Каталитическое дегидрирование вторичных спиртов Спирт газированный. CuO , около 400 до 500 ° C , Ag, Cu около 300 ° C , ZnO или ZrO около 300 до 400 ° С, используют в качестве катализатора .
- Процесс Wacker-Hœchst
Путем химического окисления
Часто используется дихромат калия или Cr (VI) (например, через PCC ), но наиболее часто используемым реагентом является реактив Джонса : CrO 3 в присутствии серной кислоты в ацетоне. Иногда, если присутствие кислоты беспокоит, используют реактив Саретта : CrO 3 в пиридине.
Путем гидролиза алкинов
При добавлении воды к алкину в кислой среде карбонильная группа образуется на углероде, несущем тройную связь с наименьшим количеством атомов водорода ( правило Марковникова ), при условии наличия окисленной ртути +2 в качестве катализатора (Hg 2+ ). Другой углерод, несущий тройную связь, будет восстановлен за счет получения двух атомов водорода .
Озонолизом алкенов
Озонолиза лечения реактива к озону и воде . Здесь, алкены подвергаются озонолиз с образованием группы карбонила , при условии , чтобы иметь в качестве катализатора из этановой кислоты (или уксусная кислоты) и цинк окисляется 2 (Zn 2+ ). При этом образуется очень нестабильный циклический промежуточный продукт: озонид, который затем превращается в кетон или альдегид . Чтобы получить кетон из алкена, по крайней мере, один углерод, несущий двойную связь, должен быть связан исключительно с другими атомами углерода, иначе будет образовываться альдегид. В результате реакции также выделяется перекись водорода .
Например, обрабатывая 2-метилбут-2-ен озоном и водой (с необходимыми катализаторами), получают пропанон (кетон), этаналь или ацетальдегид (альдегид) и перекись водорода.
По реакции Фриделя-Крафтса на ароматическое соединение
Принцип состоит в объединении бензола с ацилхлоридом и AlCl 3 . В результате к бензолу и HCl присоединяется кетон. Механизм реакции следует принципу электрофильного присоединения к ароматическому веществу, отсюда и присутствие AlCl 3 (кислота Льюиса), который будет использоваться для создания электрофила (см. Реакцию Фриделя-Крафтса ) .
Использование кетонов
Кетоны используются в производстве пластмасс в качестве растворителей, а также в качестве красителей в парфюмерии и таких лекарственных препаратов, как альдегиды .
Ацетализация
Ацетилирования является обратимой реакцией для преобразования карбонильного соединения и два спиртов (или диол) в ацетали . Эта реакция фактически защищает карбонильную группу или спирт.
Реакция
Условия и положения
- Нагреватель
- Кислотный катализ (обычно APTS или безводный HCl )
Характеристики и примечания
Эта реакция обычно направлена против кеталя (в отличие от ацеталей). Если мы хотим продвинуть его в направлении его образования, мы используем избыток спирта (который одновременно служит растворителем). Также необходимо отгонять воду (гетероазеотропная перегонка) с помощью аппарата Дина и Старка. Чтобы вызвать обратную реакцию, все наоборот: мы добавляем избыток воды, чтобы гидролизовать кеталь.
Когда мы хотим защитить карбонильную функцию, мы обычно используем диол, такой как этан-1,2-диол :
Эта реакция также может очень хорошо служить для защиты функции алкоголя, в частности, вицинальных диолов .
- В некоторых случаях реакция может прекратиться на полуацетале (в случае циклических полуацеталей).
Действие реактива Гриньяра
Реактив Гриньяра реагирует с кетоном с образованием третичного алкогол . Углерод, несущий магнийорганический , добавляется к углероду, несущему карбонильную группу. В водной среде алкоголят, сильное основание, получает протон с образованием спирта.
Реакция Виттига
Реакция Виттига превращает кетон в производное этилена. Фактически это превращает связь C = O в связь C = C.
Реакция Шапиро
Снижение кетонов
В спиртах
Промышленно
Используется дигидроген H 2 в инертном растворителе в присутствии катализатора ( гетерогенный катализ ). Очень часто это металлы, такие как платина (Pt), палладий (Pd), никель (Ni) или родий (Rh).
Если кетон также имеет связь C = C, он также гидрируется (реакция легче на C = C, чем на C = O). Чтобы избежать этого, необходимо проводить нуклеофильное добавление гидридов. Реакция экзотермическая .
По гидридам
См. Нуклеофильное добавление гидридов (ниже).
В алкане
Нуклеофильные добавки
из гидрида (LiAlH 4 , NaBH 4 )
Добавление гидридов позволяет восстанавливать кислород карбонильной группы без изменения двойной связи ( алкеновой части ) молекулы по сравнению с простым добавлением водорода.
Кетон, также несущий алкен, при обработке гидридом дает алкоголят, который несет алкен. Этот алкоголят, обработанный слабой кислотой (например, водой), затем превращается в спирт, который несет алкен.
Альдегиды - летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
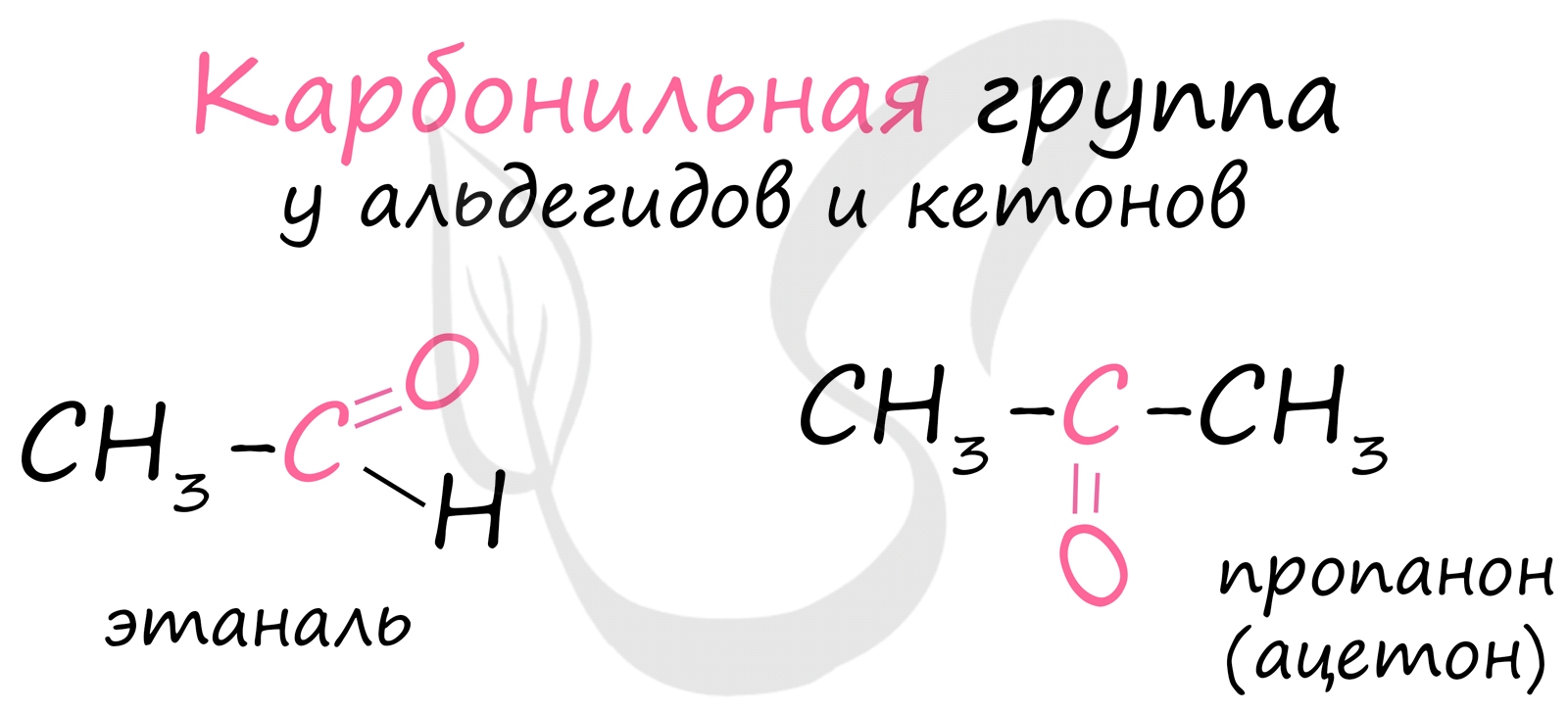
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

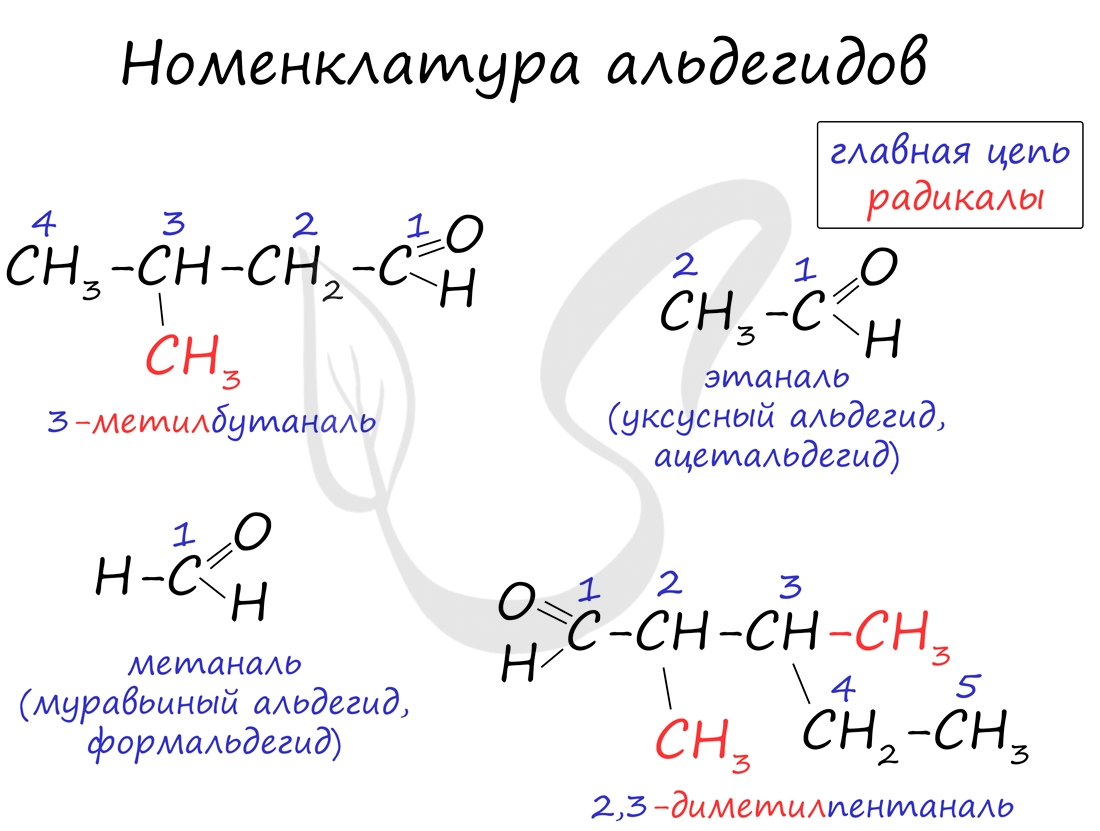
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса "аль" к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот - HO. Например: метаналь - HCHO, этаналь - CH3CHO, пропаналь - C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь - формальдегид, этаналь - ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
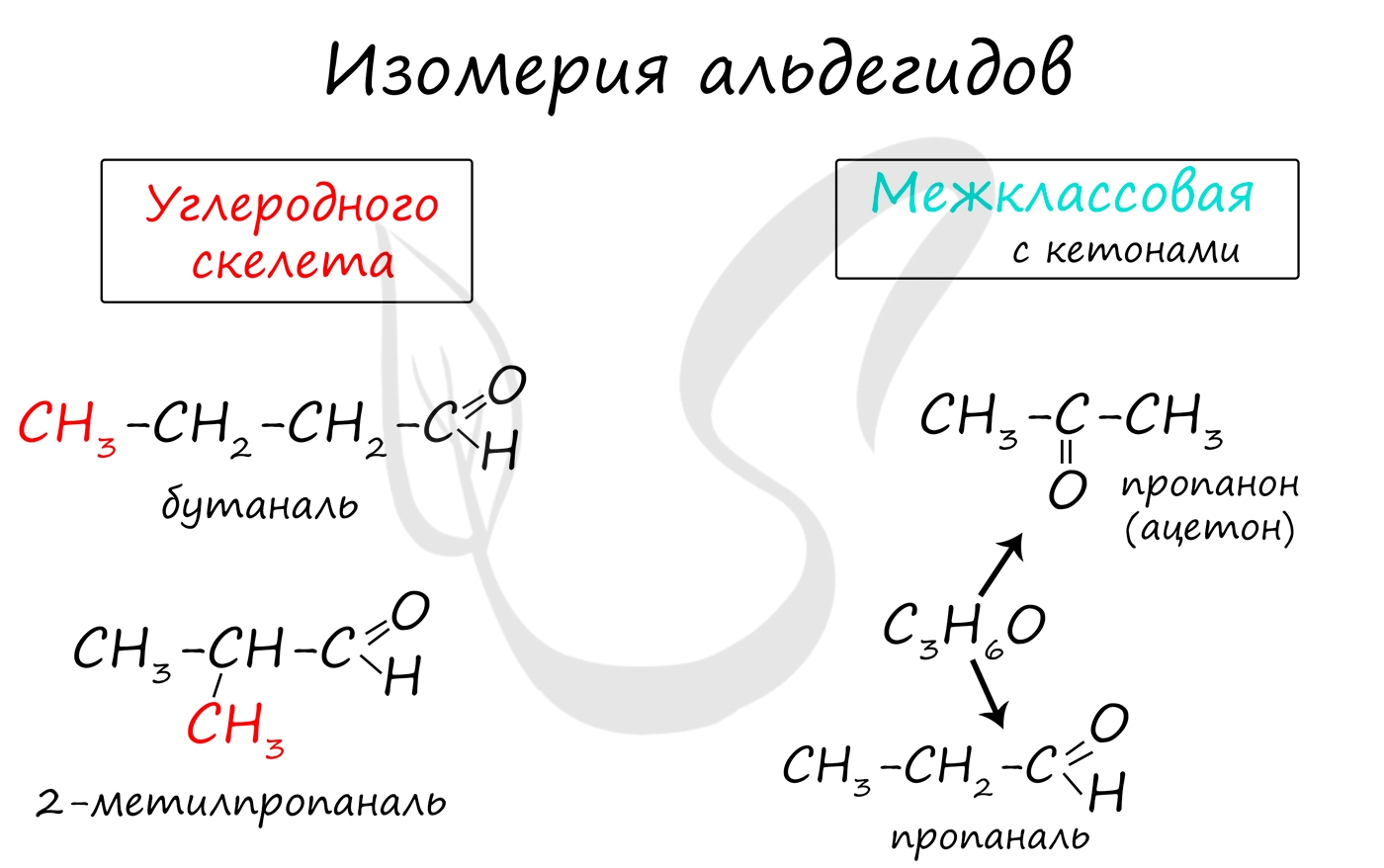
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
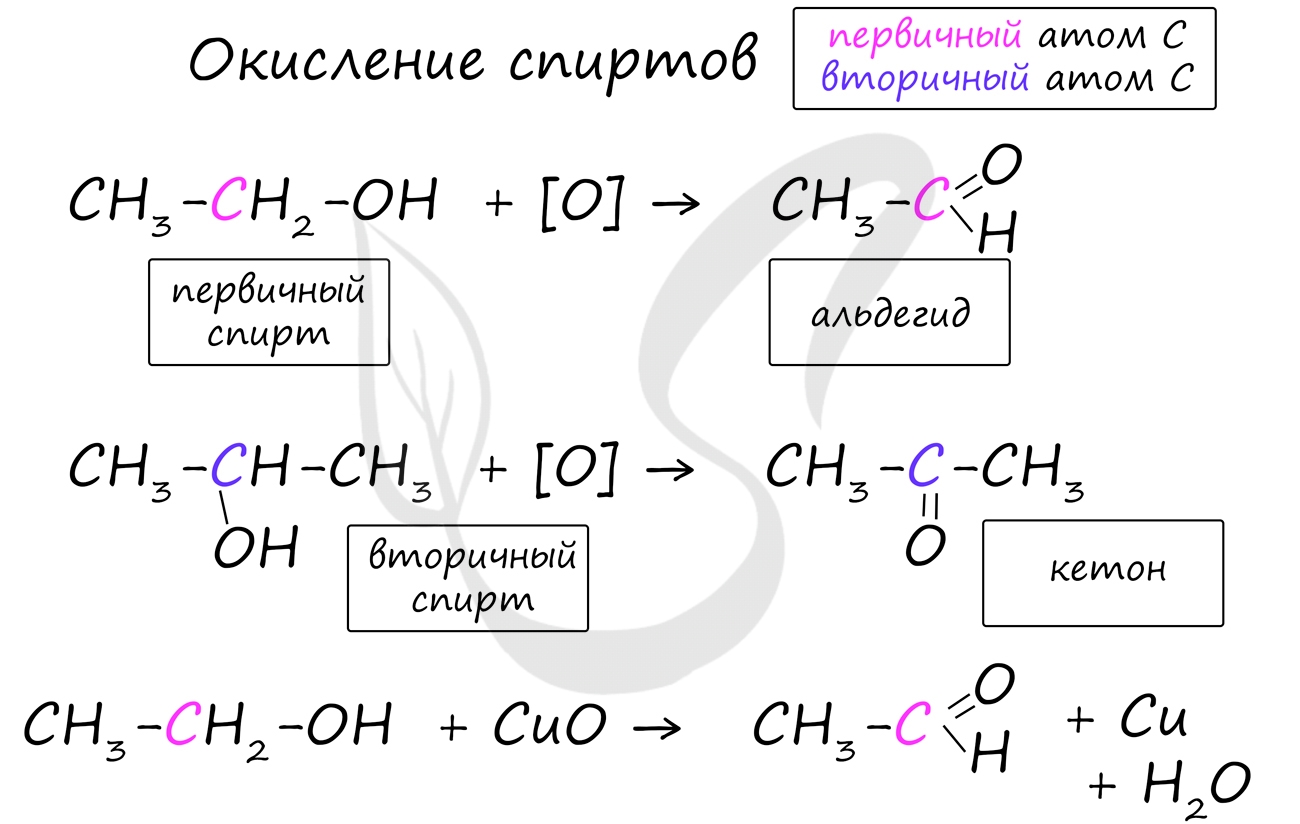
Получение альдегидов и кетонов
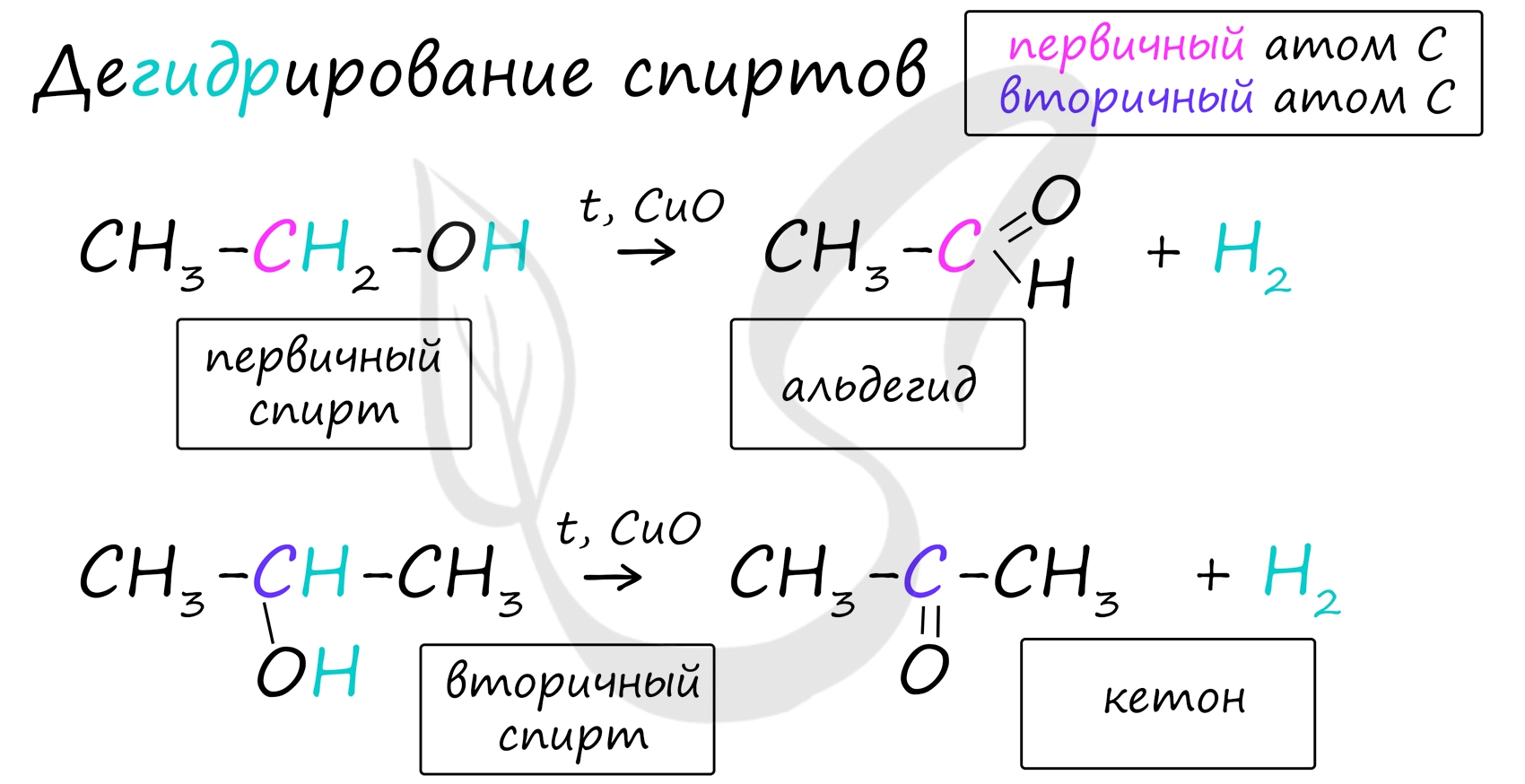
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов - кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
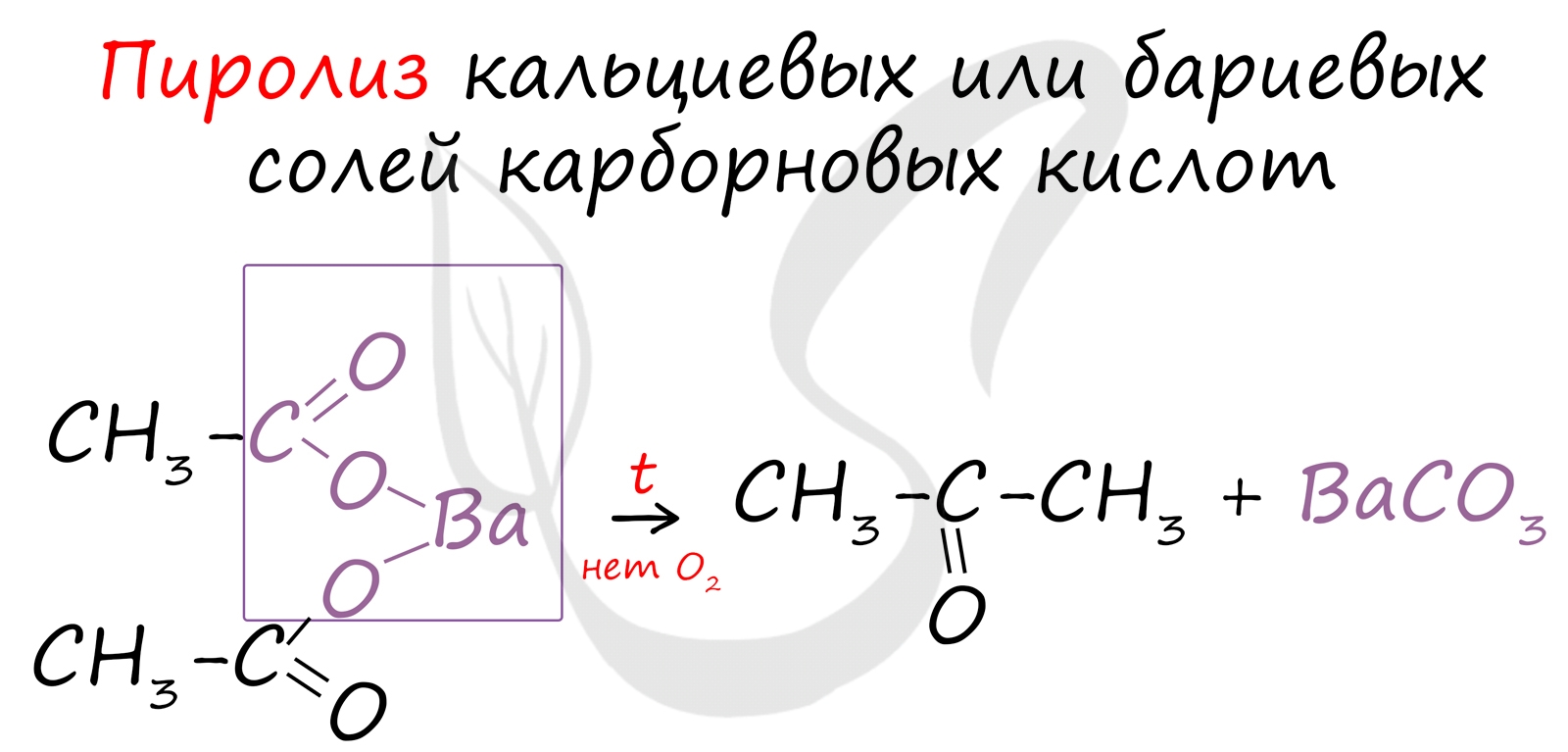
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
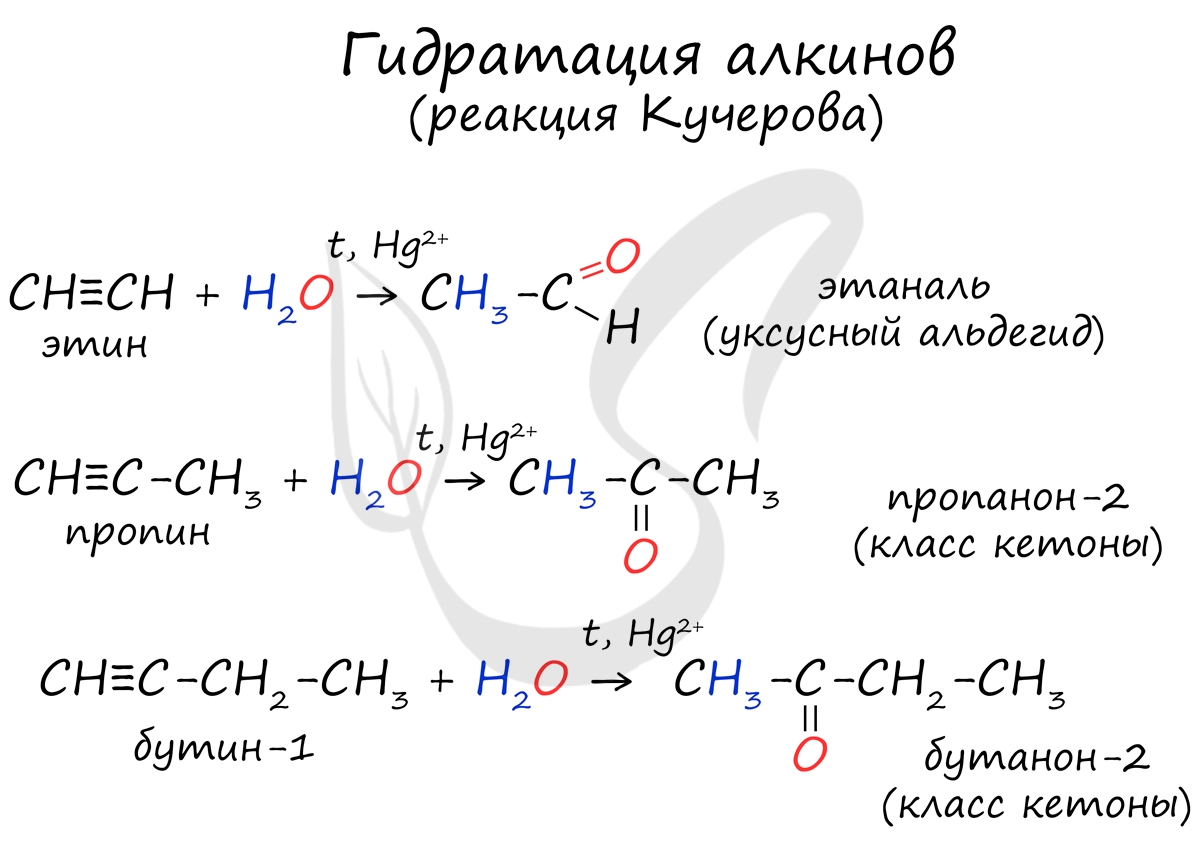
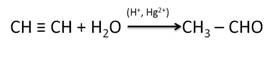
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
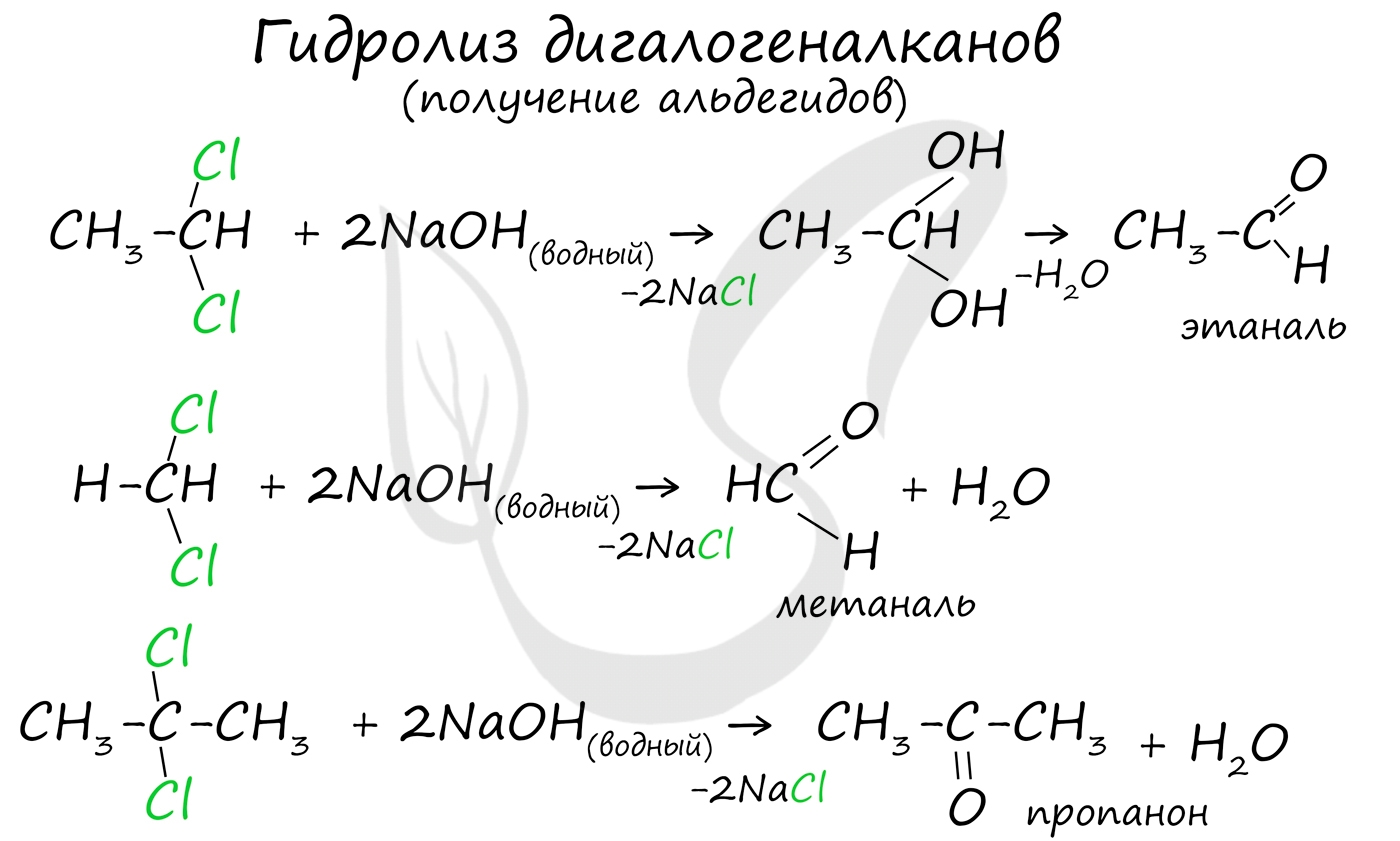
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов - у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
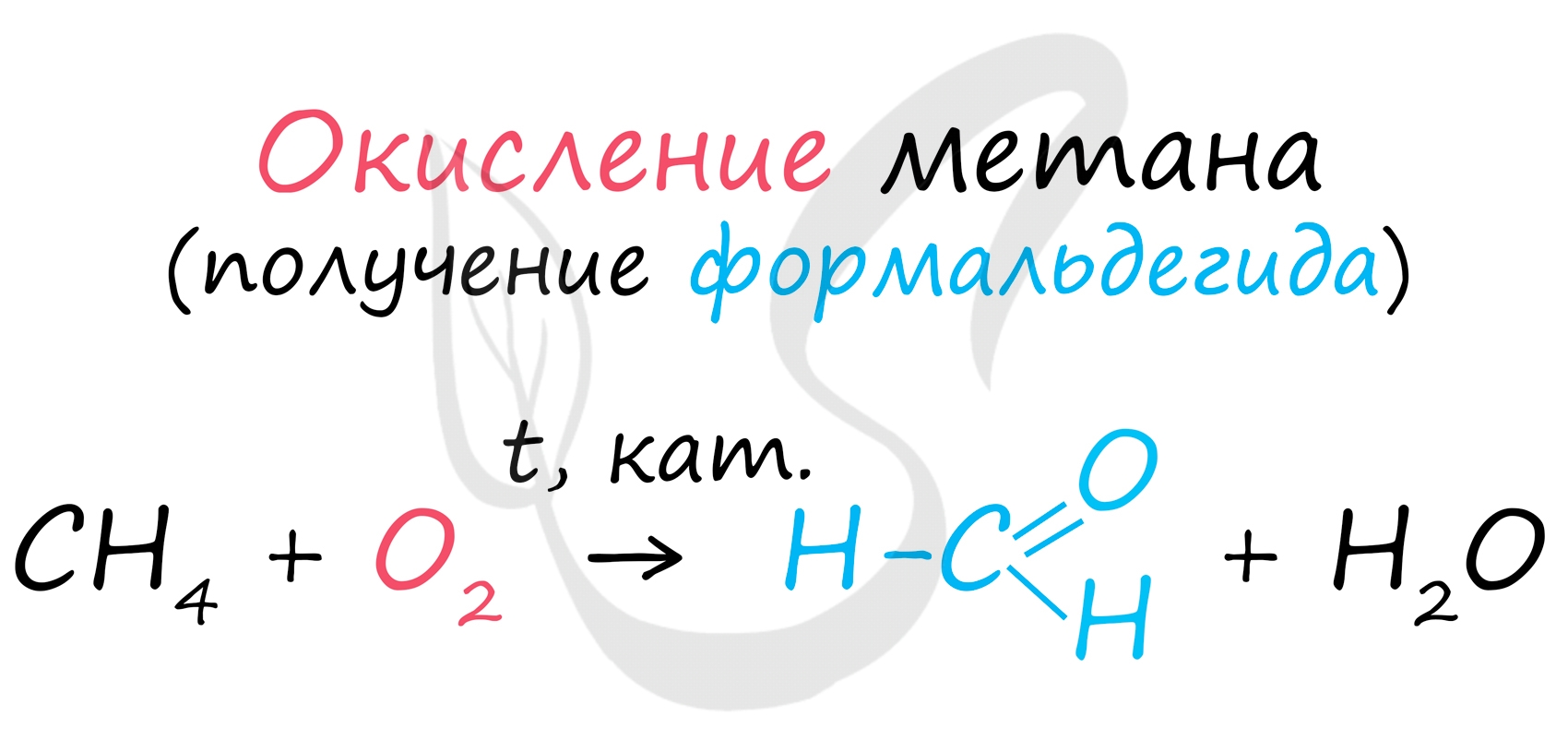
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.

Химические свойства альдегидов и кетонов
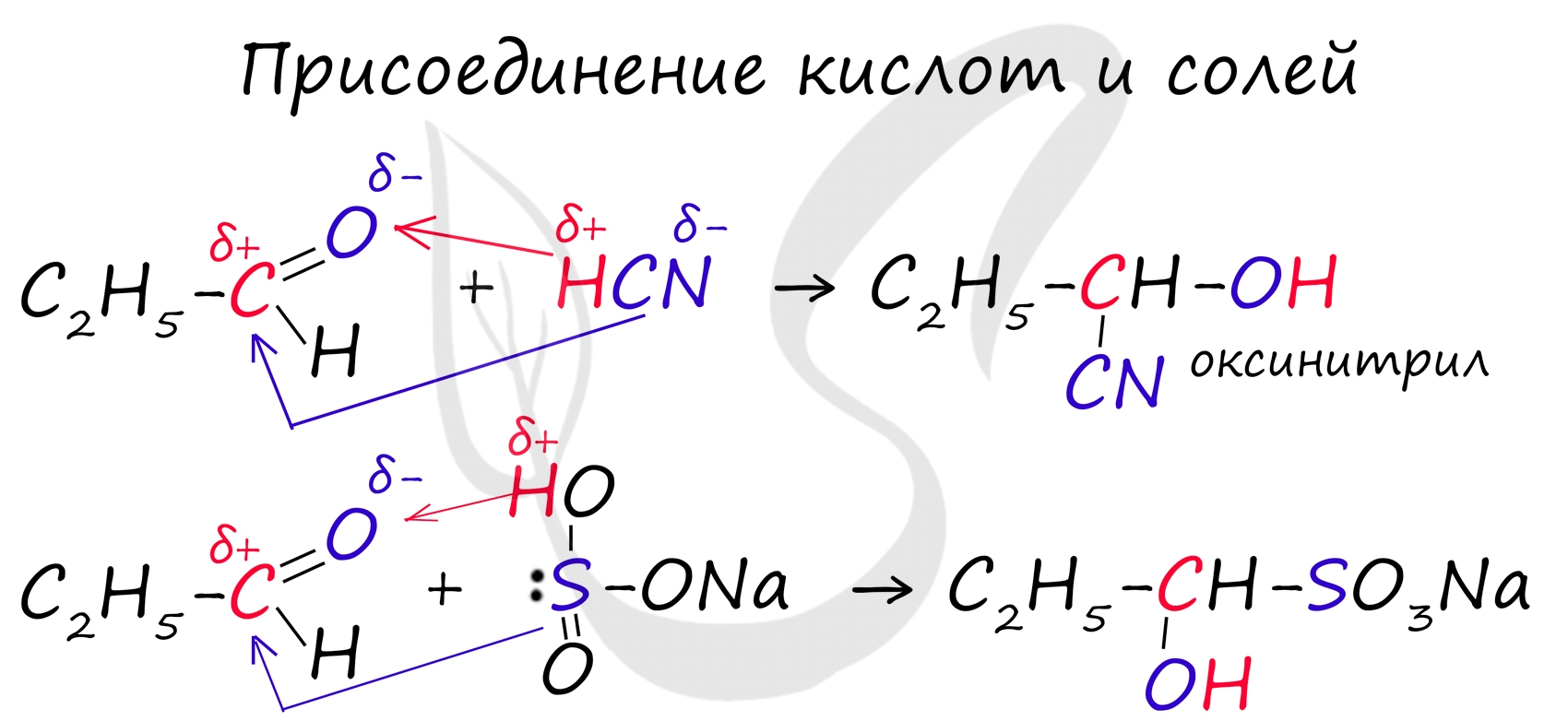
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
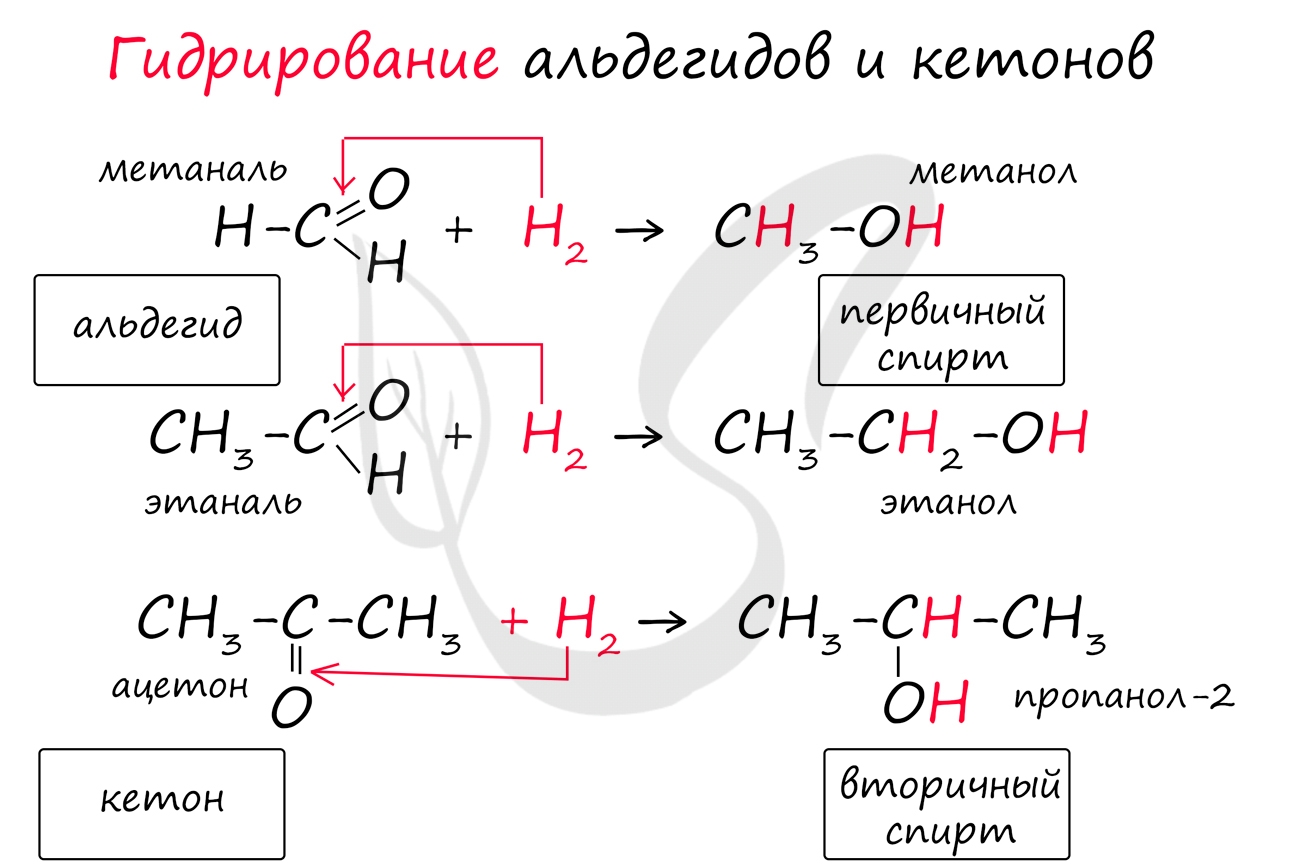
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов - вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
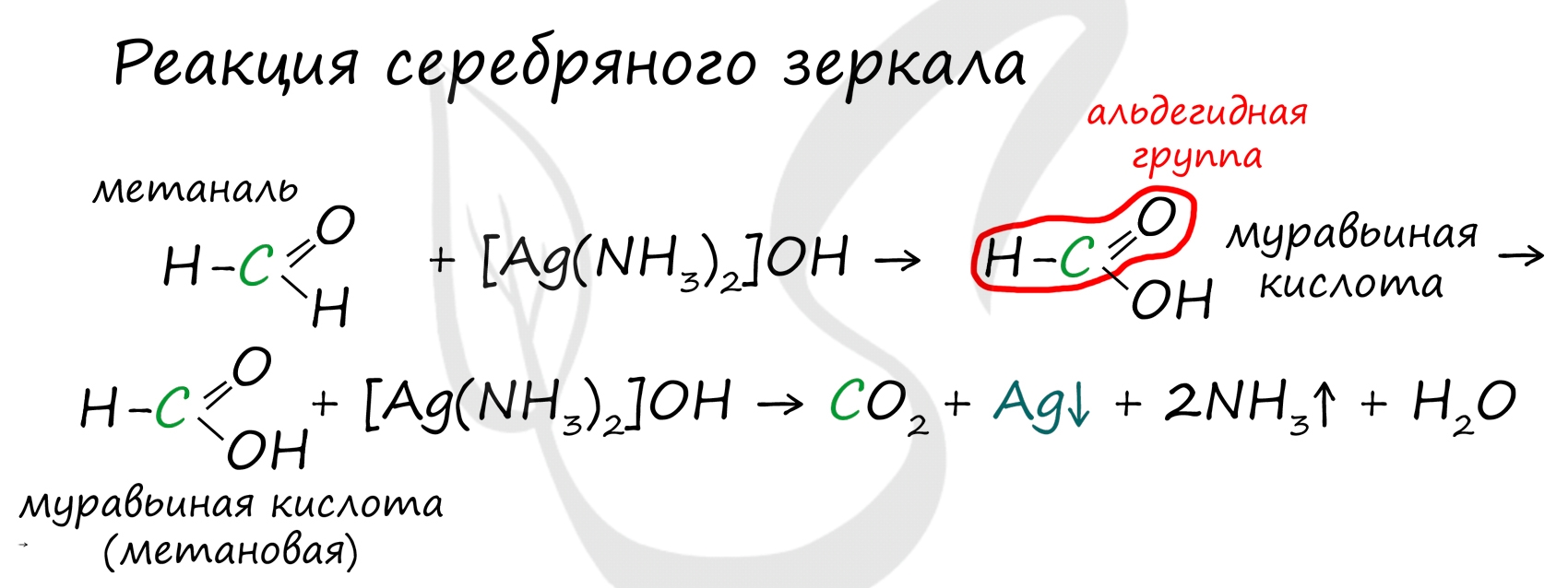
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом - наличием альдегидной группы у муравьиной кислоты.
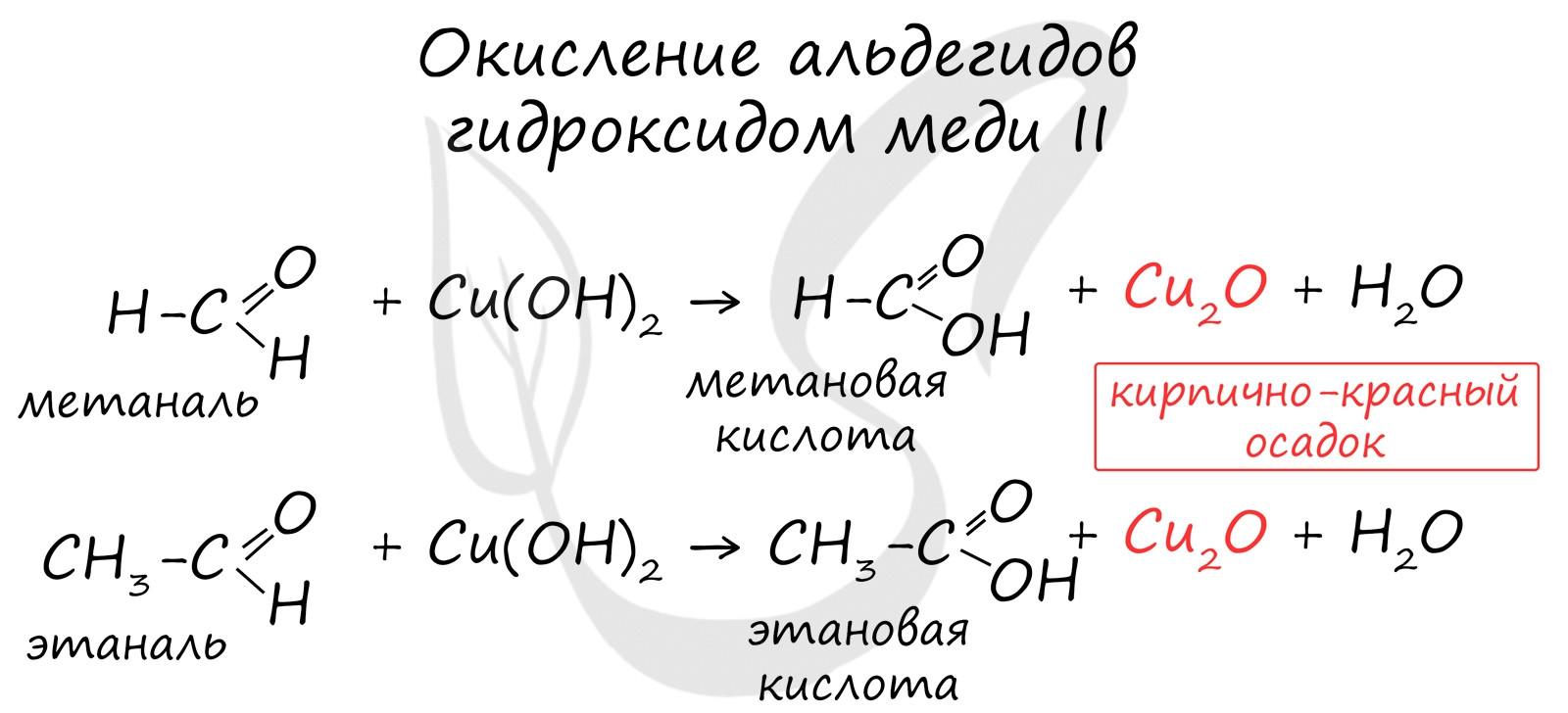
Окисление также возможно другим реагентом - гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Присутствие кетоновых тел в моче называется кетонурией. Это ненормальное явление, так как причиной присутствия кетонов в моче является, прежде всего, диабет типа 1. Другие причины включают голодание, чрезмерную физическую нагрузку, алкоголизм и крайне низкое потребление углеводов.
Достаточно высокая концентрация кетоновых тел в моче означает, что организм для получения энергии использует жиры, а не глюкозу.
Что такое кетоновые тела?
Это соединения, которые возникают в результате биохимических изменений в жирах. Кетоновые тела образуются в печени, откуда они попадают в кровь. У здорового человека норма кетоновых тел в крови не должна превышать 0,2 ммоль / л.

Механизм образования кетоновых тел
Глюкоза является основным энергетическим материалом для клеток, но при ее недостатке энергия поступает из жиров. В моче и крови человека присутствуют 3 кетоновых тела: B-гидрокси-масляная кислота, ацетоуксусная кислота, ацетон.
Кетоны в моче — обратите внимание
Состояние, при котором кетоновые тела присутствуют в моче, называется кетонурия. Если в моче обнаружены кетоновые тела, это означает, что организм использует жиры для получения энергии. Может быть много причин, вызывающих кетонурию, наряду с сопутствующими симптомами.
Симптомы возникают, когда организм не в состоянии утилизировать углеводы. что приводит к сжиганию жира у пациентов с диабетом. У пациентов без диабета причиной кетонурии может быть недостаток углеводов. Главное, определить причину кетонов в моче как можно скорее и начать соответствующее лечение. Значение имеет каждый день задержки.
Симптомы, которые могут сопровождать кетонурию
Если есть кетоны в моче или симптомы, которые могут быть связаны с наличием кетонов в моче, следует немедленно обратиться к эндокринологу. Симптомы появляются при уже прогрессирующей кетонурии.
Признаки, которые могут указывать на наличие кетоновых тел:
- характерный — фруктовый запах изо рта — за него отвечает ацетон, который присутствует в выдыхаемом воздухе (это наиболее характерный симптом кетонурии );
- высокий уровень глюкозы в крови, превышающий 300 мг / дл;
- изменился цвет кожи, покраснение или наоборот — бледный цвет;
- желудочно-кишечные симптомы — диарея, рвота, боль в животе;
- частые инфекции;
- хроническая усталость;
- сухость во рту и усиление жажды;
- полиурия.
Исследование мочевых кетоновых тел
Кетоновые тела могут быть обнаружены с помощью стрип-тестирования анализа мочи. Сдавать нужно утреннюю мочу среднего потока, когда первая порция мочи поступает в туалет, средняя часть — в специально подготовленный стерильный контейнер, а последняя — снова в туалет.

Тестирование анализа мочи
Прежде чем собирать мочу, нужно помыться. В течение периода, предшествующего общему анализу мочи, не меняйте свою диету и не выполняйте слишком много упражнений.
Нормальный результат теста тела мочи на кетоны отрицательный. Если в моче обнаруживаются кетоновые тела, лечение должно быть начато немедленно.
Причины кетоновых тел в моче
- Диабет, чаще всего диабет 1 типа . Тело диабетика не справляется с сжиганием углеводов. Причина этого — дефицит инсулина, связи с чем жировые запасы мобилизуются для получения энергии. В результате этих изменений образуются кетоновые тела. Избыток кетонов накапливается в крови, и это состояние называется кетонемией. Организм, страдающий диабетом, желая избавиться от лишних кетонов, выделяет их вместе с мочой, а также с выдыхаемым воздухом. Чаще всего кетоновые тела в моче сопровождаются гипергликемией , то есть высоким уровнем глюкозы в крови, а также наличием глюкозы в моче (глюкозурия). Избыток кетоновых тел в организме приводит к развитию кетоацидоза. Это опасное для жизни состояние. Факторы, предрасполагающие к кетоацидозу, включают: неправильное использование инсулина, внезапное прекращение инсулиновой терапии, хронические инфекции, опасные для жизни состояния: инсульт, инфаркт, панкреатит.
- Низкоуглеводная диета . При длительном голодании кетоновые тела образуются в процессе чрезмерного B-окисления жиров.
- Хронический алкоголизм.
- Другие причины — временно в случае сильной рвоты, хронической лихорадки, чрезмерных физических нагрузок.
Определив причину присутствия кетоновых тел в моче, врач начнет соответствующее лечение.
Кетоны в моче — норма ацетона в моче и интерпретация результата
Нормой кетонов в моче является отсутствие кетоновых тел. Любой положительный результат (кет в моче положительный) означает проблему в организме и требует дальнейшей диагностики. Следы кетонов в моче или их низкие уровни, например кетоны в моче 5 или кетоны в моче 15 мг / дл, могут указывать на:
- интенсивные физические усилия;
- недостаток калорий в рационе;
- рвоту;
- лихорадку;
- ожоги;
- потребление алкоголя.


Чаще всего умеренная кетонурия возникает без симптомов, которые могут указывать на диабет или кетоацидоз.
Слишком высокое содержание кетонов в моче, т. е. результат теста, указывающий на содержание кетонов в моче 50 мг/дл и более, может говорить о более серьезных нарушениях здоровья, таких как заболевания с тяжелым истощающим течением, заболевания щитовидной железы или почечная глюкозурия. Высокие кетоны в моче также сопровождают декомпенсированный или недиагностированный и нелеченный диабет.
Кетоны в моче ребенка — причины
Ацетон в моче у детей чаще всего сопровождается рвотой или лихорадкой. Иногда это признак недоедания или недостаточности надпочечников — тогда высокий уровень кетоновых тел у детей в моче сопровождается гипогликемией, то есть низким уровнем глюкозы в крови. Напротив, кетоны в моче при низком уровне глюкозы при увеличении печени могут указывать на наличие гликогеноза.
Кетоновые тела и глюкоза в моче ребенка могут указывать на диабет; В молодом возрасте наиболее распространен диабет типа 1. Для определения наличия кетонов у ребенка необходимо сначала определить уровень глюкозы в крови натощак. Дальнейшая диагностика зависит от результата глюкозы.
Кетоновые тела в моче во время беременности — что они показывают?
Кетоны в моче во время беременности не редкость. Женщины, которые страдают от частой рвоты в первом триместре беременности, показывают наличие кетонов очень часто. Кроме того, привести к увеличению кетоновых тел в крови и моче может отсутствие аппетита при беременности или пропуск вечернего приема пищи за день до анализов мочи.
Так как высокое содержание ацетона в моче беременной женщины может указывать на гестационный диабет, состояние всегда требует дальнейшей диагностики. Тогда помимо кетонов в моче беременной женщины также может наблюдаться глюкоза, кроме того, могут быть симптомы кетоацидоза.
Следы кетонов в моче — лечение
Кетонурия — это не болезнь, а симптом болезни, поэтому ее невозможно вылечить. Чтобы восстановить уровень кетонов в моче до нормы, необходимо устранить или вылечить основное заболевание. Необходимо компенсировать нарушения кислотно-основного и водно-электролитного обмена. Это особенно важно в случае диабета, осложнением которого может быть кетоновая кома.
Чтобы избавиться от кетонов в моче при диабете, необходимо нормализовать уровень глюкозы и инсулина в крови. В случае кетонурии, вызванной недоеданием, необходимо изменить рацион питания на высококалорийный и обеспечить адекватный калорийный баланс. Во время рвоты назначаются противорвотные препараты.

В этом видеоуроке собран материал по основным физическим и химическим свойствам альдегидов и кетонов, способам получения отдельных представителей класса.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Альдегиды и кетоны: свойства и получение"
Рассмотрим физические свойства альдегидов. При обычных условиях метаналь находится в газообразном состоянии, имеет резкий неприятный запах и ядовит. Остальные альдегиды – жидкости и твёрдые вещества. Низшие альдегиды, как правило, имеют неприятный и резкий запах, высшие альдегиды обладают цветочным запахом.
Температуры кипения альдегидов ниже, чем у спиртов с таким же числом атомов углерода, так как в них отсутствуют межмолекулярные водородные связи.
Простейшие альдегиды хорошо растворяются в воде. Например, уксусный альдегид неограниченно растворим в воде, формальдегид достаточно хорошо растворим в воде. Формалин – это 40 %-ный раствор формальдегида.
Химические свойства альдегидов и кетонов обусловлены строением карбонильной группы. Из-за того, что в карбонильной группе у атома кислорода частичный отрицательный заряд, а у атома углерода – частичный положительный, для альдегидов характерны реакции присоединения.
Для альдегидов и кетонов характерны реакции присоединения водорода. При этом образуются спирты. Так, в реакции этаналя с водородом в присутствии никелевого или платинового катализатора, образуется этанол. Гидрирование альдегидов и кетонов относят к реакциям восстановления.

Кроме этого, альдегиды легко окисляются до соответствующих карбоновых кислот. Если к аммиачному раствору оксида серебра (I) прилить раствор уксусного альдегида и смесь нагреть, то образуется уксусная кислота и внутренняя поверхность пробирки покрывается тонким слоем серебра.

Ещё одной качественной реакцией на альдегиды является реакция со свежеприготовленным гидроксидом меди (II). Так, при окислении уксусного альдегида гидроксидом меди (II) образуется уксусная кислота и осадок красного цвета, представляющий собой оксид меди (I).

Окислить альдегиды можно также K2Cr2O7, KMnO4 или кислородом воздуха в присутствии катализатора. При этом также образуются карбоновые кислоты. Например, при окислении пропионового альдегида кислородом воздуха в присутствии катализатора образуется пропановая кислота.

В промышленных масштабах альдегиды получают из нефти, галогенпроизводных и спиртов.
В лаборатории альдегиды и кетоны получают окислением спиртов. Так, при окислении этанола оксидом меди (II) образуется уксусный альдегид.

При окислении пропанола-2 в тех же условиях образуется ацетон, который является кетоном.

Альдегиды и кетоны можно получить гидратацией алкинов. Так, гидратацией ацетилена в условиях реакции Кучерова образуется уксусный альдегид.
В результате присоединения воды к пропину образуется кетон – ацетон.

Одним из промышленных способов получения альдегидов является окисление алкенов в присутствии солей палладия.

Альдегиды можно получить и в реакции с алкенами – оксосинтез. Так, в реакции этилена с синтез-газом в определённых условиях образуется пропаналь.

Альдегиды и кетоны можно получить в реакции гидролиза дигалогензамещённых алканов. Например, в реакции 1,1-дихлорэтана с водным раствором щёлочи образуется этаналь, в реакции 2,2-дихлорпропана с водным раствором щёлочи образуется ацетон.

Альдегиды и кетоны получают дегидрированием спиртов в присутствии катализатора меди. Так, при дегидрировании первичного спирта этанола образуется этаналь, при дегидрировании вторичного спирта пропанола-2 образуется кетон – ацетон.

Таким образом, реакционная способность альдегидов и кетонов обусловлена строением карбонильной группы. Для альдегидов и кетонов характерны реакции присоединения по месту двойной связи С = О, для альдегидов характерны реакции окисления по месту связи С – Н в альдегидной группе. К основным промышленным способам получения альдегидов и кетонов относятся: окисление спиртов и дегидрирование спиртов.
Читайте также:

