Как сделать изомеры алкинов начиная с c5h7
Обновлено: 07.07.2024
\u0421\u041d-\u0442\u0440\u043e\u0439\u043d\u0430\u044f \u0441\u0432\u044f\u0437\u044c-\u0421\u2013\u0421\u041d2\u2013\u0421\u041d2\u2013\u0421\u041d3 \u2014 \u043f\u0435\u043d\u0442\u0438\u043d-1
\u0421\u041d3\u2013\u0421-\u0442\u0440\u043e\u0439\u043d\u0430\u044f \u0441\u0432\u044f\u0437\u044c-\u0421\u2013\u0421\u041d2\u2013\u0421\u041d3 \u2014 \u043f\u0435\u043d\u0442\u0438\u043d-2
\u0421\u041d-\u0442\u0440\u043e\u0439\u043d\u0430\u044f \u0441\u0432\u044f\u0437\u044c-\u0421\u2013\u0421\u041d(\u0421\u041d3)\u2013\u0421\u041d3 \u2014 3-\u043c\u0435\u0442\u0438\u043b\u0431\u0443\u0442\u0438\u043d-1 (\u0442\u043e, \u0447\u0442\u043e \u0432 \u0441\u043a\u043e\u0431\u043a\u0430\u0445, \u2014 \u0440\u0430\u0437\u0432\u0435\u0442\u0432\u043b\u0435\u043d\u0438\u0435)
\u0410\u043b\u043a\u0430\u0434\u0438\u0435\u043d\u044b:
\u0421\u041d2=\u0421=\u0421\u041d\u2013\u0421\u041d2\u2013\u0421\u041d3 \u2014 \u043f\u0435\u043d\u0442\u0430\u0434\u0438\u0435\u043d-1,2
\u0421\u041d2=\u0421\u041d\u2013\u0421\u041d2\u2013\u0421\u041d=\u0421\u041d2 \u2014 \u043f\u0435\u043d\u0442\u0430\u0434\u0438\u0435\u043d-1,4
\u0421\u041d2=\u0421\u041d\u2013\u0421\u041d=\u0421\u041d\u2013\u0421\u041d3 \u2014 \u043f\u0435\u043d\u0442\u0430\u0434\u0438\u0435\u043d-1,3
\u0421\u041d3\u2013\u0421\u041d=\u0421=\u0421\u041d\u2013\u0421\u041d3 \u2014 \u043f\u0435\u043d\u0442\u0430\u0434\u0438\u0435\u043d-2,3
\u0421\u041d2=\u0421=\u0421(\u0421\u041d3)\u2013\u0421\u041d3 \u2014 3-\u043c\u0435\u0442\u0438\u043b\u0431\u0443\u0442\u0430\u0434\u0438\u0435\u043d-1,2
\u0421\u041d2=\u0421(\u0421\u041d3)\u2013\u0421\u041d=\u0421\u041d2 \u2014 2-\u043c\u0435\u0442\u0438\u043b\u0431\u0443\u0442\u0430\u0434\u0438\u0435\u043d-1,3">]" data-testid="answer_box_list">

Алкины:
СН-тройная связь-С–СН2–СН2–СН3 — пентин-1
СН3–С-тройная связь-С–СН2–СН3 — пентин-2
СН-тройная связь-С–СН(СН3)–СН3 — 3-метилбутин-1 (то, что в скобках, — разветвление)
Алкадиены:
СН2=С=СН–СН2–СН3 — пентадиен-1,2
СН2=СН–СН2–СН=СН2 — пентадиен-1,4
СН2=СН–СН=СН–СН3 — пентадиен-1,3
СН3–СН=С=СН–СН3 — пентадиен-2,3
СН2=С=С(СН3)–СН3 — 3-метилбутадиен-1,2
СН2=С(СН3)–СН=СН2 — 2-метилбутадиен-1,3
Новые вопросы в Химия
Вычислите массу и количество кислорода, прореагировавшего с медью, если образовалось 5г оксида меди.
1. По известному практическому объёму или массе, найдите теоретический объём или массу (используя долю выхода продукта) m теор. = mпракт. / n Vтеор.= … Vпракт. / n 2. Найдите теоретическое количество вещества для продукта. 3. Найдите теоретическое количество вещества, согласно коэффициентам. 4. С помощью теоретического количества вещества найдите массу или объём исходных веществ в реакции.
1. Зазначте період, в якому немає металічних елементів: А) 3 ; Б) 1 ; В) 5 ; Г) 7 . 2. Вкажіть правильне твердження. … У хімічних реакціях метали … А) є тільки окисниками; В) є тільки відновниками; Б) виявляють хімічну інертність; Г) можуть бути окисниками або відновниками. 3. Зазначте групу, в якій усі елементи належать до металічних: А) друга; Б) третя; В) четверта; Г) перша. 4. Вкажіть елемент з найбільш вираженими металічними властивостями: А) Літій; Б) Оксиген; В) Францій; Г) Берилій. 5. Зазначте метал, який за звичайних умов взаємодіє з водою: А) калій; Б) залізо; В) цинк; Г) свинець. 6. Вкажіть назву металу, який не витісняє водень з розбавленої сульфатної кислоти: А) залізо; Б) цинк; В) алюміній; Г) срібло. 7. Зазначте метал, який не взаємодіє з розбавленою хлоридною кислотою: А) Zn; Б) Al ; В) Нg ; Г) Fe . 8. Вкажіть метал, який вступить у реакцію з плюмбум нітратом: А) мідь; Б) цинк; В) калій; Г) срібло. 9. Вкажіть назву найменш активного металу: А) магній; Б) мідь; В) ртуть; Г) свинець. 10. Вкажіть правильне твердження. Корозія металів … А) забезпечує збереження цілісності поверхні металів; Б) усуває небажану хімічну активність будь-якого металу; В) забезпечує їх захист від руйнування; Г) спричиняє руйнування металів. 11. Зазначте спільну хімічну властивість металів: А) взаємодія з основними оксидами; В) взаємодія з азотом; Б) розчинність в кислотах; Г) розчинність в лугах. 12. Вкажіть назву групи металів, здатних витісняти водень з води: А) лужні й лужноземельні; В) підгрупа платини; Б) підгрупа феруму; Г) підгрупа купруму.
Что выделяется при реакции Al, Cr, Fe, Co, Be с конц. азотной и конц. серной кислотой при нагревании?

Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) - газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше - в органических растворителях.

Плохо растворимы в воде.
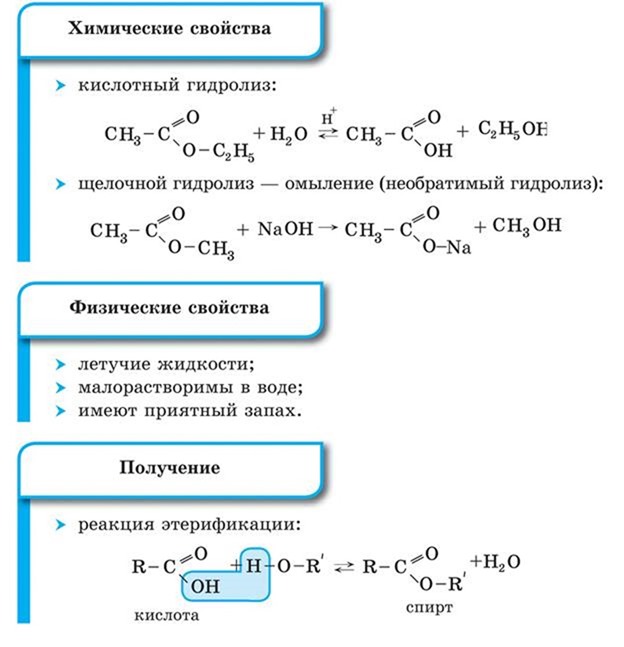
Химические свойства
Химические свойства алкинов определяются тройной связью, особенностями ее строения. Алкины способны вступать в реакции присоединения, замещения, полимеризации и окисления.
Будучи непредельными соединениями, алкины вступают в первую очередь в реакции присоединения. Эти реакции протекают ступенчато: с присоединением одной молекулы реагента тройная связь вначале переходит в двойную, а затем, по мере дальнейшего присоединения, - в одинарную.

Казалось бы, алкины, обладая двумя π-связями, гораздо активнее должны вступать в реакции электрофильного присоединения. Но это не совсем так. Углеродные атомы в молекулах алкинов расположены ближе друг к другу, чем в алкенах, и обладают большей электроотрицательностью. Это связано с тем, что электроотрицательность атома углерода зависит от его валентного состояния. Поэтому p-электроны, находясь ближе к ядрам углерода, проявляют несколько меньшую активность в реакциях электрофильного присоединения. Кроме того, сказывается, близость положительно заряженных ядер атомов, способных отталкивать приближающиеся электрофильные реагенты (катионы). В то же время алкины могут вступать в реакции нуклеофильиого присоединения (со спиртами, аммиаком и др.).
Реакция протекает в тех же условиях, что и в случае алкенов (катализаторы Pt, Pd, Ni). При восстановлении алкинов вначале образуются алкены, а затем - алканы:
ацетилен → этилен → этан
Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также проходит ступенчато:
ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
Качественная реакция; бромная вода обесцвечивается.
Реакции присоединения галогеноводородов, как и галогенов, идут в основном по механизму электрофильного присоединения:
HC ≡ CH + HCl → H2C = CHCl → H3C - CHCl2
ацетилен → хлорэтен → 1,1-дихлорэтан
Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
Образуется ацетальдегид в случае С2Н2 и кетоны - в случае гомологов ацетилена.
Катализатор - соль ртути: HgSO4

HC ≡ CH + HCN кат. → H2C = CH - CN (акрилонитрил)
Акрилонитрил - ценный продукт. Он используется в качестве мономера для получения синтетического волокна - нитрон.
В результате этой реакции образуются простые виниловые эфиры (реакция А. Е.Фаворского):
Присоединение спиртов в присутствии алкоголятов - типичная реакция нуклеофильного присоединения.
Водородные атомы в ацетилене способны замещаться на металлы (реакция металлирования). В результате образуются металлические производные ацетилена - ацетилениды. Такую способность ацетилена можно объяснить следующим образом. Углеродные атомы ацетилена, находясь в состоянии sp-гибридизации, отличаются, как известно, повышенной электроотрицательностью (по сравнению с углеродами в других гибридных состояниях). Поэтому электронная плотность связи С-H несколько смещена в сторону углерода и атом водорода приобретает некоторую подвижность:
Образуются нерастворимые соли - ацетилениды. Возможны только для алкинов, содержащих этинильную группу -С=СН (т. н. терминальные алкины).
HC ≡ CH + 2CuCl → Cu - C ≡ C - Cu↓ + HCl
этин → ацетиленид меди(I) двузамещенный
CH3 - C ≡ CH + CuCl → CH3 - C ≡ C- Cu↓ + HCl
пропин → метилацетиленид меди (I)
Образование темно-красных осадков ацетиленидов меди - качественная реакция на этинильную группу, позволяющая отличить терминальные алкины от других непредельных углеводородов.


С ацетиленидами в сухом виде следует обращаться очень осторожно: они крайне взрывоопасны.
Ацетиленовые углеводороды, как алканы и алкены, способны к изомеризации с перемещением тройной связи:

Из винилацетилена присоединением HCl получают хлоропрен, при полимеризации которого образуется хлоропреновый каучук:



Полимеризация для алкинов малохарактерна.

Ацетилены легко окисляются. При этом происходит разрыв молекулы по месту тройной связи. Если ацетилен пропускать через окислитель (водный раствор перманганата калия), то раствор быстро обесцвечивается.
Эта реакция является качественной на кратные (двойные и тройные) связи:
Ацетилен горит коптящим пламенем.
При полном сгорании ацетилена на воздухе образуются два продукта оксид углерода (IV) и вода:
При неполном сгорании образуется углерод (сажа):
Способы получения
Ацетилен в промышленности и в лаборатории можно получать следующими способами:
Разложением водой карбида кальция СаС2, который получают спеканием негашеной извести СаО с коксом:
СаО + 3C 2500°C → CaC2 + CO
Из дигапогеналканов, содержащих атомы галогена у двух соседних атомов углерода, например:

Из дигалогеналканов, содержащих два атома галогена у одного атома углерода, например:

Качественные реакции
Качественной реакцией на алкины с концевой тройной связью является взаимодействие с аммиакатом серебра или меди.
Для подтверждения наличия тройной связи в соединении используют методы спектроскопии.
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. Его применяют:
- для сварки и резки металлов;

- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды;
- в производстве взрывчатых веществ
(соли ацетилена и его производных, в котором один или два атома водорода замещены атомами элементов, более электроположительных, чем углерод;
Ацетилениды тяжелых металлов обладают значительной химической неустойчивостью, при незначительных внешних воздействиях (удар, трение) разлагаются со взрывом. Наиболее известны как инициирующие взрывчатые вещества (ВВ) ацетилениды серебра Ag2C2 и меди Cu2C2. Также следует отметить сильнейшие взрывчатые способности ацетеленида ртути. Очень сильными взрывчатыми свойствами обладает ацетеленид золота.
- для получения уксусной кислоты, этилового спирта;
- для получения растворителей - индивидуальное химическое соединение или их смесь, способная растворять различные вещества, то есть образовывать с ними однородные системы переменного состава двух или большего числа компонентов;

- для получения пластических масс - органические материалы, основой которых являются синтетические или природные высокомолекулярные соединения (полимеры). Исключительно широкое применение получили пластмассы на основе синтетических полимеров.

- для получения каучука - натуральные или синтетические эластомеры, характеризующиеся эластичностью, водонепроницаемостью и электроизоляционными свойствами, из которых путём вулканизации получают резины и эбониты.

Нахождение в природе и физиологическая роль алкинов
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения содержащие полиацетиленовые структуры.
Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги.
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле СnН2n-2.
Атомы углерода, между которыми образована тройная связь, находятся в состоянии sр-гибридизации (рис. 15). Это означает, что в гибридизации участвует одна s- и одна р-орби-таль, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию Þ-связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуются две л-связи. Таким образом, тройная связь состоит из одной а- и двух л-связей.

Все гибридные орбитали атомов, между которыми образована двойная связь, а также заместители при них (в случае этина — атомы водорода) лежат на одной прямой, а плоскости связей перпендикулярны друг другу.
Тройная углерод-углеродная связь с длиной 0,120 нм короче двойной, энергия тройной связи больше, т. е. она является более прочной.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
С2Н2 — этин, С3Н4 — пропин, С4Н6 — бутин, С5Н8 — пентин, С6Н10 — гексин и т. д.
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
Изомерия углеродного скелета у алкинов возможна, начиная с пентина.
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис транс-) изомерия в случае алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Получение
1. Метановый способ. Нагревание метана до температуры 1500 °С приводит к образованию ацетилена. Эта реакция эндо-термична. При высокой температуре происходит смещение равновесия в сторону образования ацетилена:
Продукты (газовую смесь) необходимо быстро охладить, чтобы предотвратить разложение образовавшегося ацетилена.
2. Карбидный способ. Давно известным и достаточно удобным способом получения этина является гидролиз (обменное взаимодействие веществ с водой) некоторых карбидов, например гидролиз карбида кальция:
СаС2 + 2Н20 —> Са(ОН)2 + С2Н2
Карбид кальция получают взаимодействием оксида кальция, образовавшегося при обжиге (термическом разложении) карбоната кальция, с углем:
СаСО3 -> СаО + С02
СаО + ЗС —> СаС2 + СО
3. Способ дегидрогалогенирования. При воздействии на ди-бромпроизводное, в котором атомы галогенов находятся при соседних атомах углерода (или при одном и том же атоме), спиртового раствора щелочи происходит отщепление двух молекул галогеноводорода (дегидрогалогенирование) и образование тройной связи.
Физические свойства
Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства
Реакции присоединения
Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электро-фильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома).
2. Гидрогалогенирование (присоединение галогеноводорода).
Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
СН3—С=СН + НВr —> СН3—СВr =СН2
2-бромпропен
СН3—СВr=СН2 + НВr —> СН3—СВr2—СН3
2,2-дибромпропан
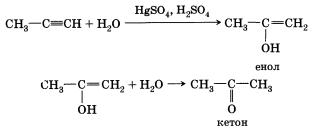
3. Гидратация (присоединение воды). Большое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова.
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов. Так как тройная связь содержит две реакционноспособные я-связи, алкины присоединяют водород в две ступени.
Тримеризация
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
Окисление алкинов
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
2С2Н2 + 502 —> 4С02 + 2Н20 + 2600 кДж
На этой реакции основано действие кислород-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более 3000 °С), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, так как содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия, при этом происходит разрушение кратной связи.
Механизм реакций электрофильного присоединения к алкинам
Давайте рассмотрим, почему бромоводород присоединяется к алкинам в соответствии с правилом Марковникова.
Предпочтительное присоединение катиона водорода (электро-фильной частицы) к более гидрированному атому углерода определяется большей устойчивостью катиона СН3 —> С+—СН2, стабилизированного положительным индуктивным эффектом метильной группы, по сравнению с карбокатионом СН3—СН=СН+, в котором донорное влияние метильной группы на углерод с положительным зарядом ослаблено.
Для того чтобы определить направление присоединения второй молекулы бромоводорода, надо сравнить устойчивость следующих карбокатионов:

Частица (а) оказывается более устойчивой, так как атом брома обладает положительным мезомерным эффектом (орбиталь с непо-деленной электронной парой брома перекрывается с незаполненной орбиталью атома углерода), который может проявиться только в том случае, если атом брома присоединен непосредственно к атому углерода, обладающему незаполненной орбиталью, т. е. несущему положительный заряд:
Гидратация (присоединение воды). Вода присоединяется к ацетилену в присутствии солей двухвалентной ртути в кислой среде с образованием непредельного спирта — енола.
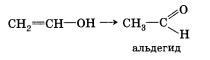
Получившийся енол немедленно превращается в альдегид:
Только при гидратации этина образуется альдегид. В случае алкинов с более длинной цепью в соответствии с правилом Марков-никова будет происходить образование енола с гидроксигруппой при менее гидрированном атоме углерода (водород присоединяется к крайнему атому углеродной цепи). Такие енолы превращаются в кетоны:
Димеризация
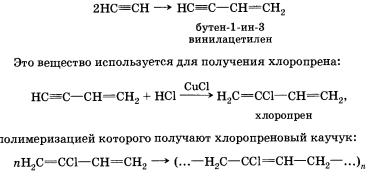
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен.
Взаимодействие с основаниями
При взаимодействии с сильными основаниями (например, амидом натрия) алкины, содержащие тройную связь на конце молекулы (т. е. атом водорода, присоединенный к атому углерода в sр-гибридизации), теряют катион водорода и образуют соли — ацетилениды:
НС=-СН + NаКН2 —> НС=-СNа + NH3
амид ацетиленид
натрия натрия
Таким образом, можно сказать, что алкины проявляют свойства кислоты.
Неподеленная электронная пара, находящаяся на гибридной орбитали атома углерода в состоянии ер-гибридизации, лучше удерживается ядром, чем в случае sр 3 -гибридизации, что приводит к более высокой кислотности алкинов.
Способность атома водорода, находящегося при тройной связи, замещаться на металл применяют для отделения алкинов с тройной связью на конце молекулы от всех остальных алкинов.
Смесь алкинов пропускают через аммиачный раствор оксида серебра. Образовавшаяся соль выпадает в осадок. Ее отфильтровывают и разлагают кислотой.
Следует отметить, что полученная соль серебра и подобные ей соединения меди взрывоопасны. Способность ацетиленидов реагировать с галогенопроизводными используют для синтеза соединений, содержащих тройную связь.
Применение
Алкины являются сырьем для производства большого количества органических соединений и материалов: альдегидов, кетонов, растворителей (тетрагалогенэтанов), исходных веществ для получения синтетических каучуков, поливинил-хлорида и других полимеров (схема 5).
Ацетилен является ценнейшим горючим с очень высокой теплотой горения.
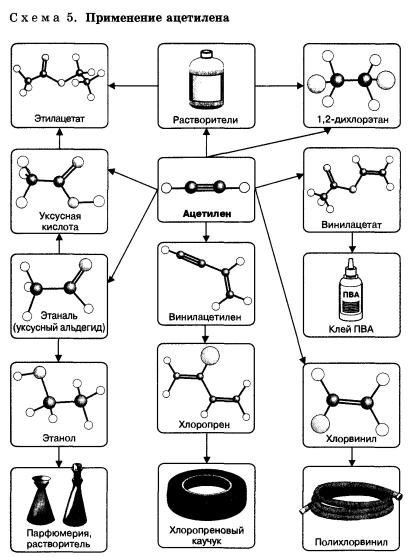
Алкины или ацетиленовые углеводороды широко используются в промышленности. Можно с уверенностью сказать, что благодаря ацетилену произошло расширение многих отраслей промышленности, в которых применяется органический синтез. Его производство в мировых масштабах составляет не один миллион тонн.
Конечно же, в своем большинстве, ацетилен нашел свое применение при сварке, а так же при резке металлов, так как при горении ацетилена выделяется много тепла и его температура пламени достигает свыше 2800 градусов и способна расплавить многие металлы.

Также он нашел широкое применение при производстве различных поливинилхлоридов, растворителей и клея.
При рассмотрении схемы 5, изображенной выше, можно с уверенностью сделать вывод, что ацетилен занимает ведущее место в промышленности, так как является для нее важным химическим сырьем.
Ацетилен также применяют, и довольно таки широко, в органическом синтезе разных веществ, таких как уксусная кислота, а также в хлорировании, гидрохлорировании и др.
Кроме этого, ацетилен является одним из исходных веществ при получении синтетических каучуков, поливинилхлорида, а также других полимеров.
Поливинилхлорид, конечно же, является важным продуктом в химической промышленности и на его основе изготавливают разные виды пластмассы, но следует знать, что при неправильной утилизации он может создать экологические проблемы, так как его время разложения длится не одну сотню лет и, к сожалению, вторичного способа его переработки еще не придумали.
Но следует знать и меры безопасности и, ни в коем случае ПВХ не сжигать, так как он при горении образует ядовитые хлорорганические соединения.

А знаете ли вы, что в конце девятнадцатого и до начала двадцатого века были популярны ацетиленовые светильники, которые широко использовались для освещения улиц, железнодорожных путей, в водном транспорте, а также в других бытовых потребностях, так как его источником был дешевый карбид кальция.
А знаете ли вы, по какому принципу работали карбидные фонари? Оказывается, что в заполненный карбидом кальция фонарь капельным способом поступала вода и дальше, в результате полученный ацетилен попадал в горелку и был использован для освещения.
Конечно же, сейчас уже ацетиленовые фонари практически нигде не применяются, разве только при производстве походного снаряжения, да и то, в небольших количествах.
Нахождение в природе и физиологическая роль алкинов
Если затронуть тему о природном происхождении алкинов, то их в природе не существует, разве только за исключением некоторых видах грибов, в которых в совсем малых дозах обнаружили такие соединения, в которых содержаться полиацетиленовые структуры.
Кроме того, что ацетилен присутствует в различных видах грибов, он также был обнаружен и в атмосфере таких планет, как Уран, Юпитер и Сатурн.
Также следует знать, что алкины обладают слабым наркозным действием и в жидком состоянии обладают способностью вызывать судороги.
История открытия
Ф. Вёлер, немецкий химик и врач, в 1862 году с помощью действий воды и карбида кальция также открыл ацетилен.
Домашнее задание
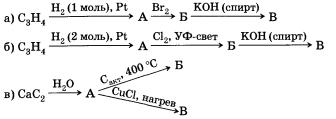
1. Возможна ли для алкинов цис-транс-изомерия?
2. Напишите все возможные формулы изомеров углеводорода состава С5Н8, относящихся к классу алкинов.
3. Предложите способы получения ацетилена из неорганических веществ. Напишите уравнения соответствующих реакций.
4. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б и В.
5. С помощью каких реагентов и при каких условиях можно получить бутин-2 из бутена-2? Запишите уравнения реакций.
6*. Почему во всех работах, связанных с ацетиленом, категорически запрещено применять медь или ее сплавы в реакторах, инструментах, коммуникациях и т. д.?
7*.При сжигании 2,48 г смеси пропана, пропена и пропина образовалось 4,03 г углекислого газа (н. у.). Сколько граммов воды получилось при этом?
8*. 3,92 л (н. у.) смеси газообразных алкена и алкина, содержащих одинаковое число атомов углерода, могут присоединить 40 г брома. Образовавшаяся при этом смесь имеет массу 47,2 г. Определите качественный и количественный (в процентах по объему) состав исходной смеси углеродов.
Алкины — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода.
Оглавление
Строение алкинов
Алкины — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле СnН2n-2.

Атомы углерода, между которыми образована тройная связь, находятся в состоянии sp-гибридизации. Это означает, что в гибридизации участвуют одна s- и одна р-орбиталь, а две р-орбитали остаются негибридизованными. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей соседних атомов углерода образуются две π-связи. Таким образом, тройная связь состоит из одной σ-связи и двух π-связей.
Все гибридные орбитали атомов, между которыми образована двойная связь, а также заместители при них (в случае этина — атомы водорода) лежат на одной прямой, а плоскости π-связей перпендикулярны друг другу.
Тройная углерод-углеродная связь с длиной 0,12 нм короче двойной, энергия тройной связи больше, т. е. она является более прочной.

Тройная связь — это комбинация одной s- и двух p-связей. Атомы углерода, входящие в состав молекулы ацетилена, находятся в состоянии sp-гибридизации.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена): С2Н2 — этин, С3Н4 — пропин, С4Н6 — бутин, С5Н8 — пентин, С6Н10 — гексин и т. д.
Изомерия и номенклатура алкинов

Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:

Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
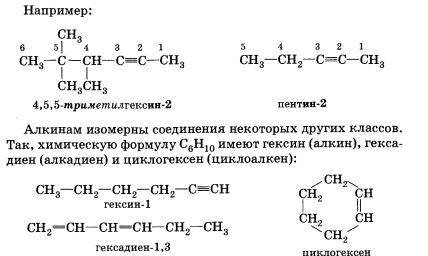
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.

Алкинам изомерны соединения некоторых других классов. Так, химическую формулу C6Н10 имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):

Физические свойства алкинов
Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.

Химические свойства алкинов
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома).

2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях гидрогалогенирования выполняется правило Марковникова:
3. Гидратация (присоединение воды). Большое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:

4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов (Pt, Pd, Ni):
Так как тройная связь содержит две реакционноспособные π-связи, алканы присоединяют водород в две ступени:
1) тримеризация — начальный этап, в течение которого при пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:

2) димеризация — следующий этап, в процессе которого под действием солей одновалентной меди образуется винилацетилен:
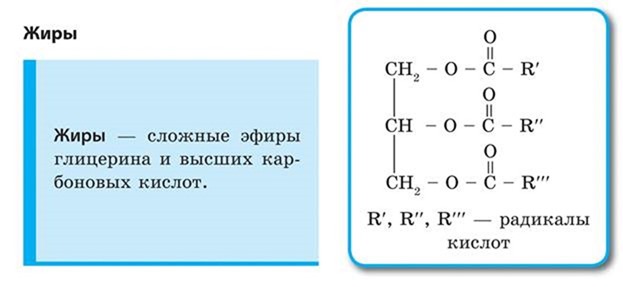
Это вещество используется для получения хлоропрена:

полимеризацией которого получают хлоропреновый каучук:

Окисление алкинов. Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:

На этой реакции основано действие кислородноацетиленовой горелки, пламя которой имеет очень высокую температуру (более 3000 °с), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т. к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Читайте также:

