Как сделать изомеризация алканов
Добавил пользователь Алексей Ф. Обновлено: 04.10.2024
§ 10. Химические свойства, получение и применение алканов
Химические свойства, получение и применение алканов
Существует огромное число различных алканов. Их многообразие объясняется как возможностью образования углеродных цепей различной длины, так и изомерией. В связи с этим изучать химические свойства каждого алкана отдельно не представляется возможным. В то же время молекулы различных алканов имеют сходное строение: атомы углерода соединены между собой и атомами водорода одинарными ковалентными связями. Учитывая это, можно ожидать, что химические свойства различных алканов будут во многом сходными.
Все алканы характеризуются низкой химической активностью. Они не взаимодействуют с растворами кислот, оснований, солей. На них не действует такой сильный окислитель, как KMnO4, и такие сильные восстановители, как щелочные металлы. Вы знаете, что щелочные металлы очень активны и реагируют практически со всеми веществами, с которыми соприкасаются, в том числе легко окисляются кислородом воздуха. Чтобы уберечь щелочные металлы от окисления, их хранят под слоем керосина — смеси, состоящей в основном из насыщенных углеводородов. При этом алканы, входящие в состав керосина, не реагируют со щелочными металлами.
Из-за низкой химической активности алканов реакции с их участием протекают в жёстких условиях (при нагревании или облучении ультрафиолетовым излучением).
Мы изучим реакции алканов с галогенами (Cl2 и Br2) и кислородом (O2), а также превращения, которые они претерпевают при нагревании.
1. Галогенирование. Взаимодействие с галогенами
Взаимодействие алканов с галогенами — хлором и бромом — протекает при нагревании или облучении ультрафиолетовым излучением.
Если смесью газообразных метана и хлора заполнить стеклянный сосуд и поместить его в тёмное место, реакция протекать не будет. Однако при нагревании смеси или облучении её ультрафиолетовым излучением протекает химическая реакция замещения атомов водорода в молекуле метана на атомы хлора:
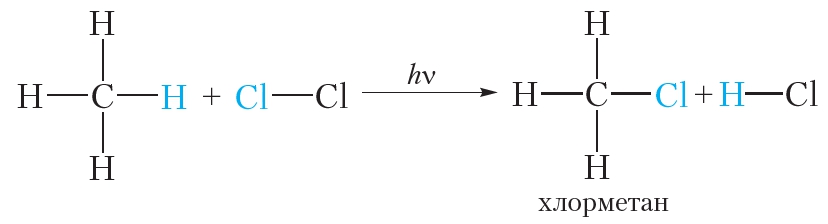
В уравнениях реакций, протекающих при облучении, над стрелкой записывают буквы hv. Данная реакция называется реакцией галогенирования и относится к реакциям замещения.
Если только один атом водорода в молекуле замещается на атом галогена, то реакцию называют моногалогенированием. Приведённая выше реакция является реакцией монохлорирования метана. В избытке хлора оставшиеся три атома водорода молекулы метана могут последовательно замещаться на галоген:
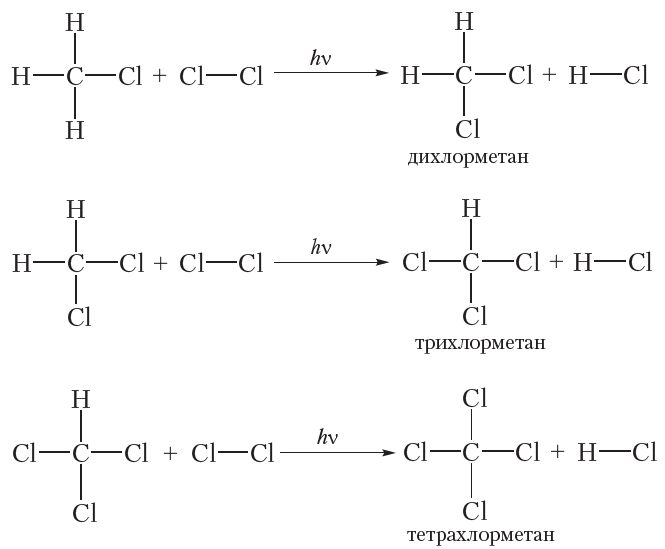
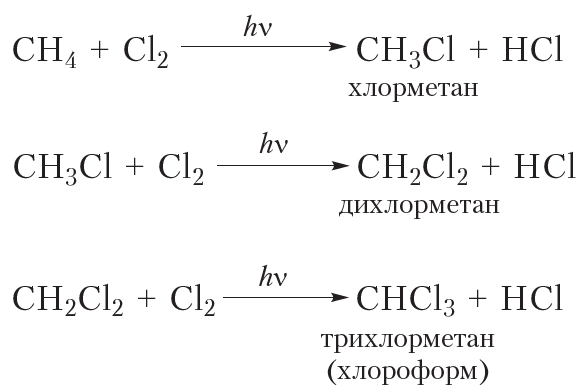
Приведём уравнения реакций всех четырёх стадий хлорирования метана с использованием молекулярных формул:
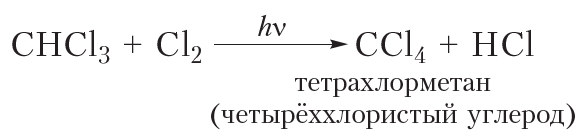
Рассмотрим реакции монохлорирования гомологов метана.
Монохлорирование этана
Для этана уравнение реакции следующее:
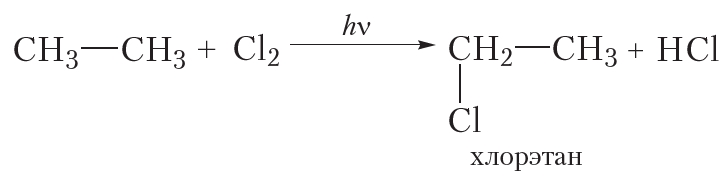

Таким образом, при монохлорировании этана так же, как и в случае метана, получается только одно органическое вещество — хлорэтан.
Монохлорирование пропана
При монохлорировании пропана образуется смесь двух органических веществ:
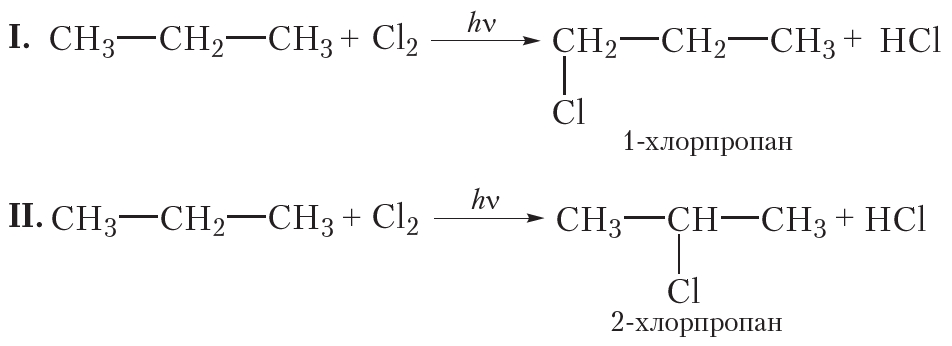
В случае I происходит замещение на галоген атома водорода при первом атоме углерода, продукт реакции 1-хлорпропан. В случае II замещается атом водорода при втором атоме углерода, продуктом реакции является 2-хлорпропан. Обратите внимание на то, что при построении названий нумерацию атомов углерода начинают с того конца углеродной цепи, к которому ближе расположен атом хлора.
В результате реакции монохлорирования пропана образуются два продукта: 1-хлорпропан и 2-хлорпропан, имеющие одинаковые молекулярные формулы C3H7Cl. Это неудивительно, ведь 1-хлорпропан и 2-хлорпропан — изомеры.
Если мы запишем уравнение реакции монохлорирования пропана с использованием молекулярных формул, оно будет выглядеть следующим образом:
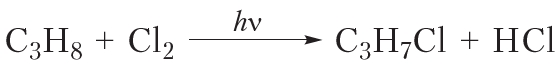
Уравнение реакции, записанное в таком виде, не только не позволяет определить, какой именно продукт (1-хлорпропан или 2-хлорпропан) имеется в виду, но и приводит к распространённому заблуждению, что при монохлорировании пропана образуется только один органический продукт — C3H7Cl, хотя на самом деле их два. Поэтому в органической химии при записи уравнений реакций обычно используют структурные, а не молекулярные формулы веществ.
В результате хлорирования алканов происходит замещение одного или нескольких атомов водорода в молекуле алкана на атомы галогена. Поэтому получающиеся органические вещества называют галогенпроизводными алканов.
Пример. Замещение двух атомов водорода хлором в молекуле этана.
Реакция протекает в два этапа.
а) Первая стадия хлорирования этана. На первой стадии происходит замещение одного атома водорода. При этом образуется только одно органическое вещество — хлорэтан:

б) Вторая стадия хлорирования этана. На данной стадии происходит взаимодействие молекулы хлора с молекулой хлорэтана, образовавшегося на первой стадии. Очевидно, что при этом могут образоваться два органических вещества:
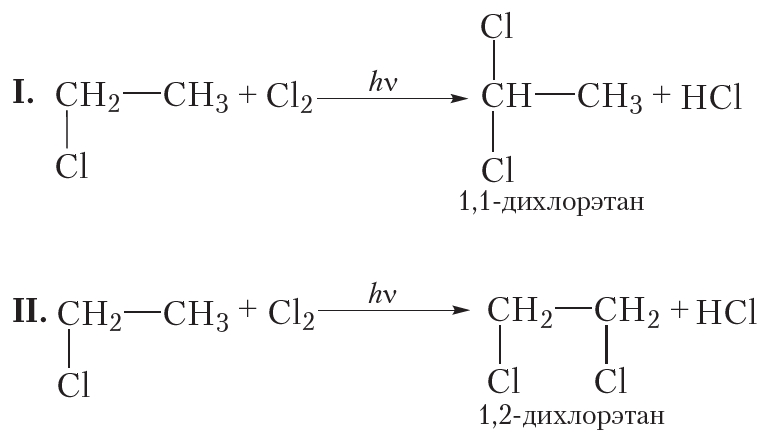
Действительно, в результате хлорирования этана можно получить смесь двух дихлорпроизводных.
Алканы вступают в реакции замещения также с бромом. Например:
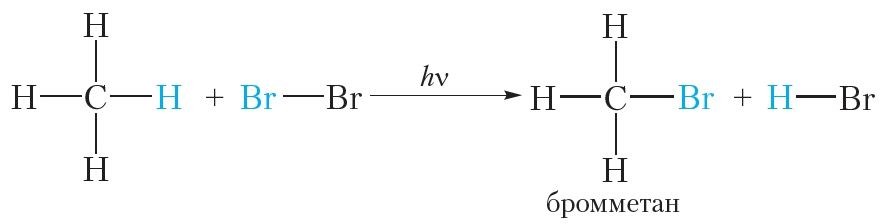

В заключение ещё раз обратим внимание, что реакции алканов с хлором и бромом протекают в жёстких условиях: при облучении или нагревании.
С механизмом реакции галогенирования алканов вы можете познакомиться, перейдя по ссылке в QR-коде.
В реакциях галогенирования атомы водорода в молекуле алкана замещаются на атомы галогена, при этом углеродная цепь молекулы сохраняется. В других реакциях алканов их углеродный скелет изменяется или полностью разрушается. Рассмотрим такие реакции.
2. Пиролиз
При сильном нагревании алканов в их молекулах происходит разрыв связей и . В результате молекулы алканов могут быть полностью разрушены с образованием углерода и водорода. Разложение веществ при высоких температурах называют пиролизом (от греч. пиро — огонь, жар и лизис — разложение, распад). Например:
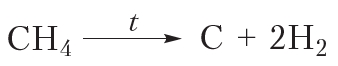
Общая схема реакции пиролиза алканов (n — число атомов углерода в молекуле алкана):
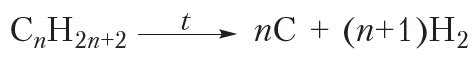
Эту реакцию используют в промышленности для получения сажи и водорода.
3. Изомеризация
Ещё одним химическим свойством алканов является изомеризация, то есть превращение одного изомера в другой. Это свойство возможно для алканов, начиная с бутана, так как метан, этан и пропан изомеров не имеют. Реакция изомеризации протекает при пропускании алкана через реактор, нагретый до высокой температуры, в присутствии катализатора. При этом молекулы алканов линейного строения превращаются в молекулы разветвлённого строения, например реакция изомеризации н-бутана:
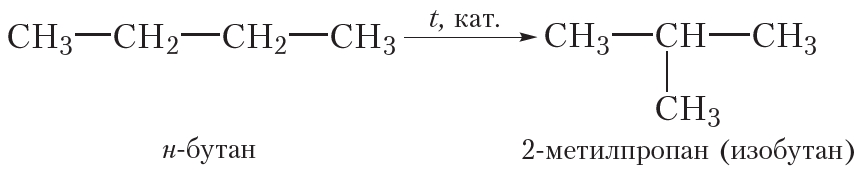
4. Горение. Взаимодействие с кислородом
Важнейшее свойство алканов — горение. Алканы воспламеняются при поджигании. Уравнение реакции горения метана:

Эта реакция вам хорошо знакома, она протекает при поджигании газа в кухонной газовой плите, ведь метан — основной компонент природного газа. Смесью пропана и изомерных бутанов наполняют газовые баллоны. Уравнения реакций горения этих алканов:
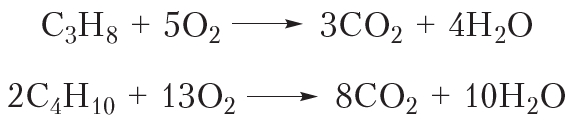
Последующие члены гомологического ряда алканов также горят при поджигании. Можно записать общее уравнение реакции горения:
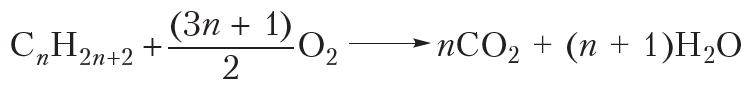
Видно, что при горении атомы водорода из молекулы алкана переходят в молекулы воды, а атомы углерода — в молекулы углекислого газа. Если горение алкана происходит в условиях недостатка кислорода, то, наряду с углекислым газом (СО2), может образоваться угарный газ (СО) или углерод (С) в виде сажи:
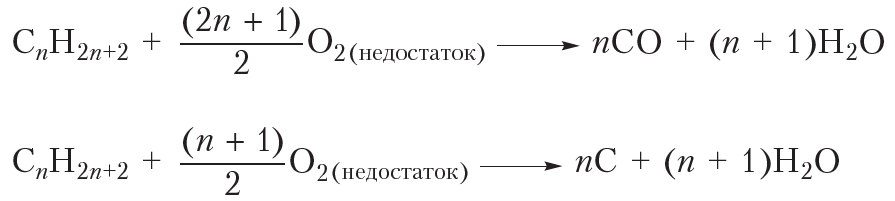
Отметим, что свойство гореть в кислороде присуще почти всем органическим соединениям. Поскольку все органические вещества содержат углерод, то при их горении могут образовываться оксиды углерода и сажа.
Образование угарного газа (CO) при неполном сгорании органического вещества смертельно опасно из-за высокой токсичности СО. Отравление угарным газом может произойти при неправильной эксплуатации печей и каминов.
Как видно, химические свойства алканов не отличаются большим разнообразием. Для них характерны в основном реакции окисления (в частности, горения), разложения и изомеризации при высокой температуре, а также реакции замещения, в результате которых получают галогенпроизводные алканов.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
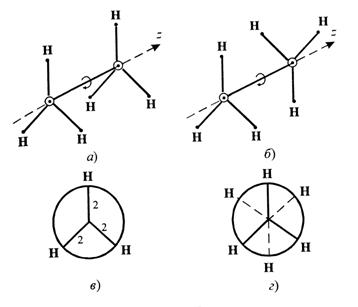
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи. Алканы – название предельных углеводородов по международной номенклатуре. Парафины– исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – имеющий мало сродства, малоактивный). Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода. Простейшие представители алканов: При сравнении этих соединений видно, что они отличаются друг от друга на группу -СН 2 - (метилен). Добавляя к пропану еще одну группу -СН 2 - , получим бутан С 4 Н 10, затем алканы С 5 Н 12, С 6 Н 14 и т.д. Теперь можно вывести общую формулу алканов. Число атомов углерода в ряду алканов примем за n , тогда число атомов водорода составит величину 2n+2 . Следовательно, состав алканов соответствует общей формуле C n H 2n+2. Поэтому часто используется такое определение: Алканы — углеводороды, состав которых выражается общей формулой C n H 2n+2, где n – число атомов углерода. II. Строение алканов Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы. Из этих формул видно, что в алканах имеются два типа химических связей: С–С и С–Н . Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2.5 - для углерода и 2.1 - для водорода). Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул: Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества. Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности. Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации. Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp 3 -гибридизации. В этом случае каждая из четырех sp 3 -гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp 3 -АО другого атома углерода, образуя σ-связи С-Н или С-С. Четыре σ-связи углерода направлены в пространстве под углом 109 о 28', что соответствует наименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода: Валентный угол Н-С-Н равен 109 о 28'. Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей. Для записи удобно использовать пространственную (стереохимическую) формулу. В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp 3 -атома углерода образуют более сложную пространственную конструкцию: Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы. Это можно показать на примере н-бутана или н-пентана: III. Изомерия алканов . Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами. 1. Различия в порядке соединения атомов в молекулах (т.е. в химическом строении) приводят к структурной изомерии . Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т.е. начиная с бутана С4Н10. Структурные изомеры - соединения одинакового состава, отличающиеся порядком связывания атомов, т.е. химическим строением молекул. Причиной проявления структурной изомерии в ряду алканов являетсяспособность атомов углерода образовывать цепи различного строения.Этот вид структурной изомерии называется изомерией углеродного скелета. Например, алкан состава C4H10 может существовать в виде двух структурных изомеров: а алкан С5Н12 – в виде трех структурных изомеров,отличающихся строением углеродной цепи: При выводе структурных формул изомеров используют следующие приемы . 2. Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве, то наблюдается пространственная изомерия (стереоизомерия). В этом случае использование структурных формул недостаточно и следует применять модели молекул или специальные формулы - стереохимические (пространственные) или проекционные. Алканы, начиная с этана H3C–СН3, существуют в различных пространственных формах (конформациях), обусловленных внутримолекулярным вращением по σ-связям С–С, и проявляют так называемую поворотную (конформационную) изомерию. Различные пространственные формы молекулы, переходящие друг в друга путем вращения вокруг σ-связей С–С, называют конформациями или поворотными изомерами (конформерами). Поворотные изомеры молекулы представляют собой энергетически неравноценные ее состояния. Их взаимопревращение происходит быстро и постоянно в результате теплового движения. Поэтому поворотные изомеры не удается выделить в индивидуальном виде, но их существование доказано физическими методами. Некоторые конформации более устойчивы (энергетически выгодны) и молекула пребывает в таких состояниях более длительное время. Рассмотрим поворотные изомеры на примере этана Н3С–СН3: Этот вид изомерии для алканов мало характерен, но, тем не менее, в некоторых случаях он присутствует. а) Оптическая изомерия Он присутствует у алканов только в том случае, если в молекуле присутствует асимметрический (хиральный) атом углерода. То есть такой, у которого все четыре валентности заняты разными заместителями. В этом случае существуют вещества, представляющие собой зеркально противоположенные антиподы: Где радикалы R1, R2, R3, R4 не равны между собой (рис. 5). Во всех остальных случаях оптическая изомерия для алканов не характерна. Рис. 5. Алканы - оптические изомеры Конформационная изомерия
Так как характер ординарных связей позволяет вращение атомов вокруг собственной оси, алканы способны принимать в пространстве различные конформации. Например, молекула этана способна существовать в виде 2- х конформаций заслонённой (рис. а.) и заторможенной (рис 6, б.). Их изображают при помощи конформационных формул Ньюмена (рис. 6 в и г.). Заторможенная конформация термодинамически более выгодна, так как в ней атомы водорода наиболее сильно удалены друг от друга и испытывают наименьшее воздействие друг на друга. В отличие от других видов изомерии, конформеры невозможно разделить даже при температуре абсолютного нуля. Рис. 6. Конформеры этана Они способны переходить друг в друга без разрыва химических связей, в отличие, например, от цис – транс - изомеров. Поэтому конформационная изомерия для алканов – явление несколько условное, тем не менее, оно наблюдается. Для алканов не характерны другие виды изомерии, такие как В межклассовая, геометрическая (цис-, транс-) изомерия. Это объясняется особенностями ординарной связи, которая, как уже говорилось, позволяет свободное вращение. Читайте также:
|