Как сделать из сероводорода серную кислоту
Обновлено: 07.07.2024
Как вы знаете, я увлекся добычей золота и других драгметаллов из разной электроники. А для этого помимо самих золотосодержащих компонентов потребуются некоторые химические реактивы. На начальном этапе я решил не тратиться на их покупку, а постараюсь их синтезировать самостоятельно.
Причем хотелось бы обойтись без специальных химреактивов и химической посуды, чтобы все, что я делаю мог повторить любой человек. Ранее я уже писал, как я изготовил свой первый реактив, это был железный купорос :
А сегодня я расскажу, как можно в домашних условиях приготовить концентрированную серную кислоту , которая понадобиться мне для изготовления других двух кислот, соляной и азотной . А из этих двух кислот, как вы знаете готовиться царская водка .
Для нашего опыта нам потребуется аккумуляторной электролит , который продается в любом автомобильном магазине. Я купил сразу банку на 5 литров с плотностью 1,28 г/см3 (что соответствует примерно концентрации 36% ). Как наверное все знают, электролит представляет собой разбавленную серную кислоту .
И для того, чтобы получить более концентрированную кислоту, нам нужно постараться выпарить из нее всю воду. А зная ее начальную концентрацию в 36% , понятно, что нужно упарить электролит примерно в 3 раза .
Далее, нам потребуется стеклянная банка для выпаривания воды из электролита. Я взял пустую баночку из под растворимого кофе. Затем, необходимо нанести разметку на эту баночку используя какой-нибудь мерный стаканчик.
1)2Al+6H2O=2Al(OH)3+3H2
2Al(0)+12H(+)+6OH(-)=2Al(OH)3+3H2
2Al(0)+12H(+)+6OH(-)=2Al(OH)3+3H2
Al-восс-ль, H2O (H(+))-ок-ль
2)BaO+H2O=Ba(OH)2
3)BaO+H2SO4=BaSO4+H2O
Ba(2+)+O(-2)+2H(+)+SO4(-2)=BaSO4+H2O
Ba(2+)+O(-2)+2H(+)+SO4(-2)=BaSO4+H2O
4)2Al+6H2SO4=Al2(SO4)3+3H2
2Al(0)+12H(+)+6SO4(-2)=2Al(3+)+6SO4(-2)+3H2
6H(+)=3H2
Al-восс-ль, H2SO4 (H)-Ок-ль
5)2Al+6H2SO4=Al2(SO4)3+3SO2+6H2O
2Al(0)+12H(+)+6SO4(-2)=2Al(+3)+3SO4(-2)+3SO2+6H2O
12H(+)+3SO4(-2)=3SO2+6H2O
Al-восс-ль, H2SO4 (S)-Ок-ль
6)2NaOH+H2SO4=Na2SO4+2H2O
2Na(+)+2OH(-)+2H(+)+SO4(-2)=2Na(+)+SO4(-2)+2H2O
2OH(-)+2H(+)=2H2O
7)2Al+2NaOH+6H2O=2Na[Al(OH4)]+3H2
2Al(0)+2Na(+)+2OH(-)+6H2O=2Na(+)+2Al+8OH(-)+3H2
6H2O=6OH(-)+3H2
Al-восс-ль, H2O (Н) - ок-ль
С недавних пор проблемы экологии все больше беспокоят человечество.
Промышленность с каждым годом наращивает свои обороты. Очевидно, что
бурное развитие промышленности приводит к благоприятным перспективам для развития современного общества, но при этом производственные предприятия негативно сказываются на экологии.
Для того чтобы уменьшить отрицательное влияние на окружающую среду, необходимо проанализировать процессы, в различных областях промышленности, увеличить количество научных исследований и на основе полученных данных разработать новые более экологичные технологии.
На данный момент природный газ является значимым природным сырьем для изготовления множества химпродуктов, при этом он является дешевым видом топлива. Большая часть горючих газов в составе содержат сероводород, который в производстве чаще всего считается ненужной примесью. Оттого газы подвергаются особой очистке, в результате, которой получается сероводородный газ, используемый для производства серной кислоты.
В действительности очистка газов от сероводородного газа осуществляется различными способами, их можно поделить на две группы: мокрые методы, предполагающие применение жидких поглотительных растворов, и сухие метода, которые основываются на участии различных поглотителей или катализаторов в сухом виде.
Порядка 94% серы содержится в сероводороде, что делает его достаточно значимым продуктом. Переработка сероводорода на серу, в дальнейшем производства из нее серной кислоты бессмысленно удобнее было бы перерабатывать сероводород напрямую на серную кислоту учитывая, что схема этого процесса довольно проста. Особенно выгодным вариантом производства серной кислоты из сероводорода является метод мокрого катализа, которой по себестоимости и капиталовложениям крайне удобен в использовании, а также позволяет использовать сероводород как низкой, так и высокой концентрации. Достоинство метода заключается в том, что сероводород являющийся отходом многих производств, перерабатывается на продукт, имеющий высокую ценность.
Сера - элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов - элементов VIa группы.
Сера - S - простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

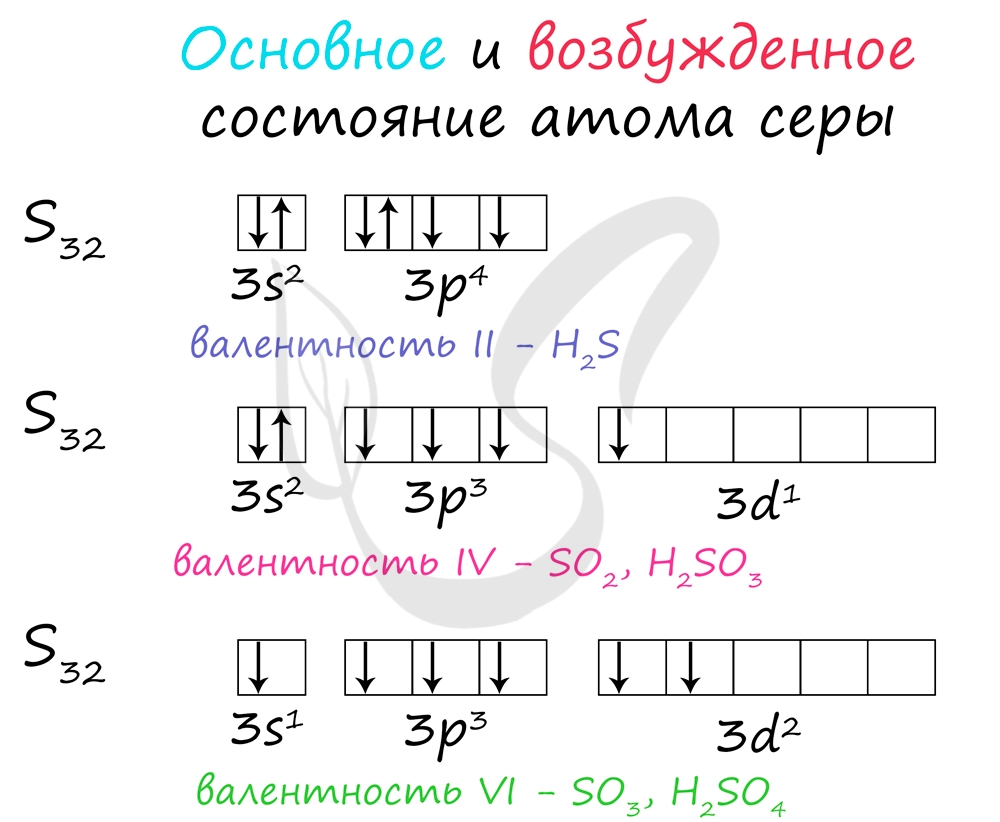
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Природные соединения
- FeS2 - пирит, колчедан
- ZnS - цинковая обманка
- PbS - свинцовый блеск (галенит), Sb2S3 - сурьмяный блеск, Bi2S3 - висмутовый блеск
- HgS - киноварь
- CuFeS2 - халькопирит
- Cu2S - халькозин
- CuS - ковеллин
- BaSO4 - барит, тяжелый шпат
- CaSO4 - гипс
В местах вулканической активности встречаются залежи самородной серы.

В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
-
Реакции с неметаллами
На воздухе сера окисляется, образуя сернистый газ - SO2. Реагирует со многими неметаллами, без нагревания - только со фтором.

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.

Сероводород - H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.

Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Сероводород - сильный восстановитель (сера в минимальной степени окисления S 2- ). Горит в кислороде синим пламенем, реагирует с кислотами.

Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
Оксид серы - SO2
Сернистый газ - SO2 - при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
С основными оксидами, основаниями образует соли сернистой кислоты - сульфиты.

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
В реакциях с основными оксидами, основаниями образует соли - сульфиты и гидросульфиты.
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота - основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.

Оксид серы VI - SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия - Pr, V2O5).
В лабораторных условиях разложением солей серной кислоты - сульфатов.
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли - сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке - средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке - кислая соль)

SO3 - сильный окислитель. Чаще всего восстанавливается до SO2.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

