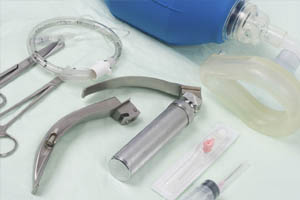
Как сделать интубацию
Добавил пользователь Дмитрий К. Обновлено: 05.10.2024
Возможны как первичная остановка дыхания, так и первичная остановка кровообращения. Выявление первичной остановки дыхания (инородные тела дыхательных путей, электротравма, утопление, поражение центральной нервной системы (ЦНС) и др.) маловероятно на догоспитальном этапе, так как к моменту прибытия бригады скорой помощи успевает развиться фибрилляция желудочков или асистолия.
Причиной первичной остановки кровообращения могут быть острый инфаркт миокарда, аритмия различного характера, электролитный дисбаланс, тромбоэмболия легочной артерии, разрыв и расслоение аневризмы аорты и т. д.
Различают три варианта прекращения сердечной деятельности: асистолия, фибрилляция и электромеханическая диссоциация. Асистолия может быть первичной или вторично развиться после фибрилляции желудочков. В первом случае шансов на успех реанимации больше, во втором, при истощении резервов миокарда, — меньше. Иногда изолинию на электрокардиограмме (ЭКГ) воспринимают как асистолию, но она может наблюдаться и при неисправности электрокардиографа, случайном отсоединении электродов, низкоамплитудной ЭКГ и т. п. Электромеханическая диссоциация характеризуется наличием электропродукции сердца, но отсутствием сокращения миокарда.
При фибрилляции возникают разрозненные, беспорядочные, неэффективные сокращения миокарда. И здесь имеют значение применение прекордиального удара и рано выполненная дефибрилляция.
Признаками остановки кровообращения являются: потеря сознания; отсутствие пульса на сонных артериях; остановка дыхания; судороги; расширение зрачков и отсутствие их реакции на свет; изменение цвета кожных покровов.
Для подтверждения остановки сердца достаточно наличие первых трех признаков.
Сердечно-легочная реанимация (СЛР) не показана, и ее можно не начинать в случаях: если установлено, что с момента остановки сердца (при нормальной температуре окружающей среды) прошло свыше 25 мин; больные заранее зафиксировали свой отказ от СЛР.
В иных случаях при оказании помощи на догоспитальном этапе СЛР начинается немедленно.
Поводом для прекращения СЛР является отсутствие признаков восстановления кровообращения и дыхания при использовании всех доступных методов СЛР в течение 30 мин.
СЛР на догоспитальном этапе
Она включает в себя элементарное поддержание жизни (по П. Сафару) или первичный реанимационный комплекс (по А. Зильберу):
- восстановление проходимости дыхательных путей;
- искусственную вентиляцию легких (ИВЛ) и оксигенацию;
- непрямой массаж сердца.
Кроме того, производятся мероприятия (рис. 1) специализированного реанимационного комплекса (по А. Зильберу), включающего:
- электрокардиографию и дефибрилляцию;
- обеспечение венозного доступа и введение медикаментозных средств;
- интубацию трахеи.
Если зубной протез цел, его оставляют в полости рта, так как это сохраняет контур рта и облегчает проведение ИВЛ.
При обструкции дыхательных путей инородным телом пострадавшего укладывают на бок и производят 3–5 резких ударов нижней частью ладони в межлопаточной области, затем пальцем пытаются удалить инородное тело из ротоглотки. Если этот метод неэффективен, то выполняют прием Геймлиха: ладонь реаниматолога укладывается на живот между пупком и мечевидным отростком, вторую руку укладывают на первую и производят толчок снизу вверх по средней линии. После чего также пальцем пытаются удалить инородное тело из ротоглотки.
Большим шагом вперед явилось создание ларингеальной маски. Ларингеальный масочный воздуховод представляет собой интубационную трубку, которая не проходит через голосовую щель в трахею, а имеет на дистальном конце миниатюрную маску, которая надевается на гортань. Манжета, прилегающая к краю маски, раздувается вокруг гортани, обеспечивая герметичность по ларингеальному периметру. Ларенгеальная маска обладает множеством преимуществ, в том числе позволяет обойтись без разгибания головы в шейном отделе, если к этому имеются противопоказания.
Каждый врач скорой помощи должен уметь выполнять интубацию трахеи. Этот метод позволяет обеспечить оптимальную проходимость дыхательных путей, снизить вероятность регургитации при проведении комплекса реанимационных мероприятий, обеспечить более высокое внутрилегочное давление. Кроме того, через интубационную трубку можно вводить некоторые медикаменты.
ИВЛ. Искусственное дыхание — это вдувание воздуха или обогащенной кислородом смеси в легкие пациента без или с применением специальных устройств. Выдыхаемый человеком воздух содержит от 16 до 18% кислорода, поэтому эффективнее ИВЛ атмосферным воздухом, либо кислородо-воздушной смесью. Каждое вдувание должно занимать 1–2 с, а частота дыхательных движений составлять 12–16 в минуту. Адекватность ИВЛ оценивается по периодическому расширению грудной клетки и пассивному выдыханию воздуха.
Бригадой скорой помощи обычно используются либо воздуховод, либо лицевая маска и мешок Амбу, либо интубация трахеи и мешок Амбу.
У пациентов с фибрилляцией желудочков и желудочковой тахикардией рекомендуется при отсутствии подготовленного к работе дефибриллятора нанести прекордиальный удар (1–2 резких удара кулаком в область границы средней и нижней трети грудины с расстояния не менее 30 см).
Если помощь оказывает один реаниматолог, то на два вдувания воздуха выполняются 15 тракций, если работают два реаниматолога, то на одно вдувание воздуха осуществляется 5 тракций.
Электрическая дефибрилляция сердца (ЭДС). Это важнейший компонент СРЛ. ЭДС эффективна только при сохранности энергетического ресурса миокарда, т. е. при регистрации на ЭКГ крупноволновых осцилляций от 0,5 до 1 мВ и более (рис. 2). Если же отмечаются низкие, аритмичные, полиморфные осцилляции, а также асистолия, то начинают с ИВЛ, непрямого массажа и медикаментозной терапии (рис. 3), добиваются перехода асистолии или мелковолновой фибрилляции желудочков в крупноволновую фибрилляцию и применяют ЭДС.
Первый разряд для ЭДС — 200 Дж, при неэффективности второй — 300 Дж, при неэффективности третий — 360 Дж. Перерыв между разрядами минимальный — для контроля ритма. Непрямой массаж сердца и ИВЛ прерываются только на момент разряда. Если первая серия из трех разрядов оказывается неэффективной, то на фоне продолжающейся ИВЛ, непрямого массажа сердца, медикаментозной терапии проводится вторая серия разрядов в той же последовательности.
В настоящее время на догоспитальном этапе применяются автоматические наружные дефибрилляторы, в этом случае ЭКГ регистрируется с электродов дефибриллятора, приложенных к грудной клетке. Дефибриллятор регистрирует ритм сердца и производит его автоматический анализ; при выявлении желудочковой тахикардии или фибрилляции желудочков конденсаторы автоматически заряжаются, и прибор дает разряд. Эффективность автоматических дефибрилляторов очень высока. Кроме автоматических, используются полуавтоматические наружные дефибрилляторы.
Медикаментозная терапия при сердечно-легочной реанимации. Медикаменты при СЛР могут вводиться: в периферическую вену; в центральную вену; в трахею.
По понятным причинам внутримышечный путь введения не показан. При наличии возможности катетеризируется периферическая вена. Если реаниматолог опытный и хорошо владеет методикой пункции центральной вены, можно использовать этот способ. Проблема в том, что в этом случае приходится прерывать реанимационные мероприятия, а перерыв больше, чем на 5–10 с нежелателен. Внутритрахеальный путь удобен, если выполнена интубация трахеи, в крайнем случае можно ввести препараты в трахею через перстнещитовидную мембрану. Эндотрахеально допустимо вводить адреналин, атропин, лидокаин. Препараты лучше развести в 10–20 мл 0,9% раствора натрия хлорида.
М-холинолитик атропин снижает тормозящее влияние ацетилхолина на синусовый узел и атриовентрикулярную проводимость и, возможно, способствует высвобождению катехоламинов из мозгового слоя надпочечников. Он показан при брадисистолии и асистолии. Дозы — 1 мг, можно повторить через 5 мин, но не более 3 мг за время реанимации.
Все антиаритмические препараты оказывают депрессивное действие на миокард и небезвредны для организма пациента. При развившейся фибрилляции желудочков их следует вводить лишь в случае нескольких неудачных попыток ЭДС, поскольку они, подавляя желудочковую эктопию затрудняют восстановление самостоятельного ритма. Лидокаин считается одним из наиболее эффективных средств при рефрактерной фибрилляции желудочков, устойчивой желудочковой тахикардии и тахикардиях неясной этиологии с широким комплексом QRS. Доза для насыщающего внутривенного введения — 1,5 мг/кг струйно (обычно — 75–100 мг). Одновременно начинается введение поддерживающей дозы 2–4 мг в мин. Для этого 1 г лидокаина разводится в 250 мл 5% раствора глюкозы.
Показанием к введению гидрокарбоната натрия можно считать затянувшуюся более чем на 15 мин реанимацию, если остановке сердца предшествовали выраженный метаболический ацидоз или гиперкалиемия. Доза — 1 ммоль/кг, внутривенно однократно, при повторном введении она уменьшается вдвое. Некоторые авторы считают, что при адекватных реанимационных мероприятиях гидрокарбонат натрия следует вводить только под контролем кислотно-основного состояния, поскольку организм значительно хуже адаптируется к алкалозу, чем к ацидозу.
В качестве инфузионных растворов целесообразно использовать 0, 9% раствор хлорида натрия, но наиболее эффективен раствор лактата Рингера по Хартману, а из коллоидов — растворы со средней молекулярной массой, содержащие гидроксиэтилкрахмал — волювен или венофундин.
Во всех случаях показана экстренная госпитализация по витальным показаниям в отделение реанимации и интенсивной терапии.
И. Г. Труханова, доктор медицинских наук, доцент
Е. В. Двойникова, кандидат медицинских наук, доцент
Самарский государственный медицинский университет, Самара

Показания и противопоказания
Ларингоскопия с последующей интубацией трахеи используется в анестезиологии более 100 лет. Показания, противопоказания и оборудование при данной манипуляции являются базовыми аспектами в анестезиологии-реаниматологии.
Показания
- Невозможность оксигенации пациента
(SpO2 Внимание! Проверьте заранее, что все оборудование работает.
- Оборудование для позиционирования пациента
- Кровать или операционный стол, который можно поднимать и опускать
- Подушка или простыня, которые можно свернуть и положить под шею пациента
- Мониторинг
- Пульсоксиметрия
- Артериальное давление
- ЭКГ
- Оборудование для оксигенации
- Источник кислорода
- Лицевая маска
- Дыхательный мешок типа Амбу
- Аспирационный катетер
- Премедикация и вводная анестезия
- Внутривенный доступ
- Препараты для премедикации
- Препараты для вводной анестезии
- Миорелаксанты
- Оборудование для интубации трахеи
- Ларингоскоп с клинками разных типов (проверьте, горят ли лампочки)
- Изогнутые и прямые клинки
- Необходимо несколько размеров (7; 7,5; 8; 8,5; 9) и стилет для интубации
- Проверьте герметичность манжеты
- Рекомендуются специальные фиксаторы
- Альтернативой может служить бинт или пластырь
- Стетоскоп
- Капнограф (концентрация CO2 на вдохе и выдохе) или шприц
- Рентген грудной клетки
Показания к видеоларингоскопии
Трудная интубация трахеи и трудные дыхательные пути в анестезиологии
Трудная интубация трахеи и трудные дыхательные пути — клиническая ситуация, в которой анестезиолог испытывает трудности с вентиляцией маской или с интубацией трахеи, что может привести к риску возникновения критической гипоксии.
Предикторы трудной интубации трахеи
К предикторам трудной интубации трахеи относятся: морбидное ожирение, ограниченная подвижность шеи и в височно-нижнечелюстном суставе, скошенный подбородок, тироментальное расстояние, грудино-ментальная дистанция
Прогнозирование трудных дыхательных путей
При прогнозировании трудных дыхательных путей следует ожидать несколько ситуаций:
- сложная вентиляция лицевой маской
- трудная установка ларингеальной маски
- сложная ларингоскопия
- сложная интубация трахеи
- неудачная интубация трахеи
Для предупреждения непредвиденной трудной интубации рекомендуется использовать прогностическую шкалу интубации трахеи: Маллампати и/или Эль-Ганзури.
Алгоритм при трудной интубации трахеи
Алгоритм при трудной интубации трахеи разработан Американским и Британским обществом анестезиологов:
Калькулятор шкалы Эль-Ганзури
Шкала Эль-Ганзури используется для прогнозирования трудной интубации. Рекомендуемый способ обеспечения проходимости дыхательных путей: 0–3 балла интубация трахеи при обычной ларингоскопии; 4–7 интубация трахеи при видеоларингоскопии; 8–12 интубация трахеи в сознании при бронхоскопии.
Шкала MACOCHA
Шкала MACOCHA
Шкала MACOCHA — прогностическая шкала интубации трахеи у тяжелых больных в отделении реанимации.
Предложена в 2013 году Одри Де Йонг чтобы предотвратить и ограничить частоту опасных для жизни осложнений после сложной интубации. Используется система подсчёта баллов, где 0 баллов – лёгкая интубация, а 12 баллов – очень сложная интубация трахеи.Международные рекомендации при интубации трахеи
Рекомендации при интубации трахеи разработаны Американским обществом анестезиологов (ASA, 2013 год), Британским обществом трудных дыхательных путей (DAS, 2015 год), Британским обществом специалистов по ожирению и бариатрической анестезии (SOBA, 2016 год) и Российской федерацией анестезиологов (ФАР, 2018 год).
Рекомендации ASA
Рекомендации ASA (American Society of Anesthesiologists) — попытка решения проблемы трудных дыхательных путей. Основные осложнения, связанные с трудной интубацией трахеи: смерть, черепно-мозговая травма, остановка сердца, ненужные хирургические вмешательства на дыхательных путях, травмы дыхательных путей и повреждение зубов.
Рекомендации ASA:Рекомендации DAS
Стратегия VORTEX
Рекомендации SOBA
Рекомендации ФАР
Прямая ларингоскопия
![ларингоскоп]()
Эффективность прямой ларингоскопии зависит от достижения оптической оси от зубов верхней челюсти до гортани. Язык и надгортанник являются анатомическими структурами, закрывающими оптическую ось. Поэтому манипуляции на языке и надгортаннике являются решающими для успешного выполнения ларингоскопии. Плохое положение пациента — самая частая причина неудач при интубации трахеи. Неспособность в сгибании шейного отдела позвоночника и разгибании в атланто-затылочном сочленении препятствует выравниванию осей гортани, глотки и рта.
Улучшенное положение Джексона при ларингоскопии достигается путём размещения под головой несжимаемой подушки толщиной 10–15 см (или валика под затылком), подробнее здесь
Ларингоскоп используется для смещения языка и надгортанника с оптической оси. Язык смещается с оптической оси горизонтально (как правило, влево), подъязычная кость и прилегающие к ней ткани сдвигаются кпереди, а надгортанник напрямую или не напрямую поднимается, чтобы открыть гортань. Сила, приложенная к ручке ларингоскопа, должна поднимать подъязычную кость и прилегающие к ней ткани параллельно оптической оси. Соответствующая подъемная сила, которая может стать причиной большого растяжения ткани, является ключевым фактором эффективной прямой ларингоскопии. Важно достичь возможно наилучшего обзора гортани без повреждения тканей. Вывести оптическую ось при прямой ларингоскопии не всегда возможно. Разгибание головы облегчает введение ларингоскопа, уменьшает контакт ларингоскопа с верхними зубами, улучшает обзор гортани и облегчает открывание рта. Разгибание головы следует использовать при отсутствии противопоказаний.
Техника BURP: backward, upward, and rightward pressure on the larynx
Когда трахея находится в переднем анатомическом положении, применяется маневр BURP (backward, upward, and rightward pressure on the larynx: давление назад, вверх и вправо), что значительно облегчает обзор гортани при ларингоскопии: 1) приложите пальцы к щитовидной железе 2) приложите обратное давление и подтолкните щитовидный хрящ к подбородку 3) переместите его вправо от пациента. Данная техника может улучшить визуализацию входа в гортань.
Оротрахеальная интубация и л арингоскоп Macintosh
Техника оротрахеальной интубации
![ларингоскоп]()
ЛАРИНГОСКОПИЧЕСКИЕ КЛИНКИ FLEXTIP+ HEINE — ЭТО ЛАРИНГОСКОПИЧЕСКИЕ КЛИНКИ MACINTOSH С ЗАГИБАЕМЫМ (ДО 70°) КОНЦОМ КЛИНКА
Тремя последовательными компонентами прямой ларингоскопии являются: введение ларингоскопа, коррекция его положения и подъемной силы и применение других приемов для оптимизации обзора голосовой щели. Полное открывание рта облегчает введение ларингоскопа. Он вводится с правой стороны рта и справа от языка, одновременно с этим необходимо следить за тем, чтобы не защемить губы между клинком ларингоскопа и зубами. Ларингоскоп устанавливается и одновременно сдвигается к срединной линии, чтобы сдвинуть язык влево. Прогрессирующая визуализация анатомических структур снижает риск травмы. Надгортанник является первым ключевым анатомическим ориентиром. Кончик ларингоскопа устанавливается в валекуле, и надгортанник опосредованно поднимается под силой, натягивающей подъязычно-надгортанную связку. Когда обеспечено достаточное поднимание надгортанника, дальнейшая подъемная сила прикладывается к ларингоскопу, чтобы достичь наилучшего обзора гортани. Крайне важно не упираться в верхние зубы, поскольку это может привести к их повреждению и ухудшить визуализацию гортани. Если визуализацию гортани невозможно осуществить без давления на зубы, следует отказаться от применения такого ларингоскопа и применить другой способ интубации трахеи.
Проведение эндотрахеальной трубки при эффективной ларингоскопии
Сложности при интубации трахеи возникают преимущественно вследствие невозможности увидеть гортань. Эффективность прямой ларингоскопии оценивают с точки зрения достигнутого наилучшего ракурса гортани. Наиболее широко используемой шкалой является описанная Cormack и Lehane.
![Интубация трахеи у пациента с COVID-19]()
Предварительная оксигенация является обязательной для пациентов с COVID-19 из-за риска быстрого снижения уровня насыщения гемоглобина артериальной крови кислородом. После оптимизации положения пациента и коррекции гемодинамических нарушений выполните предварительную оксигенацию с фракцией вдыхаемого кислорода 100% в течение не менее 3 минут при активном дыхании или восьми вдохах, каждый из которых равен жизненной емкости легких.
Быстрая последовательная интубация, показанная для всех случаев, чтобы свести к минимуму время апноэ, может привести к значительной аэрозолизации, если проводится вентиляция легких с применением дыхательной маски. Поэтому такая вентиляция легких должна проводиться с осторожностью и только в том случае, если происходит снижение насыщения гемоглобина артериальной крови кислородом до критической отметки.
Если нет других указаний, прием Селлика не должен использоваться. Таким образом, первичный успех вентиляции может быть максимизирован, и оптимальная вентиляция легких (при необходимости) не нарушается. Для предотвращения десатурации рекомендуется апнойная оксигенация с применением низкопоточной назальной оксигенации во время попыток интубации трахеи. Поскольку этот процесс сопровождается генерацией аэрозоля, следует избегать высокого потока кислорода, подаваемого через нос.
Рекомендуется осторожное введение гипнотических агентов, чтобы свести к минимуму гемодинамическую нестабильность. Также показано введение рокурония в количестве 1,2 мг/кг или суксаметония — 1 мг/кг, которые обеспечат быстрое начало нервно-мышечной блокады и предотвратят кашель и связанную с ним аэрозолизацию. Рекомендуется также проводить нейромышечный мониторинг.
Настоятельно рекомендуется использовать при интубации видеоларингоскоп, в идеале одноразовый, но с отдельным экраном, чтобы свести к минимуму контакт с пациентом. В случае неудачи интубации трахеи можно осторожно использовать ручную вентиляцию легких с последующей попыткой интубации трахеи (максимум дважды и с учетом изменения положения, устройства и техники между попытками). Если интубация трахеи не удалась дважды или если требуется искусственный дыхательный путь, настоятельно рекомендуется использовать надгортанные устройства (ларингеальные маски) второго поколения (предпочтительно то устройство, которое позволяет в последующем проводить интубацию через него посредством введения гибкого бронхоскопа).
При невозможности обеспечить проходимость дыхательных путей при помощи видеоларингоскопии и установки надгортанного воздуховода, может быть рассмотрена хирургическая или чрескожная коникотомия). Очень желательно, чтобы принятие решения о коникотомии не откладывалось до снижения насыщения гемоглобина артериальной крови кислородом ниже критической отметки. Если пациенту показано выполнение интубации в сознании, применение внутривенной седации может свести к минимуму кашель. Необходимо свести к минимуму использование аэрозольной местной анестезии и рассмотреть возможность использования для слизистых ингалятора, валиков и марлевых тампонов, а также (если позволяет состояние пациента) блокады нервов, иннервирующих верхние дыхательные пути.
Необходимо использовать одноразовые гибкие бронхоскопы, чтобы снизить риск перекрестного заражения. Настоятельно рекомендуется использовать бронхоскоп с отдельным экраном. Можно рассмотреть интубацию трахеи в сознании с использованием видеоларингоскопии, поскольку это быстрее, чем фиброоптическая интубация.
Несмотря на потенциальную возможность аэрозолизации, трахеостомия с местной анестезией должна быть рассмотрена в случае неудачного проведения интубации трахеи и последующего пробуждения пациента, а также в тех случаях, когда очевидна невозможность обеспечения проходимости дыхательных путей стандартными методами. В случае сценария “невозможно интубировать, невозможно оксигенировать” необходимо выполнить эксренную коникотомию.
Если пациенту с COVID-19 требуется экстренная интубация трахеи, то перед обеспечением проходимости дыхательных путей члены бригады должны надеть средства индивидуальной защиты (СИЗ). Гипоксическому пациенту может потребоваться щадящая вентиляция легких с применением дыхательной маски, чтобы дать больше времени пациенту и клиницистам.
Поместите вирусно-бактериальные фильтры твердых частиц воздуха между лицевой маской или эндотрахеальной трубкой и дыхательным контуром, как только пациент будет подключен к аппарату искусственной вентиляции легких. Следует избегать разгерметизации и отключения дыхательного контура, чтобы предотвратить распространение вируса.
![]()
Желая поднять только одну тему, обозначенную в названии, авторы статьи невольно затронули сразу несколько вопросов, требующих обсуждения. Поэтому и дискуссия может получиться многоплановой. Здесь и вопрос о назоинтестинальной интубации вообще, и вопрос о так называемой интубации после операции по поводу язвенного пилородуоденального стеноза.
По поводу терминологии.
По поводу длительности назоинтестинальной интубации.
Если мы говорим о типичной назоинтестинальной интубации с целью декомпрессии кишечника, то здесь необходим, по меткому замечанию авторов, компромисс между клинической значимостью интубации и рисками побочных эффектов (и осложнений) этой процедуры.
По мнению большинства хирургов, длительность пребывания назоинтестинального зонда не должна превышать 5-7 суток, так как более длительное пребывание зонда сопровождается риском различных осложнений [2, 3, 4] (Дедерер Ю. М. , 1977; Иванов А. С. , 2004; Лаберко Л. А. и соавт. , 2004). Особенно часто развиваются осложнения со стороны дыхательной и сердечно-сосудистой систем. Наиболее грозными из них являются послеоперационная пневмония и острый инфаркт миокарда. Э. А. Нечаев [5] указывает, что после выполнения назоинтестинальной интубации пневмония развивается на 5% чаще (22, 1%), чем после декомпрессии открытыми методами. Особенно высок риск развития этих осложнений после операций у лиц пожилого и старческого возраста, что заставляет некоторых авторов отказаться от назоинтестинальной интубации у данных групп пациентов, заменяя её однократным лаважем. Нельзя сбрасывать со счетов и риск пролежня от зонда, который изготавливается из довольно упруго эластичного материала (иначе его невозможно будет провести через дуоденальный и дуоденоеюнальный изгибы). Повреждению кишки при интубации могут способствовать травматичность манипуляции и выраженный инфильтративно-спаечный процесс в брюшной полости, приводящие к десерозированию стенки кишки. В этих условиях даже термолабильный зонд может оказаться небезопасным при длительном нахождении. Безусловно, усугубляют ситуацию применение зондов, приготовленных из неприспособленных трубок и не имеющих оливы. Именно поэтому практически все хирурги стремятся сократить пребывание зонда в желудочно-кишечном тракте. Многим удается уменьшить этот показатель до 3-4 суток [6].
От цели установки зонда будет зависеть и характер устанавливаемого зонда, что в свою очередь также влияет на вероятность осложнений. Для декомпрессии будет, конечно, целесообразен зонд с достаточно широким просветом. Однако длительное пребывание именно такого зонда наиболее опасно.
По поводу интубации тонкой кишки при панкреонекрозе.
В самом же начале статьи авторы смешивают главное показание к назоинтестинальной интубации (декомпрессия по поводу энтеральной недостаточности) с возможностью раннего энтерального питания у больных в острую фазу деструктивного панкреатита. В такой ситуации надо опять же четко дифференцировать цель установки назоинтестинального зонда и предполагаемый вид лечения в ближайшее время – консервативное или оперативное.
Традиционно в современной литературе установка тонкого зонда за связку Трейтца у больных с панкреонекрозом ассоциируется с необходимостью нутритивной поддержки, что не только является источником питательных веществ, но и снижает риск инфицирования некротизированных тканей вследствие бактериальной транслокации из кишечника.
Однако следует помнить об имеющемся при остром панкреатите в фазе ферментной токсемии парезе желудка и ободочной кишки. Поэтому первоочередной задачей будет желудочный зонд для декомпрессии, так как парез верхних отделов кишечника противоречит концепции раннего начала энтерального питания через зонд, стоящий практически сразу же за связкой Трейтца. Нельзя согласиться с тезисом автора, что нахождение энтерального зонда для питания теоретически должно перекрывать сроки гастродуоденального пареза.
Когда мы говорим о значительном продвижении энтерального зонда по кишке, подразумевается, что зонд проводится под визуальным контролем непосредственно рукой хирурга во время лапаротомии по поводу острого панкреатита. Но здесь также необходимо дифференцировать цель установки зонда. Шинирование кишечника по поводу паралитической кишечной непроходимости при панкреатогенном перитоните не позволит использовать установленный зонд в последующем для питания. Такой зонд подлежит извлечению в указанные выше сроки.
По поводу интубации кишки с целью декомпрессии анастомоза.
Если вести речь в целом об интестинальной интубации, то весь спектр возможностей не ограничивается только назоинтестинальной интубацией в ортоградном направлении, особенно если нам нужна декомпрессия зоны кишечного анастомоза или кишечного шва. В зависимости от локализации анастомоза шинирование осуществляют, выводя зонд наружу не только через нос, но и через тонкую кишку (энтеростома по типу Майдля), ободочную кишку (колостома), слепую кишку (цекостома) или анус.
Вариант ортоградной или ретроградной интубации через наложенную выше или ниже анастомоза стому заслуживает отдельного обсуждения. При этом дренажная рубка должна заходить за анастомоз не более чем на 10-15 см с тем, чтобы хорошо дренировать, главным образом, область анастомоза, а при удалении трубки не травмировать анастомоз. На наш взгляд, то, как введен интестинальный зонд (в ортоградном или ретроградном направлении), особого значения не имеет, так как к тому времени, когда кишка начинает нормально перистальтировать и может сместить трубку, последняя может быть уже удалена.
Большинство хирургов совершенно справедливо являются противниками множественных отверстий на протяжении большей части длинника зонда. Это требование легко выполнить, если зонд изготавливается хирургом непосредственно во время операции из имеющихся полихлорвиниловых трубок. Если же в арсенале хирурга имеются зонды заводского изготовления со стандартным количеством отверстий, это требует постоянного контроля со стороны хирурга за уровнем расположения последнего отверстия. Оно не должно оказаться на уровне желудка или двенадцатиперстной кишки, в противном случае эвакуирующееся из дистальных отделов кишечное содержимое будет опорожняться в желудок и двенадцатиперстную кишку, вызывая рвоту и впечатление некупирующейся кишечной непроходимости. Все это заставляет устанавливать дополнительный зонд в желудок для удаления попадающего туда химуса. Особенно это важно контролировать, если пациенту выполнена обширная резекция тонкой кишки, и в оставшихся петлях не могут разместиться все боковые отверстия стандартного фабричного (с оливой на конце) зонда. В таких ситуациях следует предпочесть самостоятельно изготовленный зонд, необходимой длины и с необходимым количество боковых отверстий.
Основная задача хирурга – осуществить декомпрессию, прежде всего, в области анастомоза. Если в трубке имеется множество отверстий, то никогда нельзя быть уверенным в том, что она остается проходимой на всем протяжении до области анастомоза. В том случае, если конец трубки забивается кишечным содержимым, дренаж части кишки будет продолжать осуществляться, но дренирования наиболее необходимого нам участка, т. е. области анастомоза, может не быть. Даже вводя в зонд рентгеноконтрастное вещество, хирург не сможет установить, работает зонд или нет, поскольку оно будет вытекать из многочисленных отверстий и не дойдет до конца. По этой же причине зонд не удастся полностью промыть, чтобы восстановить ее проходимость.
Поэтому если назоинтестинальная интубация необходима для декомпрессии кишечного анастомоза, боковых отверстий должно быть столько, чтобы выше и ниже анастомоза располагалось по 3-4 боковых отверстия с интервалом 3-4 см. При небольшом количестве боковых отверстий можно будет абсолютно точно установить, работает ли дренаж, а если он забился – восстановить его проходимость, подавая по нему жидкость под напором.
По поводу послеоперационной кишечной непроходимости на фоне назоинтестинальной интубации.
Выполнение назоинтестинальной интубации требует профилактики развития острой послеоперационной кишечной непроходимости. И здесь следует выделить две стороны проблемы: предупреждение развития послеоперационного пареза кишечника и предупреждение развития механической непроходимости.
Причиной первого состояния может быть травматизация и раздражение рефлексогенных участков (корень брыжейки тонкой кишки, ретроцекальное пространство и брыжейка терминального отдела подвздошной кишки), повреждение нервных стволов, ответственных за моторику желудка и кишечника, инфицирование брюшной полости. Логично и не вызывает сомнения, что выраженность пареза прямо пропорциональна объему операции. Иными словами, чем больше хирург манипулирует в животе, тем более выраженным оказывается послеоперационный илеус. Отсюда следует не только требование нежного обращения с этими отделами во время операции. У таких пациентов целесообразна до- или послеоперационная катетризация перидурального пространства как с целью обезболивания, так и стимуляции перистальтики.
Вторая проблема решается за счет бережного укладывания интубированных петель тонкой кишки, максимально приближенному к естественному их расположению. Это тем более актуально, чем более жестким является материал, из которого изготовлен интестинальный зонд. Упругие свойства последнего могут препятствовать правильному расположению кишечных петель.
Особого отношения требует уход за интестинальным зондом. Одно из описываемых осложнений – пролежень кишки от зонда – может быть объяснен созданием отрицательного внутрикишечного давления во время частой аспирации кишечного содержимого. Нет никакого резона присоединять зонд к аспиратору, если по интубатору самостоятельно и активно поступает кишечное содержимое. Если у больного есть признаки закупорки зонда кишечным содержимым, то попытка активной аспирации не улучшит ситуацию. Предварительно необходимо промыть зонд физиологическим раствором, а уже потом эвакуировать электроотсосом скопившееся кишечное содержимое и излишки введенной жидкости. В большинстве случаев после промывания дренажа налаживается самостоятельный отток химуса.
По поводу тактики при послеоперационном парезе.
Говоря о длительности пребывания зонда в рамках данной дискуссионной статьи, нельзя не затронуть вопрос о течении послеоперационного периода.
Что делать, если, несмотря на наличие назоинтестинальной интубации, у больного на 5-7-е сутки послеоперационного периода сохраняется обильное отделяемое по зонду? На наш взгляд, в таком случае удерживать зонд более 5-7 суток бессмысленно. Он создает ложное впечатление о хорошей декомпрессии.
Дело в том, что при благоприятном течении функция кишечника на зонде должна восстановиться самостоятельно к 3-му, максимум к 4-му дню, и у больного должно уменьшиться отделяемое по зонду, появиться отчетливая перистальтика и отчетливое отхождение газов.
Однако сохраняющийся при наличии зонда парез желудочно-кишечного тракта более 5-6 дней свидетельствует о неблагополучном течении послеоперационного периода.
Оперирующему хирургу в случае отсутствия заметного прогресса в состоянии такого больного свойственен некоторый консерватизм и стремлении расценить ситуацию скорее как паралитический илеус. Но такой подход опасен и может привести к тяжелым последствиям.
Во-первых, могут быть диагностические ошибки, когда за послеоперационный парез принимают острую механическую кишечную непроходимость, развившуюся вследствие недостаточно адекватного укладывания интубированных петель, перегиба самого зонда и, соответственно, перегиба петель (вплоть до заворота кишечника), сдавления кишечной трубки воспалительным инфильтратом. Нельзя сбрасывать со счетов и технические ошибки: захватывание в шов стенки кишки при зашивании брюшной стенки, забытые инородные тела, оставление без соответствующей коррекции имеющихся спаек, инфильтрата или опухоли, вызвавших непроходимость и расположенных ниже дистального конца установленного зонда. Тем более, что мы знаем, что нанизанная на зонд кишка имеет свойство расправляться и соскальзывать, а дистальный конец зонда – мигрировать в проксимальном направлении.
Во-вторых, имевшийся в начале парез кишечника, по поводу которого и была произведена назоинтестинальная интубация, сам может оказаться причиной развития острой механической непроходимости кишечника.
В-третьих, длительно существующий парез кишечника может перейти в уже необратимое состояние – паралич кишечника.
В-четвертых, парез кишечника способствует появлению таких осложнений как пневмония, полная или неполная эвентрация, образование дефектов по линии шва апоневроза с последующим формированием вентральных грыж и проч.
В-пятых, парез кишечника иногда может быть единственным признаком вялотекущего гнойного перитонита (вторичного или третичного), а несвоевременное распознавание причин пареза может привести к самым тяжелым последствиям.
Здесь надо обратить внимание еще и на то, что дифференциальный диагноз между затянувшимся послеоперационным парезом кишечника и ранней механической кишечной непроходимостью крайне труден, поскольку симптоматология их в первые дни после операции практически одинакова.
Казалось бы, единственно полезным дифференциально-диагностическим симптомом могли быть боли в животе схваткообразного характера, усиленная перистальтика и асимметрия живота. К сожалению, в условиях назоинтестинальной интубации ни один из симптомов не может быть информативен: схваткообразный характер боли сменяется довольно быстро болью постоянного характера, перистальтика быстро истощается, а асимметрия не визуализируется на фоне интубации кишки. Поэтому следует обращать внимание на другие достоверные признаки: прогрессирующее вздутие живота, не уменьшающееся количество отделяемого по зонду, отсутствие пневматизации толстой кишки. Эти признаки выявляются уже в первые 3-4 дня в условиях адекватного восполнения гиповолемии, коррекции электролитных нарушений, стимуляции перистальтики.
Консервативное лечение, направленное на стимуляцию перистальтики, может и должно быть предпринято в таких ситуациях. Впрочем, оно должно проводиться сразу же после операции, не дожидаясь критически затянувшегося пареза.
Тем не менее, если это не было сделано ранее, пациенту необходимо:
1) поставить дополнительно назогастральный зонд, чтобы исключить вероятность поступления кишечного содержимого через боковые отверстия на уровне желудка;
2) тщательно выявить и корригировать потенциальные причины продолжающегося илеуса: а) исключить чрезмерные дозы опиатов, которые могут способствовать илеусу; б) корригировать электролитный баланс; в) оценить, не являются ли причиной паралитического илеуса внутрибрюшные осложнения, такие как гематома, абсцесс, несостоятельность анастомоза, послеоперационный панкреатит (они могут маскировать тонкокишечную механическую непроходимость), и выполнить компьютерную томографию; г) корригировать гипоальбуминемию, которая может приводить к генерализованным отекам, в том числе и кишечной стенки.
В результате только консервативного лечения стойкий эффект может быть получен у 80% больных. Вместе с тем, чрезмерное увлечение консервативным лечением опасно, поскольку в ситуациях, когда необходимо оперативное вмешательство, это может привести к задержке лапаротомии. Поэтому если встает вопрос о сохранении пареза на фоне назоинтестинальной интубации через 5-7 дней, все надежды на более длительное оставление назоинтестинального зонда, как средство купирования послеоперационного илеуса, бесперспективны, и все сомнения должны быть разрешены в пользу релапаротомии.
По поводу зондов при оперативном лечении суб- и декомпенсированного язвенного стеноза.
Таким образом, вопрос о длительной назоинтестинальной интубации мы бы рассматривали только с точки зрения лечения существующего пареза кишечника на фоне любого вида кишечной непроходимости, с точки зрения профилактики послеоперационной паралитической кишечной непроходимости, а также с позиции защиты межкишечного анастомоза. Когда мы говорим о кормлении после операции, речь должна идти о зондовом энтеральном питании (через зонд, установленный за связку Трейтца), и в понятие назоинтестинальной интубации это не входит.
1. Энциклопедический словарь медицинских терминов. – М.: Медицина, 1984. - Том 1. – С. 418.
2. Дедерер Ю. М. Патогенез и лечение острой непроходимости кишечника. – М.: Медицина, 1971. – 272 с.
3. Иванов А. С. Осложнения назоинтестинальной интубации при острой кишечной непроходимости: Дис…канд. мед. наук (14. 00. 27). – Санкт-Петербург, 2004. – 118 с.
4. Лаберко Л. А. , Кузнецов Н. А. , Аронов Л. С. и др. Коррекция проявлений синдрома энтеральной недостаточности при распространенном перитоните // Хирургия. - 2004. - №9. - С. 25-28.
5. Нечаев Э. А. , Курыгин А. А. , Ханевич М. Д. Дренирование тонкой кишки при перитоните и кишечной непроходимости. - СПб. : Росмедполис, 1993. - 238 с.
6. Сапожков А. Ю. , Никольский В. И. Декомпрессия кишечника. –Пенза, 1992. –137 с.
7. Шайн М. Здравый смысл в неотложной абдоминальной хирургии. Пер. с англ. – М.: ГЭОТАР-Мед, 2003. – 272 с.
Читайте также:
- Ларингоскоп с клинками разных типов (проверьте, горят ли лампочки)