Как сделать фторид серы
Добавил пользователь Morpheus Обновлено: 05.10.2024
Гексафторид серы (также элегаз или шестифтористая сера, SF6) — неорганическое вещество, при нормальных условиях тяжёлый газ, в 5 раз тяжелее воздуха. Соединение было впервые получено и описано в 1900 году Анри Муассаном в ходе работ по изучению химии фтора.
Содержание
Методы получения
Возможно получать гексафторид серы из простых веществ:
Также гексафторид серы образуется при разложении сложных фторидов серы:
\mathsf \rightarrow SF_6 + SF_4>
Физико-химические свойства
Практически бесцветный газ, обладающий высоким пробивным напряжением (89 кВ/см). Электрическая прочность элегаза зависит от давления, она в 2—4 раза выше, чем у воздуха. В нём содержится 21,95 % серы и 78,05 % фтора. При нормальном давлении элегаз может находиться в любом из трёх агрегатных состояний при температуре до минус 50,8 °С. К:Википедия:Статьи без источников (тип: не указан) [источник не указан 2338 дней] [прояснить]
Плохо растворим в воде (1 объём SF6 в 200 объёмах воды), этиловом спирте и диэтиловом эфире [1] , хорошо растворим в нитрометане.
Плотность элегаза при T=273 K и давлении р=0,1 МПа составляет 6,56 кг/м³. Относительная диэлектрическая проницаемость — 1,0021. Полное число степеней свободы молекулы элегаза равно 21, из них три степени свободы — в поступательном движении, три — во вращательном, а остальные — в колебательном. Диаметр молекулы равен 5,33 Å.
Термодинамические величины
| Свойство | Значение при н. у. (газ) |
|---|---|
| Энтальпия образования | −1219 кДж/моль |
| Энтропия образования | 291,6 Дж/(моль·К) |
| Теплоёмкость | 97,15 Дж/(моль·К) [2] |
| Теплопроводность | 12,058 мВт/(м·К) [2] |
| Критическая температура | 318,7 К |
| Критическое давление | 3,71 МПа |
Химические свойства
Гексафторид серы — достаточно инертное соединение, не реагирует с водой, вероятно, из-за кинетических факторов. Не реагирует также с растворами HCl и NaOH [3] , однако при действии восстановителей могут протекать некоторые реакции.
Взаимодействие с металлическим натрием проходит только при нагревании, однако уже при 64 °C взаимодействует с раствором натрия в аммиаке.
С водородом и кислородом гексафторид не реагирует. Однако, при сильном нагревании (до 400 °C) SF6 взаимодействует с сероводородом, а при 30 °C — с иодоводородом:
При повышенном давлении и температуре около 500 °C SF6 окисляет PF3 до PF5:
Применение
- как изолятор и теплоноситель в высоковольтной электротехнике;
- как технологическая среда в электронной и металлургической промышленности;
- в системах газового пожаротушения в качестве пожаротушащего вещества;
- как хладагент благодаря высокой теплоёмкости, низкой теплопроводности и низкой вязкости[4] ;
- для улучшения звукоизоляции в стеклопакетах;
- в полупроводниковой промышленности для плазмохимического травления кремния.
При вдыхании наблюдается эффект пониженной тональности голоса, противоположный действию гелия [5] .
Применение в электротехнике
Электрическая прочность при атмосферном давлении и зазоре 1 см составляет 89 кВ/см. Характерным является очень большой коэффициент теплового расширения и высокая плотность. Это важно для энергетических установок, в которых проводится охлаждение каких-либо частей устройства, так как при большом коэффициенте теплового расширения легко образуется конвективный поток, уносящий тепло [8] .
В центре молекулы элегаза расположен атом серы, а на равном расстоянии от него в вершинах правильного октаэдра располагаются шесть атомов фтора. Это определяет высокую эффективность захвата электронов молекулами, их относительно большую длину свободного пробега и слабую реакционную способность. Поэтому элегаз обладает высокой электрической прочностью.
Элегаз безвреден в смеси с воздухом. Однако вследствие нарушения технологии производства элегаза или его разложения в аппарате под действием электрических разрядов (дугового, коронного, частичных), в элегазе могут возникать чрезвычайно активные в химическом отношении и вредные для человека примеси, а также различные твёрдые соединения, оседающие на стенах конструкции. Интенсивность образования таких примесей зависит от наличия в элегазе примесей кислорода и особенно паров воды.
Некоторое количество элегаза в электротехнической аппаратуре также разлагается в процессе нормальной работы. Например, коммутация тока 31,5 кА в выключателе 110 кВ приводит к разложению 5—7 см³ элегаза на 1 кДж выделяемой в дуге энергии.
Стоимость элегаза довольно высока, однако он нашёл достаточно широкое применение в технике, особенно в высоковольтной электротехнике. Он прежде всего используется как диэлектрик, то есть в качестве основной изоляции для комплектных распределительных устройств, высоковольтных измерительных трансформаторов тока и напряжения и др [9] . Также элегаз используется как среда дугогашения в высоковольтных выключателях [10] .
- взрыво- и пожаробезопасность;
- снижения массо-габаритных показателей конструкции за счёт уменьшения изоляционных промежутков и улучшенных условий охлаждения токоведущих частей К:Википедия:Статьи без источников (тип: не указан)[источник не указан 3090 дней] .
Регламентирующие стандарты
- IEC 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- IEC 60480:2004 — Руководство по проверке и обработке серы шестифтористой (SF6), взятой из электротехнического оборудования, и технические условия на её повторное использование.
- EN 60376:2005 — Технические условия на элегаз (SF6) технического сорта для электрического оборудования.
- EN 60480:2004 — Руководство по проверке и обработке элегаза (SF6), взятого из электротехнического оборудования, и технические условия на его повторное использование.
Вредное воздействие
По степени воздействия на организм человека относится к малоопасным веществам (4-й класс согласно ГОСТ 12.1.007-76).
Имеется возможность отравления продуктами распада элегаза (низшими фторидами), образующимися, например, при работе дугогасительных камер в высоковольтных выключателях.
Потенциал разрушения озонового слоя ODP = 0.
Потенциал глобального потепления GWP = 24 900 (регламентируется Киотским протоколом).
Интересные факты
Напишите отзыв о статье "Фторид серы(VI)"
Примечания
Литература
См. также
Отрывок, характеризующий Фторид серы(VI)
– Осмелюсь доложить вашему сиятельству, что грубый народ здешний не желает выпустить госпожу из имения и угрожает отпречь лошадей, так что с утра все уложено и ее сиятельство не могут выехать.
– Не может быть! – вскрикнул Ростов.
– Имею честь докладывать вам сущую правду, – повторил Алпатыч.
Ростов слез с лошади и, передав ее вестовому, пошел с Алпатычем к дому, расспрашивая его о подробностях дела. Действительно, вчерашнее предложение княжны мужикам хлеба, ее объяснение с Дроном и с сходкою так испортили дело, что Дрон окончательно сдал ключи, присоединился к мужикам и не являлся по требованию Алпатыча и что поутру, когда княжна велела закладывать, чтобы ехать, мужики вышли большой толпой к амбару и выслали сказать, что они не выпустят княжны из деревни, что есть приказ, чтобы не вывозиться, и они выпрягут лошадей. Алпатыч выходил к ним, усовещивая их, но ему отвечали (больше всех говорил Карп; Дрон не показывался из толпы), что княжну нельзя выпустить, что на то приказ есть; а что пускай княжна остается, и они по старому будут служить ей и во всем повиноваться.
В ту минуту, когда Ростов и Ильин проскакали по дороге, княжна Марья, несмотря на отговариванье Алпатыча, няни и девушек, велела закладывать и хотела ехать; но, увидав проскакавших кавалеристов, их приняли за французов, кучера разбежались, и в доме поднялся плач женщин.
– Батюшка! отец родной! бог тебя послал, – говорили умиленные голоса, в то время как Ростов проходил через переднюю.
Княжна Марья, потерянная и бессильная, сидела в зале, в то время как к ней ввели Ростова. Она не понимала, кто он, и зачем он, и что с нею будет. Увидав его русское лицо и по входу его и первым сказанным словам признав его за человека своего круга, она взглянула на него своим глубоким и лучистым взглядом и начала говорить обрывавшимся и дрожавшим от волнения голосом. Ростову тотчас же представилось что то романическое в этой встрече. «Беззащитная, убитая горем девушка, одна, оставленная на произвол грубых, бунтующих мужиков! И какая то странная судьба натолкнула меня сюда! – думал Ростов, слушяя ее и глядя на нее. – И какая кротость, благородство в ее чертах и в выражении! – думал он, слушая ее робкий рассказ.
Когда она заговорила о том, что все это случилось на другой день после похорон отца, ее голос задрожал. Она отвернулась и потом, как бы боясь, чтобы Ростов не принял ее слова за желание разжалобить его, вопросительно испуганно взглянула на него. У Ростова слезы стояли в глазах. Княжна Марья заметила это и благодарно посмотрела на Ростова тем своим лучистым взглядом, который заставлял забывать некрасивость ее лица.
– Не могу выразить, княжна, как я счастлив тем, что я случайно заехал сюда и буду в состоянии показать вам свою готовность, – сказал Ростов, вставая. – Извольте ехать, и я отвечаю вам своей честью, что ни один человек не посмеет сделать вам неприятность, ежели вы мне только позволите конвоировать вас, – и, почтительно поклонившись, как кланяются дамам царской крови, он направился к двери.
Почтительностью своего тона Ростов как будто показывал, что, несмотря на то, что он за счастье бы счел свое знакомство с нею, он не хотел пользоваться случаем ее несчастия для сближения с нею.
Княжна Марья поняла и оценила этот тон.
– Я очень, очень благодарна вам, – сказала ему княжна по французски, – но надеюсь, что все это было только недоразуменье и что никто не виноват в том. – Княжна вдруг заплакала. – Извините меня, – сказала она.
Ростов, нахмурившись, еще раз низко поклонился и вышел из комнаты.
Ростов, не желая навязывать свое знакомство княжне, не пошел к ней, а остался в деревне, ожидая ее выезда. Дождавшись выезда экипажей княжны Марьи из дома, Ростов сел верхом и до пути, занятого нашими войсками, в двенадцати верстах от Богучарова, верхом провожал ее. В Янкове, на постоялом дворе, он простился с нею почтительно, в первый раз позволив себе поцеловать ее руку.
– Как вам не совестно, – краснея, отвечал он княжне Марье на выражение благодарности за ее спасенье (как она называла его поступок), – каждый становой сделал бы то же. Если бы нам только приходилось воевать с мужиками, мы бы не допустили так далеко неприятеля, – говорил он, стыдясь чего то и стараясь переменить разговор. – Я счастлив только, что имел случай познакомиться с вами. Прощайте, княжна, желаю вам счастия и утешения и желаю встретиться с вами при более счастливых условиях. Ежели вы не хотите заставить краснеть меня, пожалуйста, не благодарите.
Но княжна, если не благодарила более словами, благодарила его всем выражением своего сиявшего благодарностью и нежностью лица. Она не могла верить ему, что ей не за что благодарить его. Напротив, для нее несомненно было то, что ежели бы его не было, то она, наверное, должна была бы погибнуть и от бунтовщиков и от французов; что он, для того чтобы спасти ее, подвергал себя самым очевидным и страшным опасностям; и еще несомненнее было то, что он был человек с высокой и благородной душой, который умел понять ее положение и горе. Его добрые и честные глаза с выступившими на них слезами, в то время как она сама, заплакав, говорила с ним о своей потере, не выходили из ее воображения.
Когда она простилась с ним и осталась одна, княжна Марья вдруг почувствовала в глазах слезы, и тут уж не в первый раз ей представился странный вопрос, любит ли она его?
По дороге дальше к Москве, несмотря на то, что положение княжны было не радостно, Дуняша, ехавшая с ней в карете, не раз замечала, что княжна, высунувшись в окно кареты, чему то радостно и грустно улыбалась.
«Ну что же, ежели бы я и полюбила его? – думала княжна Марья.
Как ни стыдно ей было признаться себе, что она первая полюбила человека, который, может быть, никогда не полюбит ее, она утешала себя мыслью, что никто никогда не узнает этого и что она не будет виновата, ежели будет до конца жизни, никому не говоря о том, любить того, которого она любила в первый и в последний раз.
Сера - элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов - элементов VIa группы.
Сера - S - простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

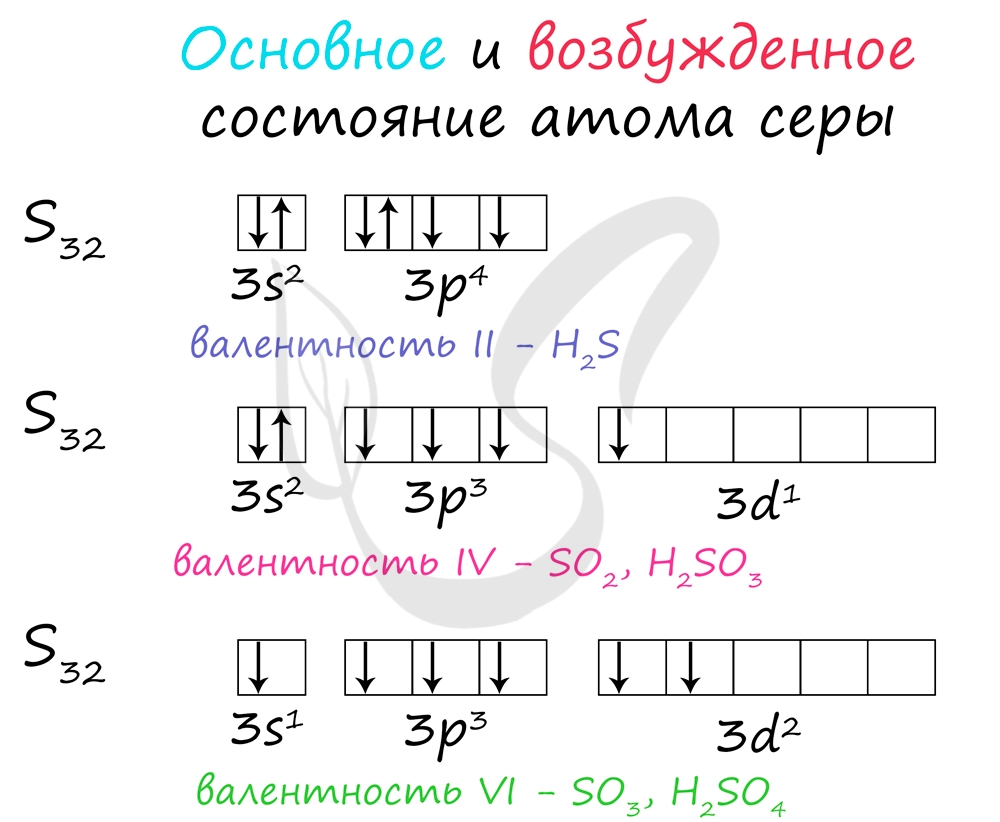
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Природные соединения
- FeS2 - пирит, колчедан
- ZnS - цинковая обманка
- PbS - свинцовый блеск (галенит), Sb2S3 - сурьмяный блеск, Bi2S3 - висмутовый блеск
- HgS - киноварь
- CuFeS2 - халькопирит
- Cu2S - халькозин
- CuS - ковеллин
- BaSO4 - барит, тяжелый шпат
- CaSO4 - гипс
В местах вулканической активности встречаются залежи самородной серы.

В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
-
Реакции с неметаллами
На воздухе сера окисляется, образуя сернистый газ - SO2. Реагирует со многими неметаллами, без нагревания - только со фтором.

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.

Сероводород - H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.

Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Сероводород - сильный восстановитель (сера в минимальной степени окисления S 2- ). Горит в кислороде синим пламенем, реагирует с кислотами.

Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
Оксид серы - SO2
Сернистый газ - SO2 - при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
С основными оксидами, основаниями образует соли сернистой кислоты - сульфиты.

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
В реакциях с основными оксидами, основаниями образует соли - сульфиты и гидросульфиты.
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота - основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.

Оксид серы VI - SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия - Pr, V2O5).
В лабораторных условиях разложением солей серной кислоты - сульфатов.
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли - сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке - средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке - кислая соль)

SO3 - сильный окислитель. Чаще всего восстанавливается до SO2.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Сера -расположена в главной подгруппе(в третьем ряду ) шестой группы(смотреть наверх) и в третьем периоде(смотреть налево) периодической системы.

на внешнем энергетическом уровне 6 электронов, они валентны( способный к образованию химических связей).Для завершения внешнего уровня(внешний уровень состоит из 6 электронов) атому не достает двух электронов,чтобы перейти в восьмую группу , (это вечная борьба за лучшее место под солнцем :),поэтому в соединениях с водородом (H) и металлами она проявляет низшую степень окисления -2:
s+2e= s2- ( Сера забирает(прибавляет) и становится плохим,отрицательным. Так всегда поступают неметаллы, забирая у металлов электроны.)
Сероводорот H2S-ядовитый газ с запахом тухлых яиц.При взаимодействии с кислородом(О), фтором(F) и хлором(Cl) сера отдает валентные электроны :
s-4е=s4+(Отдал, стал хорошим , положительным)
При потере всех шести электронов она переходит в максимальную степень окисления +6:
Происхождение названия

Природные минералы серы
Сера является шестнадцатым по химической распространённости элементом в земной коре . Встречается в свободном (самородном) состоянии и связанном виде, в виде соединений сульфатов( соль серной кислоты, H 2 SO 4, к широко распространенный сульфатам относятся сульфат меди (II) (CuSO4)выглядит так:

и сульфат железа (II) (FeSО4) .

:
Сульфат это белая глауберова соль, настолько белая,что летом при солнечном свете на нее нельзя смотреть, не рискуя повредить глаз.

и сульфидов( химическое соединение получаемое из СУЛЬФИДА ВОДОРОДА, H2S, в котором другой химический элемент или их группа замещает водород. Примером неорганического сульфида служит сульфид свинца, PbS.).

1 камень сульфид свинца(галенит или свинцовый блеск),2 ртути(киноварь),3 железа(пирит или железный колчедан),4 цинка(бленда).
В виде органических соединений сера содержится в нефти,каменном угле,входит в состав белков.
Свойства
сера представляет собой светло-желтый порошок. Сера тяжелее воды и не растворима в ней ,но при высыпании в воду не тонет , а плавает на ее поверхности, так как не смачивается водой.


в твердом виде сера состоит из молекул s8, по форме напоминающую корону.

При нагревании сера плавится превращаясь в подвижную светло-желтую жидкость, состоящую из молекул s8.При дальнейшем нагревании жидкость темнеет,становясь буро-красной, загустевает , а затем снова приобретает подвижность.
(расплавленная сера горит. На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом " />
)
Если кипящую серу аккуратно вылить в сосуд с холодной водой , она превращается в эластичный полимер ,похожий на резину.Такая сера называется пластической,в отличие от обычной-ромбической.Пластическая сера состоит из длинных цепочек.Она неустойчива и за несколько часов вновь превращается в ромбическую серу.Пластическая и ромбическая сера - это аллотропные модификации серы.
(пластическая сера )(ромбическая сера)
Химические свойства
Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только со фтором:
" />
(интересное:фторид серы - SF6 (или как его еще называют “элегаз“), газ который тяжелее воздуха в пять раз. При вдыхании он вызывает эффект понижения голоса. Даже человек с писклявым голосом, способен заговорить голосом Дарта Вейдера, воспользовавшись волшебным баллончиком с фторидом серы). Расплав серы реагирует с хлором , при этом возможно образование двух низших хлоридов: " height="" />
" height="" />
При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора, среди которых — высший сульфид P2S5:


Кроме того, при нагревании сера реагирует с водородом, углеродом, кремнием:
" />
(сероводород) (Газ с характерным запахом тухлых яиц.Очень токсичен. Вдыхание воздуха с небольшим содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу) " />
(сероуглерод) (Обладает психотропными, нейротоксическими свойствами, который наркотически воздействует на центральную нервную систему. При отравлении возникают головная боль, головокружение, судороги, потеря сознания. Бессознательное состояние может сменяться психическим и двигательным возбуждением.При приеме внутрь наступают тошнота, рвота, боли в животе. При контакте с кожей наблюдаются гиперемия и химические ожоги.) (сероуглерод в твердом виде)
При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды(класс химических соединений, представляющих собой соединения металлов (а также ряда неметаллов В, Si, Р, As) с серой (S), где она имеет степень окисления −2. Могут рассматриваться как соли сероводородной кислоты H2S.):
Биологическая роль " />
" />
" />
" />
. Сернистый натрий Na2S (Сульфи́д желе́за(II) — сложное неорганическое вещество с химической формулой FeS .) серни́стой кислотыСимптомыотравлениинасморккашельохриплостьудушьервотаотёклёгких
Растворяется в воде с образованием нестойкой H2SO3 ,известную лишь в растворах H2O+SO2=H2SO3.А в свою очередь эта неустойчивая кислота образует Сульфиты(Na2SO3) и гидросульфиты (NaHSO4).SO2 очень токсичен. при сернистым газом — , , , сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — , расстройство речи, затруднение глотания, , возможен острый .Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.Образуются кислотные дожди.Хорошо растворяется в глицерине и спирте.Жидкий сернистый газ растворяет резину и некоторые пластмассы)(Окси́д се́ры(IV)-сернистый газ,бесцветный газ с характерным резким запахом (запах загорающейся спички )
SO3-ангидрид , образуется при каталитическом окислении сернистого газа кислородом ,представляет собой масляную жидкость , со временем превращающуюся в игольчатые кристаллы.Серный ангидрид жадно поглощает воду, превращаясь в серную кислоту : H2O+SO3=H2SO4.Реакция протекает настолько быстро , что на промышленных предприятиях серный ангидрит поглощают крепким раствором серной кислоты ,содержащим всего несколько процентов воды. Так получается олеум-раствор серного ангидрида в концентрированной серной кислоте

.
Сера — один из биогенных элементов. Сера входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), ферментов. Сера участвует в образовании третичной структуры белка. Также сера участвует в бактериальном фотосинтезе (сера входит в состав бактериохлорофилла, а сероводород является источником водорода). Окислительно-восстановительные реакции серы — источник энергии в хемосинтезе.
Человек содержит примерно 2 г серы на 1 кг своего веса.
Применение
примерно 90% добываемой серы расходуется на производство серной кислоты.Сера используется при получении резины,органических красителей,лекарственных препаратов,входит в состав пороха и других пиротехнических смесей.
Чтобы предотвратить нежелательные последствия изменения климата, человечество должно отказаться от сжигания ископаемого топлива, которое генерирует слишком много парниковых газов. Оказывается, однако, что переход на альтернативные источники энергии может привести к попаданию в атмосферу гораздо более вредного агента.
Это гексафторид серы (SF6) – газ, молекула которого состоит из одного атома серы и шести атомов фтора. Если вы обладаете навыками поиска информации в Интернете, то легко найдёте там видеоролики, на которых запечатлены веселые забавы с этим веществом. Газ не имеет запаха, бесцветен и тяжелее воздуха, поэтому может использоваться как антипод гелия - если тот делает голос человека, вдохнувшего его, выше, то SF6 добавляет в него густых басов. Кроме того, он не очень реактивен, благодаря чему применяется для предотвращения пожаров - вытесняя воздух, который питает пламя.

Рената Литвинова изменяет голос
Благодаря этим свойствам гексафторид серы активно используется в промышленности, в частности внутри высоковольтных распределительных устройств. Это помогает избегать нежелательных огненных фейерверков и серьезных аварий. Спрос на SF6 растёт вместе с увеличением производства электричества. И какой бы заковыристой ни была здесь логика, но чем больше энергии мы вырабатываем, даже из возобновляемых источников, тем больше гексафторида серы производим. Недавнее исследование британских учёных показало, что энергосистема их родины каждый год увеличивает потребление SF6 на 30-40 тонн, а во всём мире к 2030 году этот объём возрастёт на 75% .
Проблема в том, что это фторосодержащий газ, а вся эта группа относится к парниковым. Более того, среди своих сородичей гексафторид серы отличается самым мощным воздействием на воздушную среду - потенциально он в 23500 раз вреднее углекислого газа. А так как это синтетическая молекула, она не расщепляется и не поглощается под влиянием естественной среды, поэтому остаётся в атмосфере в течение тысяч лет. Всё это означает, что даже небольшое количество SF6 может оказаться непропорционально опасным.
Естественно, никто специально не выбрасывает это соединение в атмосферу, разве только любители говорить более низким голосом. Однако оно может вытечь из того контейнера, в котором призвано находиться, и это практически невозможно заметить из-за уже упомянутого отсутствия цвета и запаха. По данным Национального управления океанических и атмосферных исследований, концентрация гексафторида серы в воздушной среде за последние два десятилетия увеличилась более чем вдвое. Выбросы газа в 2017 году в Европе по своему воздействию оказались приблизительно равны тому вреду, который нанесли бы 1.3 миллиона автомобилей.
Насколько всё это страшно? К счастью, особой опасности для человечества в данном случае нет. В 2017 году доля SF6 в промышленных выбросах той же Великобритании составила всего 0.11%. Параллельно учёные ищут альтернативы этому соединению. Для оборудования, работающего со средним напряжением, материалы уже найдены. Некоторые компании переходят на технологии, не требующие использования подобных газов. - например, "Siemens", разработавшая соответствующее высоковольтное распределительное устройство. Компания "Scottish Power Renewables" строит ветряную электростанцию, внутри которой вместо SF6 будут использоваться воздух и вакуум. Приятно то, что из-за особого внимания к этой проблеме утечки SF6 каждый год сокращаются, несмотря на увеличение используемого объёма этого газа.
Читайте также:

